AZD5363诱导肝癌细胞凋亡与自噬的实验研究*
李若彤
(泰安市中心医院病理科, 山东 泰安 271000)
肝细胞癌(hepatocellutar carcinoma,HCC)是消化系统最常见的恶性肿瘤之一,在世界范围内占所有肿瘤发病率的第5 位,且发病率仍在逐年上升。我国是肝癌发病率最高的国家,2015年患病人数约46.6万,而因肝癌死亡的人数达到42.2万人[1]。目前HCC的治疗手段主要是手术和放、化疗等,但由于发病隐匿,多数患者就诊时已失去手术时机;另外,以外科手术为主的治疗模式预后仍不尽人意,使得寻找有效治疗药物一直是肝癌研究的热点[2]。
AZD5363是一种新近合成的Akt抑制剂,能够抑制多种肿瘤细胞增殖,同时能够协同促进LY294002等其它Akt蛋白激酶抑制剂的抗肿瘤活性[3-4]。本研究以肝癌细胞系HepG2和Huh7为研究对象,从AZD5363诱导细胞自噬与其调控肝癌细胞活力和凋亡的相关性入手,检测AZD5363对HepG2和Huh7细胞活力、凋亡及自噬的影响,为AZD5363的临床应用及治疗提供新的实验依据。
材 料 和 方 法
1 实验材料
人肝癌细胞株HepG2和Huh7购自上海中科院生命研究所细胞库。AZD5363购自Selleck Chemicals;Lipofectamine 2000和胎牛血清购自赛默飞世尔科技(中国)有限公司;DNA片段末端标记法(TUNEL)凋亡检测试剂盒购自Roche;抗多腺苷二磷酸核糖聚合酶 [poly(ADP-ribose) polymerase, PARP]抗体购自Cell Signaling Technology;MTT、氯喹(chloroquine,CQ)和抗β-actin抗体购自Sigma;ECL化学发光检测试剂盒购自Millipore;II抗均购自北京中杉金桥生物技术有限公司。
2 实验方法
2.1细胞培养 肝癌HepG2和Huh7细胞用含10%胎牛血清的DMEM培养基,于37 ℃、5% CO2条件下培养,3 d传代1次。
2.2MTT实验检测细胞活力 胰酶消化HepG2细胞和Huh7细胞并接种于96孔板中,过夜培养后加入不同剂量(1.25、2.5、5、10、20、50和100 μmol/L)的AZD5363处理24 h,对照(control)组加入含DMSO的完全培养基。终止培养前4 h于各个孔中加20 μL MTT(5 mg/L)。吸去培养基,加入150 μL的DMSO于室温振荡10 min,最后于490 nm波长下测定各孔吸光度(A)值。以同样的方法测平行孔,并对结果进行统计分析。
2.3TUNEL法观察细胞凋亡 取对数生长期的细胞接种于96孔板中,分别用终浓度为0 μmol/L、20 μmol/L和50 μmol/L的AZD5363处理细胞24 h。室温下用4%甲醇溶液固定细胞1 h,0.1% Triton X-100处理2 min。按照TUNEL凋亡检测试剂盒说明书对细胞进行凋亡染色,倒置荧光显微镜观察细胞TUNEL染色结果。同时取对数生长期的细胞接种于96孔板中,分为CQ(20 μmol/L)组、AZD5363(50 μmol/L)组和CQ(20 μmol/L)+AZD5363(50 μmol/L)组,处理24 h后,采用TUNEL法检测细胞凋亡情况。每组实验重复3次,取平均值。
2.4Western blot实验 HepG2细胞和Huh7细胞经PBS洗涤3次后,用预冷RIPA裂解液冰上裂解细胞30 min, 4 ℃、 12 000 r/min离心25 min,收集上清并用BCA法定量蛋白。经SDS-PAGE分离蛋白,经电泳及转膜将蛋白质电转至硝酸纤维素膜上;再用5%脱脂奶粉封闭过夜,加入I抗,室温过夜孵育后加入II抗,最后ECL显影液曝光显影。实验重复3次。
2.5GFP-LC3融合蛋白表达的观察 用无血清Opti-MEM培养基稀释GFP-LC3质粒和Lipofectamine 2000复合物,混匀后室温孵育30 min,然后加入经Opti-MEM洗涤后的HepG2细胞和Huh7细胞中。在5% CO2孵箱内37 ℃ 孵育6 h后,更换新的完全培养液。转染24 h后,加入不同浓度的AZD5363继续处理24 h,倒置显微镜下观察并拍照。
3 统计学处理
采用SPSS 18.0 统计软件分析,数据用均数±标准差(mean±SD)表示,多组间比较应用单因素方差分析,组间两两比较应用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 AZD5363对HepG2和HUh7细胞活力的抑制作用
MTT实验结果显示,与正常对照组相比,2种肝癌细胞经不同浓度AZD5363作用24 h后,细胞活力均明显下降(P<0.05),表明AZD5363能够剂量依赖性地抑制细胞活力,见图1。
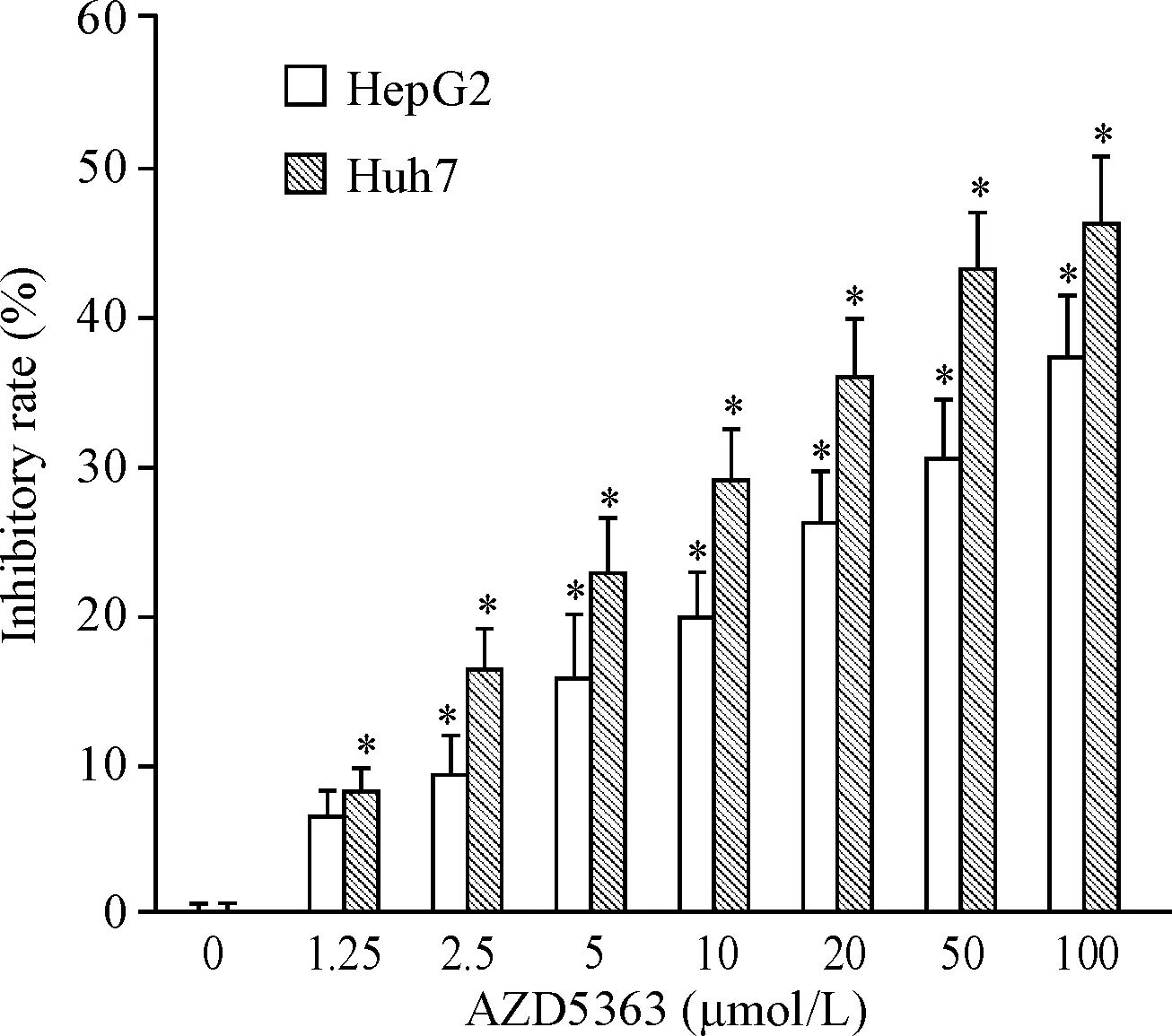
Figure 1.The effect of AZD5363 treatment on the viability of HepG2 and Huh7 cells was determined by MTT assay. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图1AZD5363对HepG2和Huh7细胞活力的抑制作用
2 AZD5363诱导HepG2细胞和Huh7细胞凋亡
采用TUNEL实验检测了AZD5363对细胞凋亡的影响。从结果可以看出,较高剂量(20和50 μmol/L)的AZD5363能够明显诱导肝癌细胞发生凋亡(P<0.05),见图2。
另外,Western blot实验检测发现,20和50 μmol/L AZD5363促进了HepG2细胞和Huh7细胞内PARP的切割(P<0.05),见图3,进一步表明AZD5363能够诱导肝癌细胞发生凋亡。

Figure 2.AZD5363 triggered the apoptosis in hepatocellular carcinoma cells. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图2AZD5363诱导Huh7和HepG2细胞发生凋亡
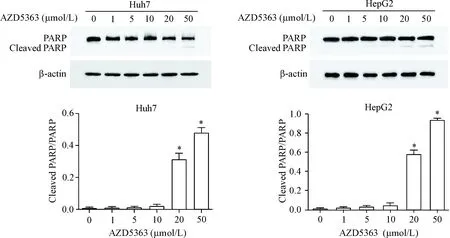
Figure 3.High doses of AZD5363 triggered Huh7 and HepG2 cell apoptosis via activating the cleavage of PARP. The level of PARP cleavage was determined by Western blot analysis. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图3AZD5363诱导Huh7和HepG2细胞内PARP的切割
3 AZD5363诱导肝癌细胞发生自噬
将肝癌细胞转染GFP-LC3表达载体,然后用AZD5363处理细胞24 h,观察细胞自噬的变化。从结果可见,正常对照组细胞中的GFP-LC3 斑点极少,经AZD5363处理后,细胞中的GFP-LC3 斑点显著增多,说明AZD5363可以诱导HepG2细胞及Huh7细胞发生自噬,见图4。
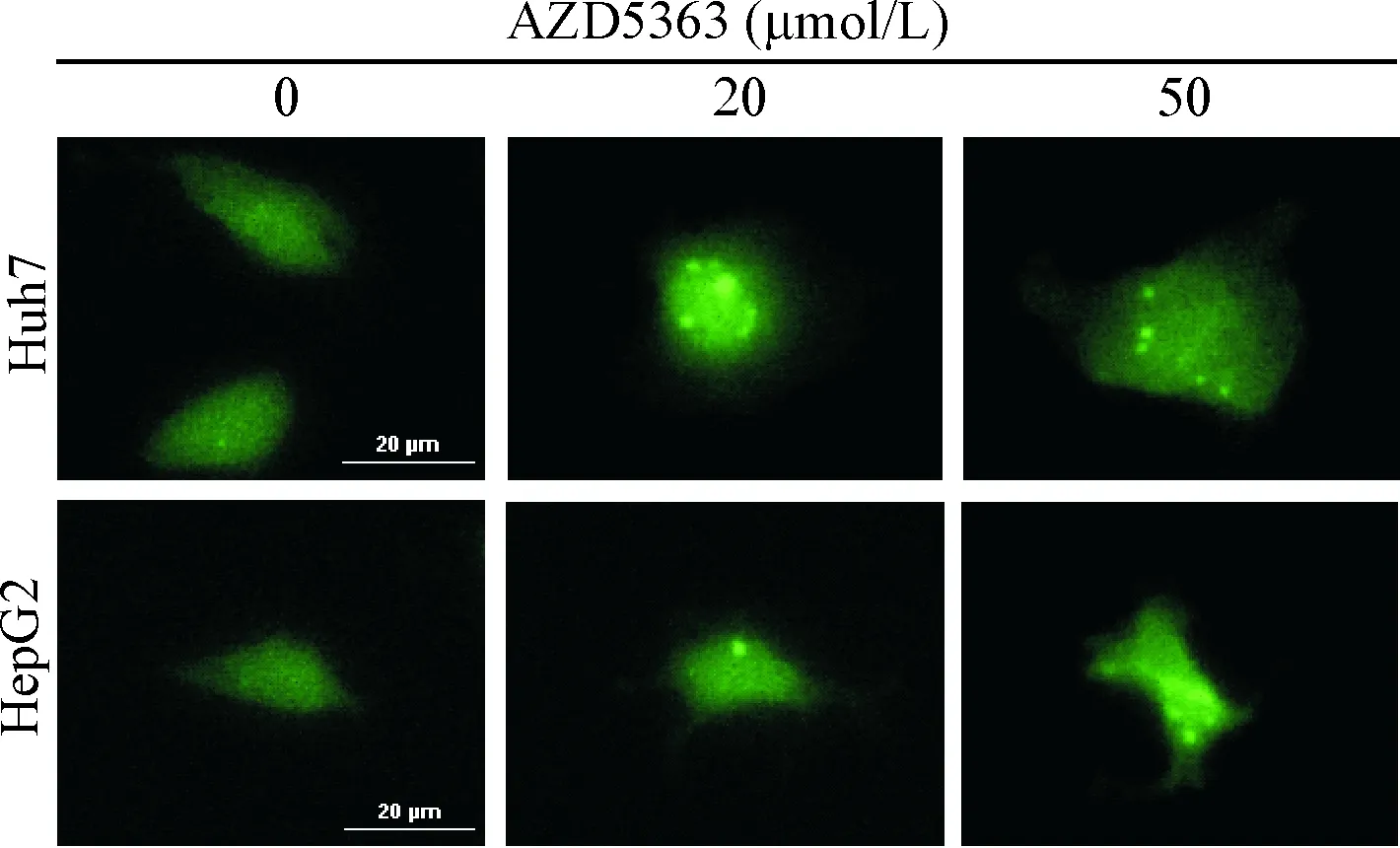
Figure 4.Microscopic observation of GFP-LC3-II in Huh7 cells and HepG2 cells transiently transfected with GFP-LC3 plasmids cultured for 24 h and then treated with AZD5363 for another 24 h. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图4AZD5363诱导肝癌细胞发生自噬
Western blot实验结果显示,AZD5363作用于HepG2细胞和Huh7细胞24 h后,细胞内自噬标志蛋白LC3-II的表达水平明显增加(P<0.05),见图5。
4 氯喹促进AZD5363诱导的肝癌细胞凋亡
为了进一步探讨自噬与AZD5363诱导细胞凋亡的相关性,本组利用自噬抑制剂氯喹来抑制细胞中自噬的发生。MTT实验结果表明,与AZD5363单独用药组相比,抑制自噬能够显著增加AZD5363对细胞活力的抑制作用(P<0.05),见图6。
TUNEL染色结果表明,与AZD5363单独用药相比,AZD5363联合CQ组细胞凋亡率明显增加(P<0.05),见图7。
另外,Western blot实验显示,AZD5363与CQ联用后促进了肝癌细胞内PARP的切割(P<0.05),见图8,进一步说明AZD5363诱导的自噬对肝癌细胞起保护性作用。
讨 论
本课题组前期通过研究发现,AZD5363能够抑制乳腺癌细胞的增殖,并诱导细胞凋亡,但其在肝癌细胞中的抑制活性尚未报道[5]。本研究首先采用MTT实验检测了AZD5363对肝癌细胞活力的抑制作用,发现不同浓度的AZD5363作用肝癌细胞后,细胞活力显著下降,表明AZD5363能够抑制HepG2和Huh7细胞活力,且抑制作用呈剂量依赖性。
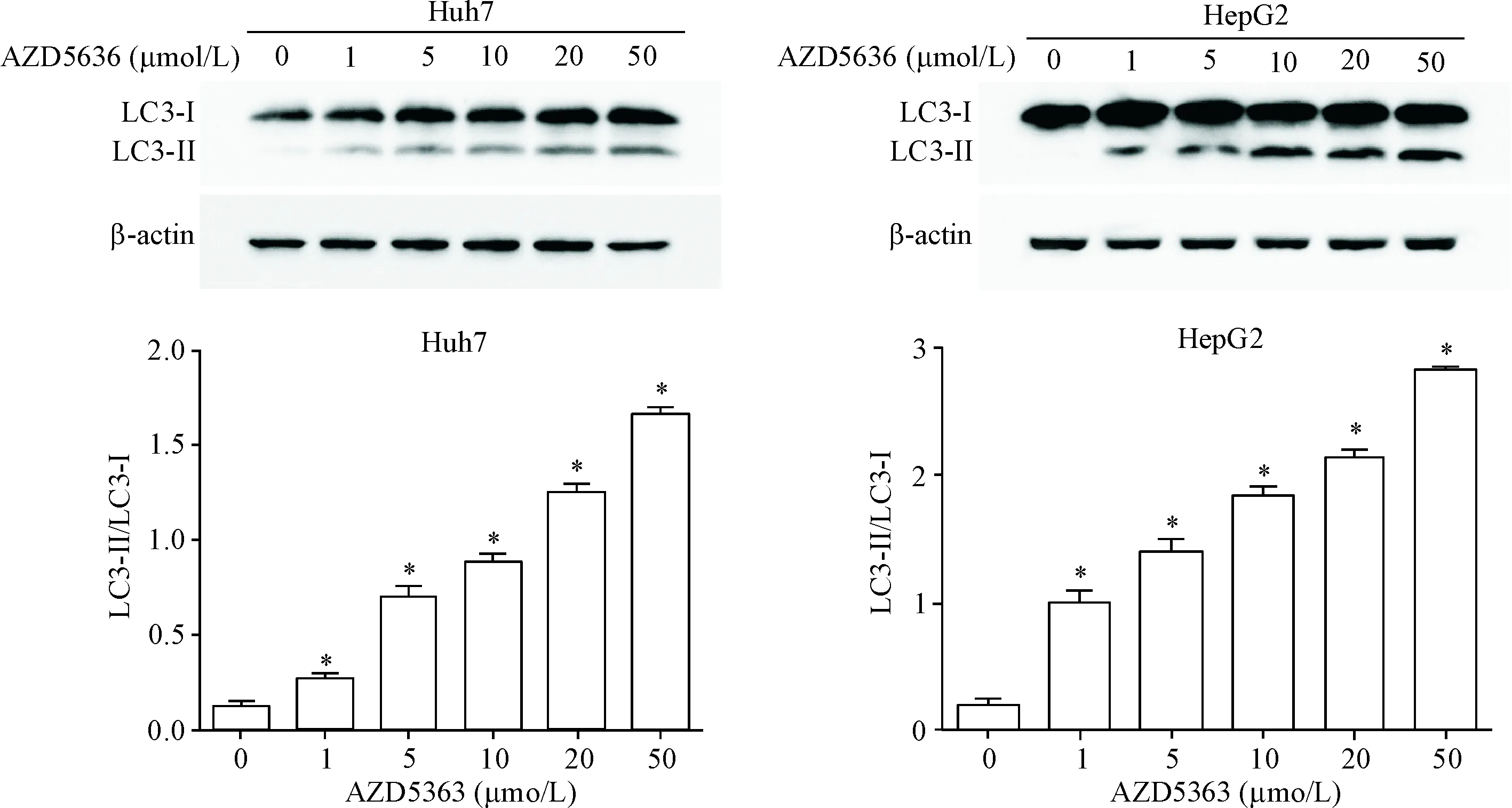
Figure 5.The results of Western blot analysis of LC3-II in the Huh7 cells and HepG2 cells treated with the indicated concentrations of AZD5363 for 24 h. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图5AZD5363对HepG2和Huh7细胞中LC3-II表达的影响
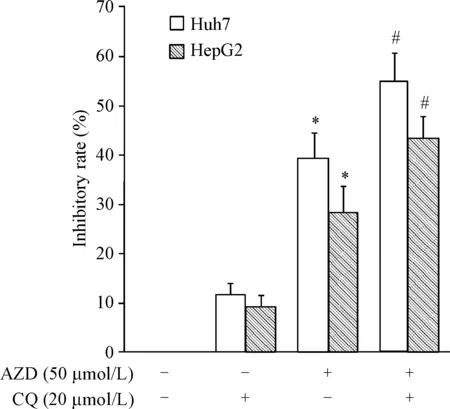
Figure 6.Blockage of autophagy by CQ promoted AZD5363-suppressed viability of the hepatocellular carcinoma cells. The cell viability was determined by MTT assay. Mean±SD.n=3.*P<0.05vscontrol group (untreated cells);#P<0.05vsAZD5363 alone group.
图6抑制自噬增加AZD5363对肝癌细胞活力的抑制作用
诱导细胞凋亡是抗肿瘤药物抑癌活性的理论依据之一[6-7]。我们采用TUNEL标记法检测了AZD5363对肝癌细胞凋亡的诱导作用,发现较高浓度的AZD5363作用细胞24 h后,HepG2细胞和Huh7细胞均表现不同程度的凋亡。为进一步阐明AZD5363促凋亡的可能作用机制,本研究采用Western blot 法分析了AZD5363对细胞内PARP 蛋白切割水平的影响。PARP 是存在于多数真核细胞中的一个多功能蛋白质翻译后修饰酶,是细胞凋亡核心成员caspase的切割底物,在细胞和各种刺激因素作用下,活化的caspase通过剪切PARP 成不同的片段而使其不能发挥正常功能,从而启动细胞的凋亡[8]。本研究Western blot结果发现,较高剂量的AZD5363作用细胞后,PARP蛋白切割水平增加,进而诱导肝癌细胞发生凋亡。
细胞自噬是真核细胞中一种重要的生物学过程,细胞发生自噬时,胞质内出现双层膜结构包裹受损蛋白及细胞器形成自噬体,并与溶酶体相结合形成自噬溶酶体,降解其包裹内容物,为细胞代谢提供原料和能量[9]。自噬在肿瘤的发生发展过程中发挥重要作用,许多研究表明,肿瘤细胞在化疗过程中可激活自噬信号,作为一种保护机制使得细胞免遭死亡[10]。因此,抑制自噬而增强肿瘤细胞对化疗药物的敏感性在目前抗肿瘤治疗研究应受到重视[11]。
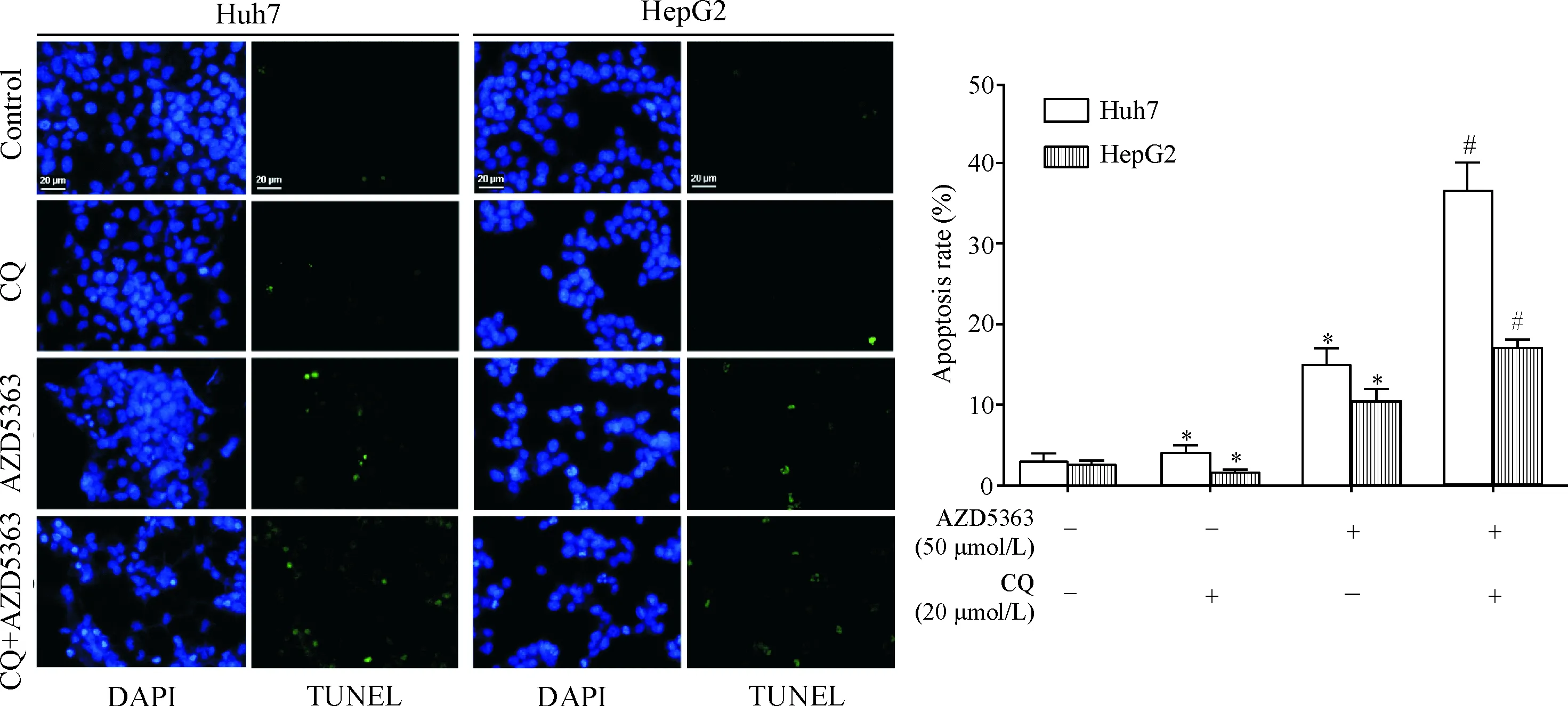
Figure 7.Combined treatment with AZD5363 and chloroquine (CQ) synergistically induced apoptosis in hepatocellular carcinoma cells. The apoptosis was determined by TUNEL staining. Mean±SD.n=3.*P<0.05vscontrol group (untreated cells);#P<0.05vsAZD5363 alone group.
图7抑制自噬增强AZD5363诱导的Huh7和HepG2细胞凋亡
为了阐明AZD5363抑制肝癌细胞活性的内在机制,本研究同时检测了AZD5363对细胞自噬的影响,发现AZD5363能够诱导肝癌细胞发生自噬。考虑到细胞自噬在调控肿瘤细胞化疗效果中的重要作用,我们选取氯喹作为自噬抑制剂,探讨AZD5363诱导的细胞凋亡与自噬的相关性。当肝癌细胞用CQ处理后,可明显增强AZD5363对细胞活力的抑制作用,同时促进AZD5363诱导的细胞凋亡,表明抑制自噬增强AZD5363对HepG2细胞和Huh7细胞的杀伤活性,自噬在AZD5363处理的肝癌细胞中起保护作用。
综上所述,本研究探讨了AZD5363对人肝癌HepG2和Huh7细胞凋亡与自噬的影响,发现AZD5363能够通过抑制细胞活力和诱导细胞凋亡而杀伤肝癌细胞,同时激活细胞了保护性自噬,抑制自噬促进了AZD5363的抗肿瘤活性。本研究为肝细胞癌的临床治疗提供新思路。
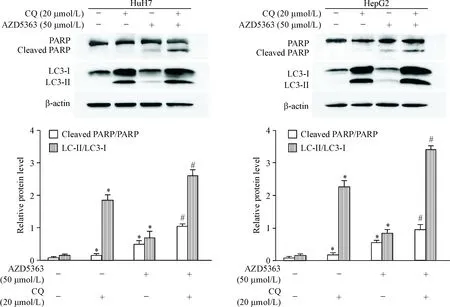
Figure 8.The protein levels of cleaved PARP and LC3-Ⅱ after combined treatment with AZD5363 and chloroquine (CQ) were analyzed by Western blot analysis. β-actin was used as an equal loading control. Mean±SD.n=3.*P<0.05vscontrol group (untreated cells);#P<0.05vsAZD5363 alone group.
图8抑制自噬增强AZD5363诱导的PARP切割

