IL-6通过诱导lncTCF7表达促进甲状腺乳头状癌TPC-1细胞上皮-间充质转化、迁移和侵袭*
邵扬谦, 周 斌, 孙加强, 张宇轩, 秦建武△
(郑州大学附属肿瘤医院 1甲状腺头颈外科, 2分子病理科室, 河南 郑州 450008; 3郑州大学第一附属医院中西医结合科, 河南 郑州 450052)
白细胞介素6(interleukin-6,IL-6)是一种与肿瘤微环境相关的细胞因子,可由巨噬细胞、T淋巴细胞和血管内皮细胞等多种细胞产生,其在乳腺癌、结肠癌和非小细胞肺癌多种肿瘤组织和细胞中异常表达,参与肿瘤细胞的增殖、迁移、侵袭和上皮-间充质转化(epithelial-mesenchymal transition,EMT)等过程,与肿瘤的发展关系密切[1-3]。有研究发现,甲状腺癌患者外周血中IL-6水平明显升高,与甲状腺癌的侵袭和转移关系密切[4]。甲状腺癌是常见的内分泌系统和头颈部恶性肿瘤,具有增长迅速、发病率高和复发率高等特点,随着其发病人数和死亡人数的不断增加,使得人们对甲状腺癌机制的认识和诊断治疗尤为迫切。甲状腺乳头状癌是甲状腺癌的重要病理类型,约占其90%,颈部淋巴结转移是其重要的临床特征,寻找有效抑制肿瘤细胞的浸润和转移的靶标一直是甲状腺乳头状癌研究的重点[5]。EMT是一种赋予上皮细胞转移和入侵能力的生物学过程,在肿瘤细胞的浸润和转移过程中发挥着重要作用。长链非编码RNA lncTCF7在大肠癌和非小细胞肺癌等肿瘤的侵袭和转移中发挥着促进作用[6-7]。已有研究证实,IL-6可通过激活STAT3上调lncTCF7表达促进肝细胞癌EMT[8];IL-6也可促进未分化型甲状腺癌肿瘤干细胞增殖[9],但其对甲状腺乳头状癌细胞EMT、迁移和侵袭能力的影响未见报道。因此,本研究以人甲状腺乳头状癌TPC-1细胞为研究对象,探讨IL-6通过诱导lncTCF7表达对甲状腺乳头状癌TPC-1细胞的EMT、迁移和侵袭能力的影响,以期为甲状腺乳头状癌的治疗提供新的线索。
材 料 和 方 法
1 细胞、试剂与仪器
人甲状腺乳头状癌TPC-1细胞购于ATCC。DMEM培养基购于Gibco;胎牛血清购于杭州四季青公司;胰蛋白酶购于碧云天生物技术研究所;si-lncTCF7-1序列(5’-AGCCAACATTGTTGGTTAT-3’)、si-lncTCF7-2序列(5’-CACCTAGGTGCTCACTGAA-3’)及其阴性对照序列(5’-UUCUCCGAACG-UGUCACGUTT-3’)、lncTCF7过表达质粒及其空载体质粒均购于GenePharma;TRIzol试剂和Lipofectamine 2000 购自Invitrogen;抗E-cadherin、vimentin、Snail、Slug和GAPDH抗体购于CST;羊抗兔/鼠IgG-HRP II 抗和BCA蛋白检测试剂盒购于南京凯基生物公司;PCR试剂盒购自Abm;逆转录试剂盒购自TaKaRa;Transwell小室购于Corning;PVDF膜购于PALL。CO2细胞培养箱购于Thermo;PCR 扩增仪购于ABI;电泳仪购于北京六一仪器厂;凝胶成像分析仪购于UVP;倒置相差显微镜购于厦门麦克奥迪公司。
2 方法
2.1细胞培养及处理 采用含10%胎牛血清的DMEM培养基于37 ℃、5% CO2培养箱中培养TPC-1细胞,每2 d换液1次,待细胞贴壁达瓶底80%左右时,以0.25%胰蛋白酶消化传代。收集生长状态良好的第3~5代对数生长期TPC-1细胞进行实验。 取对数期生长期的TPC-1细胞,以每孔3×106个细胞接种于96孔板上,于培养箱内培养过夜后,将其随机分为5组,分别加入终浓度为0、5、10、20和50 μg/L的IL-6反应24 h后,收集各组细胞,采用RT-qPCR检测TPC-1细胞中lncTCF7的表达情况;另接种一板TPC-1细胞,培养过夜后将其随机分为4组,以同一浓度50 μg/L 的IL-6分别处理0、6、12和24 h后,收集各组细胞采用RT-qPCR检测。
2.2RT-qPCR检测 以TRIzol法提取TPC-1细胞总RNA后,参照逆转录说明书步骤合成cDNA。以cDNA为模板,再参照RT-qPCR试剂盒说明书步骤进行PCR扩增。其中,上海生工生物合成的lncTCF7的上游引物序列为5’-AGGAGTCCTTGGACCTGAGC-3’,下游引物序列为5’-AGTGGCTGGCATATAACCAACA-3’;内参照GAPDH的上游引物序列为5’-GCACCGTCAAGGCTGAGAAC-3’,下游引物序列为5’-GCCTTCTCCATGGTGGTGAA-3’。按照如下PCR扩增条件进行扩增:95 ℃预变性120 s;95 ℃ 变性15 s、55 ℃ 退火30 s、72 ℃ 延伸30 s,40个循环;72 ℃总延伸300 s。采用2-ΔΔCt法检测TPC-1细胞中lncTCF7的表达水平。
2.3Western blot检测蛋白水平 收集方法2.1中0 μg/L和50 μg/L IL-6作用24 h后的2组TPC-1细胞,加入RIPA裂解液提取总蛋白后,参照BCA蛋白检测试剂盒对总蛋白进行浓度和纯度的检测。取定量合格的总蛋白,加入等量的上样缓冲液充分混匀后,于沸水浴中变性5 min。取适量的变性蛋白上样行SDS-PAGE,待分离结束后,采用转膜仪将蛋白样品转至聚偏二氟乙烯膜上,接着放入含5%脱脂奶粉的封闭液封闭1 h。用封闭液稀释1 000倍的抗E-cadherin、vimentin和GAPDH抗体常温孵育1 h后,以封闭液按照每次10 min洗膜3次;再用封闭液稀释2 000倍的HRP-羊抗鼠/兔 II 抗常温孵育1 h。以封闭液洗膜后,滴加化学发光剂,大约30 s后,置于成像仪的暗室内曝光,拍照分析。后期采用Wes-tern blot检测敲减lncTCF7表达对IL-6诱导的EMT相关因子Snail和Slug的蛋白表达情况,其中抗Snail和Slug抗体的稀释倍数为800。
2.4细胞转染 将对数生长期的TPC-1细胞以每孔105个细胞接种至6孔细胞板上,于培养箱内培养。待细胞融合度达70%以上时,进行瞬时转染。参照转染试剂Lipofectamine 2000的说明书步骤将lncTCF7过表达质粒及其空载体质粒转染至TPC-1细胞中,并标记为lncTCF7组和vector组。转染6 h后,更换新鲜培养液继续培养,48 h后收集各组细胞,采用Western blot检测TPC-1细胞中E-cadherin和vimentin蛋白表达的影响。后期实验采用Lipofectamine 2000将si-lncTCF7-1、si-lncTCF7-2及其阴性对照序列转染至TPC-1细胞中,分别标记为si-lncTCF7-1组、si-lncTCF7-2和si-Con组,转染48 h后,采用RT-qPCR检测其转染效果。另在转染48 h后,给予50 μg/L IL-6处理24 h,并设一组不加IL-6的si-Con组细胞作为对照,采用Western blot检测各组细胞中E-cadherin和vimentin蛋白的表达,Transwell小室实验检测各组细胞的迁移和侵袭能力。
2.5Transwell小室实验 细胞迁移实验:将lncTCF7组和vector组细胞常规消化后,加入无血清的DMEM培养基制备1×108/L的细胞悬液。于24孔板Transwell小室上室中加入200 μL细胞悬液,下室中加入含10%胎牛血清的DMEM培养基。每组实验重复3次。置于培养箱内常规培养48 h后,取出小室,分别加入10%甲醇和0.1%结晶紫溶液固定、染色,晾干后,于倒置显微镜下观察、拍照。各组细胞迁移能力以随机选取的6个视野的细胞数的平均值表示。细胞侵袭实验:实验前,以浓度为1 g/L 的Matrigel对Transwell小室上室聚碳酸酯微孔膜进行包被,于培养箱内聚合反应30 min后,在小室上室中加入细胞悬液,下室中加入含10%胎牛血清的DMEM培养基,培养48 h,取出小室,以甲醇和结晶紫对细胞进行固定和染色,倒置显微镜下拍照分析。详细步骤参照迁移实验。
2.6相差显微镜观察细胞形态 采用相差显微镜观察待测的TPC-1细胞形态并拍照,观察敲减lncTCF7表达对IL-6诱导的TPC-1细胞形态的影响。
3 统计学分析
采用SPSS 22.0进行统计学分析。实验数据以均数±标准差(mean±SD)的形式表示。两组间比较采用独立样本t检验,多组间比较使用单因素方差分析,组间多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 IL-6诱导TPC-1细胞中lncTCF7的表达
RT-qPCR检测结果显示,以不同浓度(0、5、10、20和50 μg/L)的IL-6作用24 h后,与0 μg/L对照组相比,TPC-1细胞中lncTCF7表达随着IL-6浓度的增加逐渐升高(P<0.05);以50 μg/L的IL-6作用0、6、12和24 h后,TPC-1细胞中lncTCF7表达随着IL-6作用时间的延长逐渐升高(P<0.05),见图1。可见,IL-6可呈剂量和时间依赖性地诱导TPC-1细胞中lncTCF7表达。
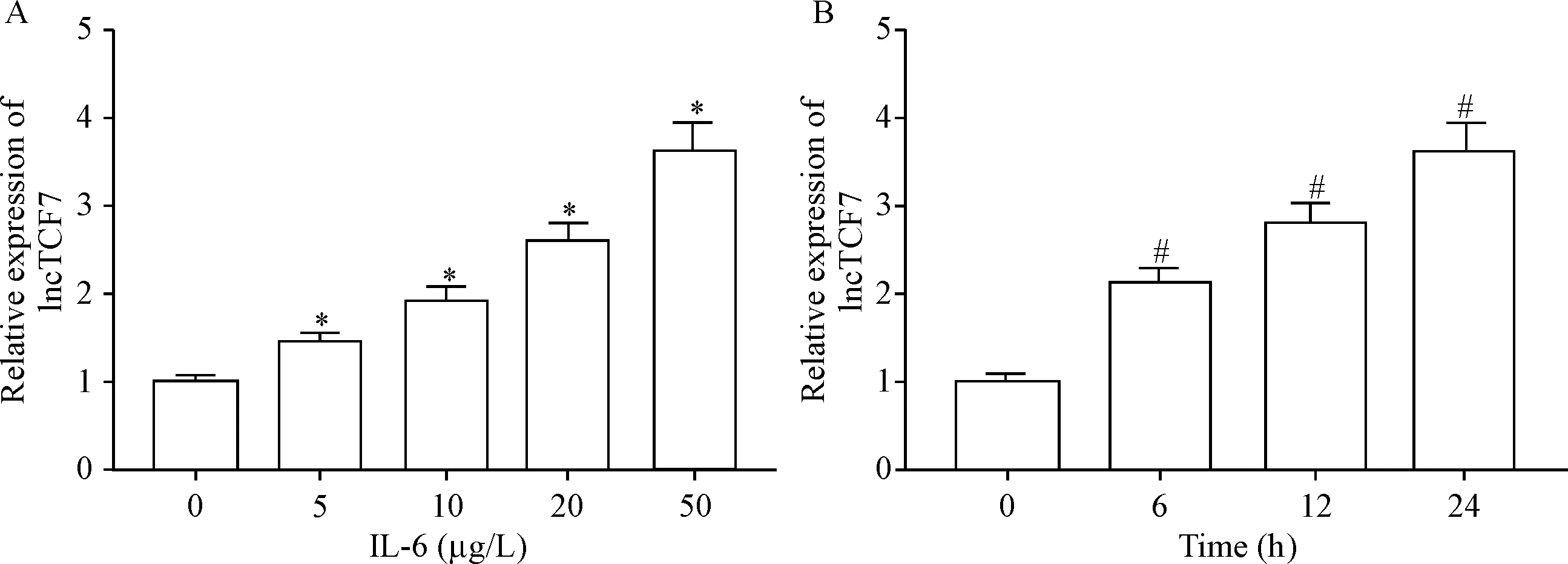
Figure 1.The effects of IL-6 on the expression of lncTCF7 in the TPC-1 cells. A: the TPC-1 cells were treated with different concentrations of IL-6 for 24 h; B: the TPC-1 cells were treated with 50 μg/L IL-6 for different time. Mean±SD.n=3.*P<0.05vs0 μg/L group;#P<0.05vs0 h group.
图1IL-6对TPC-1细胞中lncTCF7表达的影响
2 IL-6诱导TPC-1细胞的EMT
Western blot检测结果显示,与未加IL-6的TPC-1细胞相比,以50 μg/L IL-6作用24 h后,TPC-1细胞中上皮标志物E-cadherin表达明显降低,间充质标志物vimentin表达明显升高(P<0.05),见图2。 这说明IL-6可诱导TPC-1细胞的EMT。

Figure 2.The effect of IL-6 on epithelial-mesenchymal transition of TPC-1 cells. Mean±SD.n=3.*P<0.05vsIL-6 (-) group.
图2IL-6对TPC-1细胞上皮-间充质转化的影响
3 过表达lncRNA-TCF7可促进TPC-1细胞的EMT
Western blot检测结果显示,与vector组相比,在转染lncTCF7过表达质粒的lncTCF7组细胞中E-cadherin表达明显降低,而vimentin蛋白表达明显升高(P<0.05),见图3。这说明过表达lncTCF7可促进TPC-1细胞的EMT。
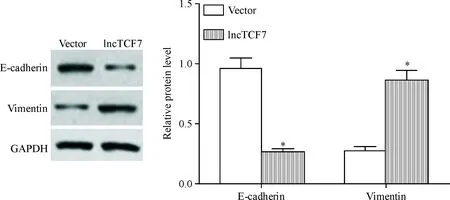
Figure 3.The effect of lncTCF7 over-expression on epithelial-mesenchymal transition of TPC-1 cells. Mean±SD.n=3.*P<0.05vsvector group.
图3过表达lncTCF7对TPC-1细胞上皮-间充质转化的影响
4 过表达lncTCF7可促进TPC-1细胞的迁移和侵袭能力
Transwell实验检测结果显示,与vector组相比,转染lncTCF7过表达质粒的lncTCF7组细胞的迁移和侵袭细胞数均明显升高(P<0.05),见图4。这说明过表达lncTCF7可促进TPC-1细胞的迁移和侵袭能力。
5 敲减lncTCF7表达抑制了IL-6诱导的TPC-1细胞EMT、迁移和侵袭
RT-qPCR检测结果显示,与si-Con组相比,si-lncTCF7-1组和si-lncTCF7-2组细胞中lncTCF7的表达水平均明显降低(P<0.05),见图5A。Western blot检测和Transwell实验结果显示,与si-Con+IL-6(-)组相比,给予50 μg/L IL-6作用的si-Con+IL-6(+)组细胞中E-cadherin蛋白表达下调,而vimentin蛋白表达上调,同时迁移和侵袭细胞数均增多(P<0.05);与si-Con+IL-6(+)组相比,在成功敲减lncTCF7表达的si-lncTCF7-1组和si-lncTCF7-2组细胞中E-cadherin蛋白表达上调,而vimentin蛋白表达下调,同时,迁移和侵袭细胞数均减少(P<0.05),见图5B、C。可见敲减lncTCF7表达能够明显抑制IL-6诱导的TPC-1细胞EMT、迁移和侵袭。
6 敲减lncTCF7表达抑制了IL-6对TPC-1细胞形态和EMT相关分子蛋白水平的影响
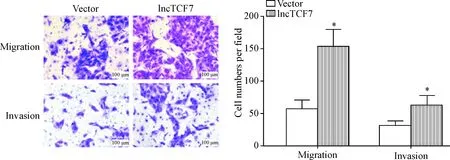
Figure 4.The effects of lncTCF7 over-expression on the migration and invasion abilities of TPC-1 cells. Mean±SD.n=3.*P<0.05vsvector group.
图4过表达lncRNA-TCF7对TPC-1细胞迁移和侵袭能力的影响
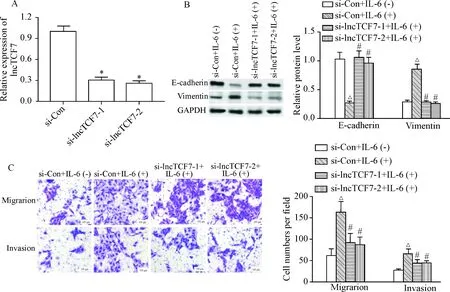
Figure 5.The effects of lncTCF7 knockdown on IL-6-induced epithelial-mesenchymal transition, migration and invasion of TPC-1 cells. A: lncTCF7 knockdown in the TPC-1 cells; B: the result of Western blot for determining the protein expression of E-cadherin and vimentin; C: the number of migratory and invasive cells in each group. Mean±SD.n=3.*P<0.05vssi-Con group;△P<0.05vssi-Con+IL-6 (-) group;#P<0.05vssi-Con+IL-6 (+) group.
图5敲减lncTCF7的表达对IL-6诱导的TPC-1细胞上皮-间充质转化、迁移和侵袭能力的影响
光学显微镜下发现,与si-Con+IL-6(-)组相比,给予50 μg/L IL-6作用的si-Con+IL-6(+)组的TPC-1细胞由鹅卵石状变为纺锤体状,且细胞间隙加大,连接松散;而敲减lncTCF7表达后,IL-6引起的上述变化明显受到抑制,见图6A。同时,Western blot进一步检测EMT转录因子Slug和Snail蛋白的表达,与si-Con+IL-6(-)组相比,si-Con+IL-6(+)组TPC-1细胞中Slug和Snail蛋白的表达水平均明显升高,而si-lncTCF7+IL-6(+)组中Slug和Snail蛋白的表达水平较si-Con+IL-6(+)组均明显降低(P<0.05),见图6B。可见,敲减lncTCF7表达能够明显抑制IL-6对TPC-1细胞形态和EMT相关分子蛋白水平的影响。
讨 论
IL-6是一种常见的多种功能细胞因子,在肿瘤细胞微环境中发挥着重要作用,可通过多种途径直接或间接作用于肿瘤细胞,参与众多肿瘤的发生和发展过程,而抑制其表达有望成为治疗癌症的重要策略[10-11]。IL-6在子宫内膜癌组织中的表达异常升高,且与子宫内膜癌肌层浸润和淋巴结转移有关,可作为子宫内膜癌发展监测指标和治疗靶点[12];星形胶质细胞分泌的IL-6可通过上调MMP-14表达促进胶质瘤的迁移和侵袭[13];IL-6通过STAT3信号通路促进胃癌和卵巢癌的迁移和侵袭,沉默其表达则能够降低肿瘤细胞的转移能力[14-15];此外,IL-6可通过上调lncTCF7表达促进肝细胞癌的上皮间质转化[8]。lncTCF7是一种新发现的长链非编码RNA,其异常表达与肿瘤的发生发展和预后不良等关系密切[16],例如,lncTCF7在脑胶质瘤和结直肠癌中高表达,其表达水平越高,患者的生存预后越差,其可通过激活Wnt/β-catenin信号通路促进肿瘤的细胞增殖、迁移和侵袭;另外,lncTCF7可被IL-6/STAT3反式激活通过调控上皮-间充质转化促进肝癌细胞的侵袭[8];而敲减其表达则能够明显抑制肿瘤细胞的迁移、增殖和致瘤性[6,17]。已有研究[8, 18-19]指出,IL-6在甲状腺乳头状癌中异常高表达,与癌灶的包膜侵犯有关;然而IL-6有无通过诱导lncTCF7表达参与甲状腺乳头状癌细胞的EMT、迁移和侵袭过程,目前并不清楚。

Figure 6.Knockdown of lncTCF7 expression inhibited the morphological changes and the protein levels of epithelial-mesenchymal transition-related molecules of TPC-1 cells induced by IL-6. A: morphological changes of the TPC-1 cells with/without IL-6 treatment after knockdown of lncTCF7 expression (×100); B: the protein expression of Snail and Slug in the TPC-1 cells detected by Western blot. Mean±SD.n=3.*P<0.05vssi-Con+IL-6 (-) group;#P<0.05vssi-Con+IL-6 (+) group.
图6敲减lncTCF7的表达抑制了IL-6诱导的TPC-1细胞形态改变和上皮-间充质转化相关分子蛋白水平的变化
我们以不同浓度的IL-6作用24 h或以50 μg/L的IL-6作用不同时间后,RT-qPCR检测发现,IL-6可呈剂量和时间依赖性地诱导甲状腺乳头状癌TPC-1细胞中lncTCF7的表达;以50 μg/L IL-6作用24 h后,Western blot检测TPC-1细胞中E-cadherin表达明显降低,vimentin表达明显升高。E-cadherin是一种钙依赖性跨膜糖蛋白,在形成细胞间黏附性连接过程中发挥着重要作用,其下调可造成细胞间黏附性连接减弱,促进细胞的迁移和侵袭,常被作为EMT的上皮标志物;vimentin是一种中间丝蛋白,存在于间充质细胞中,在间充质来源的细胞中显示阳性,上皮来源细胞中显示阴性,可通过调节细胞黏附分子和细胞骨架蛋白等参与细胞信号转导、黏附、迁移和侵袭等过程,常被作为EMT的间充质标志物;两者均在甲状腺乳头状癌的发展过程中发挥着重要作用[20-21]。上述结果提示,IL-6可能够通过诱导lncTCF7表达促进甲状腺乳头状癌的发展。转染lncTCF7过表达质粒后,TPC-1细胞中E-cadherin表达降低,vimentin表达升高,同时TPC-1细胞的迁移和侵袭细胞数减少,提示,lncTCF7在甲状腺乳头状癌的EMT、迁移和侵袭过程中发挥着重要的促进作用。为了验证lncTCF7在IL-6促进甲状腺乳头状癌的发展中的作用,我们通过转染si-lncTCF7-1序列成功敲减其表达后,检测发现IL-6作用后TPC-1细胞中E-cadherin表达下降、vimentin表达上调、迁移和侵袭细胞数增多且细胞间隙增大这一系列变化均受到抑制。Slug和Snail是转录因子Snail超家族成员,可与E-cadherin启动子区域的E-box结合进而抑制E-cadherin的转录,进而影响细胞的EMT。结果提示,IL-6通过诱导lncTCF7表达促进甲状腺乳头状癌TPC-1细胞的EMT、迁移和侵袭能力。
综上所述,IL-6和lncTCF7均在甲状腺乳头状癌TPC-1细胞的EMT、迁移和侵袭过程中发挥着重要的促进作用,但其具体的调控机制还有待进一步深入研究。这为靶向IL-6或lncTCF7抗甲状腺乳头状癌转移提供了参考依据。

