重组人源性胶原蛋白的制备及表征
侯增淼,李晓颖,李敏,杨金芳,杨小琳,赵金礼
重组人源性胶原蛋白的制备及表征
侯增淼,李晓颖,李敏,杨金芳,杨小琳,赵金礼
陕西慧康生物科技有限责任公司,陕西 西安 710054
为了获得可实现工业化生产的重组人源性胶原蛋白,根据人I型胶原蛋白Gly-X-Y序列,优选亲水性的Gly-X-Y胶原肽段设计人源性胶原蛋白氨基酸序列及对应的核苷酸序列,利用酶切技术构建pPIC9K-COL表达载体,电转化毕赤酵母获得人源性胶原蛋白毕赤酵母工程菌,并对其进行发酵罐发酵、纯化及鉴定。结果显示,获得表达量达4.5 g/L,纯度大于95%的人源性胶原蛋白,经氨基酸N端测序、分子量测定、氨基酸分析及胶原酶降解试验,确定获得的蛋白与理论的人源性胶原蛋白一级结构一致;同时胶原经冷冻干燥后进行扫描电镜分析及细胞毒性试验,确定人源性胶原蛋白冻干品具有多孔纤维网状结构及优良的细胞相容性,预示其具备作为生物医学材料的潜质。
胶原蛋白,人源性,毕赤酵母,生物材料
胶原蛋白 (Collagen) 是体内含量最多的一种蛋白质,是细胞外基质 (ECM) 的主要成分,其对维护细胞、组织、器官的正常生理功能和损伤修复有重要作用[1]。在分子结构上,每条胶原肽链主要由Gly-X-Y (X、Y 是Gly之外的任何氨基酸残基) 三联体重复构成,这种独特的结构是形成胶原纤维高级结构所必需的,它决定了胶原蛋白优良的生物相容性和低免疫原性,已广泛应用于医药、保健品及化妆品行业中[2-3]。
在现有技术中,胶原蛋白的主要来源是动物组织提取,而随着生物技术的发展,利用基因重组技术,通过微生物发酵法获得重组胶原已取得巨大成果,与天然胶原蛋白相比,利用该技术生产的胶原蛋白解决了传统提取法存在的病毒隐患缺陷,同时又显著提高了胶原蛋白的稳定性、亲水性和生物相容性[4]。微生物发酵所用宿主菌目前主要采用大肠杆菌[5-7]和甲醇营养酵母[8-9],但采用大肠杆菌表达获得的重组胶原蛋白存在纯化困难的问题及内毒素含量高的风险,而甲醇营养型巴斯德毕赤酵母作为一种真核表达系统具有目的蛋白表达量高、纯化方法简单、不受内毒素影响等特点,已广泛应用于重组蛋白的表达,是胶原蛋白重组表达的优势宿主菌。本研究以毕赤酵母为宿主菌,构建表达人源性胶原蛋白基因工程菌,经发酵纯化获得高纯度人源性胶原蛋白,并对其结构及性能进行表征,为人源性胶原蛋白的深入应用奠定了基础。
1 材料与方法
1.1 主要仪器
梯度PCR仪 (MJMini,BIO-RAD),电穿孔仪 (GenePulse,BIO-RAD),150 L发酵系统 (上海保兴),三足式离心机 (辽阳阳光),超滤系统 (武汉新力协力),中空纤维膜组件 (天津膜天膜)、蛋白纯化色谱层析系统 (Hanbon),紫外分光光度计 (752N型,上海精科),电泳仪 (北京六一),高效液相色谱仪 (日立),扫描电子显微镜 (VEGA 3 LM (SEM),TESCAN) 等。
1.2 材料
大肠杆菌.DH5α (天根生化),GS115 (Invitrogen公司),pPIC9K (Invitrogen公司,对5 709 bp处的Ⅰ位点进行点突变),PCR MasterMix (天根生化),DNA纯化回收试剂盒 (天根生化),质粒小提试剂盒 (天根生化),限制性内切酶 (Thermo Fisher Scientific),SolutionⅠ (TaKaRa),CM FF (交大保赛),C8柱,Ⅰ型胶原酶 (Gibco),其他试剂均为国产分析纯试剂。
1.3 基因工程菌的构建
根据人Ⅰ型胶原蛋白氨基酸序列,优选亲水性的Gly-X-Y胶原肽段设计合成人源性胶原蛋白氨基酸序列,包含411个氨基酸,理论分子量约38 kDa,等电点为9.7,同时按照毕赤酵母密码子偏好性设计对应的DNA序列(氨基酸序列及对应核苷酸序列已提交GenBank,登录号为MH544244,5′端添加Ⅰ限制性内切酶酶切位点CTCGAG和KEX2酶切位点序列AAAAGA,3′端添加RⅠ限制性内切酶酶切位点GAATTC,将设计的核苷酸序列送生工生物工程 (上海) 股份有限公司全基因合成,之后对合成产物进行Ⅰ和RⅠ双酶切,连接至载体pPIC9K,获得pPIC9K-COL表达载体。然后,将pPIC9K-COL电转化至毕赤酵母GS115菌株,经G418 (Geneticin,遗传霉素) 及摇瓶筛选,获得人源性胶原蛋白基因工程菌。
1.4 胶原的发酵及纯化
利用150 L中试发酵系统进行人源性胶原蛋白发酵,参考Invitrogen公司“Fermentation Process Guidelines”方法,发酵参数为:pH 5.0,温度29 ℃,溶氧控制大于30%,待发酵液湿菌重达200 g/L时进行甲醇诱导,诱导时间约为48 h,放罐,经离心机进行固液分离,利用0.22 μm中空纤维膜超滤,去除残留的菌体及杂质,然后使用截留分子量为10 kDa的中空纤维膜超滤,收集截留液,将截留液进行阳离子交换层析 (A相:pH 6.0,10 mmol/L柠檬酸缓冲液;B相:A相+ 1 mol/L NaCl),用5%的B相洗脱,收集洗脱液,洗脱液经10 kDa卷式膜超滤浓缩脱盐,冷冻干燥,即可获得人源性胶原蛋白冻干品纯品,并经HPLC高效液相色谱分析纯度及含量测定 (C8柱,A相:超纯水+0.1% TFA;B相:乙腈+0.1% TFA)。
1.5 胶原的N端测序
通过岛津全自动蛋白质多肽测序仪 (PPSQ-33A) 对人源性胶原蛋白N端序列15个氨基酸进行分析,由生工生物工程 (上海) 股份有限公司完成检测。
1.6 胶原的分子量研究
对人源性胶原蛋白纯化后冻干品进行基质辅助激光解吸电离飞行时间质谱 (5800 MALDI-TOF/ TOF) 检测其相对分子量,判断重组人源性胶原蛋白的实际分子量,由生工生物工程 (上海) 股份有限公司检测。
1.7 胶原的氨基酸分析
采用的实验方法是使用6 mol/L盐酸对人源性胶原蛋白样品进行酸水解成游离氨基酸,然后用PITC对游离氨基酸进行衍生化处理,之后使用高效液相色谱对衍生化的氨基酸样品进行分析。最后使用Labsolution软件对高效液相色谱数据进行分析,根据外标法计算确定样品的氨基酸组成摩尔百分比 (由生工生物工程 (上海) 股份有限公司检测)。
1.8 胶原的胶原酶降解分析
利用1 mg/mL Ⅰ型胶原酶消化液溶解重组人源性胶原蛋白冻干品样品,使胶原的浓度为1 mg/mL,37 ℃水浴作用4 h,同时以牛Ⅰ型胶原蛋白作为阳性对照,牛血清白蛋白 (BSA) 为阴性对照,利用SDS-PAGE检测。
1.9 胶原冻干品的扫描电镜分析
采用扫描电子显微镜 (VEGA 3 LM (SEM),TESCAN) 对重组人源性胶原蛋白冻干品进行扫描显像。
1.10 胶原的细胞毒性测定
用含10%胎牛血清的DMEM/F12培养液将培养的成纤维细胞L929 (小鼠成纤维细胞) 稀释配成6×103/mL的单细胞悬液;取3块96孔培养板,每孔接种100 μL的细胞悬浮液,置于5% (体积分数) CO2培养箱中,37 ℃培养24 h;弃去原培养液,每孔加入100 μL实验组 (100 mg/L,500 mg/L,1 000 mg/L,5 000 mg/L,10 g/L) 配制溶液,同时设置阴性对照组 (单纯细胞培养液) 和阳性对照组 (4% DMSO),每组8孔;将3块培养板移入37 ℃、5% (体积分数) CO2培养箱中,分别于接种后48 h、96 h各取出1块培养板,每孔再加入MTT (噻唑蓝) 50 μL,继续在37 ℃条件下培养2 h,吸弃原培养液,立即加入二甲基亚砜,每孔150 μL,室温放置并轻轻振荡10–15 min;选择490 nm波长,在酶标仪上测定各孔光吸收值 (),并计算细胞相对增殖率RGR (%) = (实验组吸收值/阴性对照组吸收值)×100%。
2 结果与分析
2.1 基因工程菌的构建
对构建的表达载体pPIC9K-COL电转化毕赤酵母宿主菌GS115,利用摇瓶发酵筛选,甲醇诱导,SDS-PAGE检测,结果如图1所示,获得的目的蛋白条带明确,杂蛋白较少,表达菌株可用于下一步试验。

图1 人源性胶原蛋白摇瓶筛选SDS-PAGE检测结果

图2 人源性胶原蛋白发酵罐发酵过程不同诱导时间检测SDS-PAGE检测结果
2.2 胶原的发酵及纯化
从甲醇诱导开始,每隔4 h取样收集上清,10倍稀释后,进行SDS-PAGE,结果如图2所示,甲醇诱导后,重组人源性胶原蛋白随着诱导时间的延长,表达量呈逐渐升高趋势,48 h放罐后,经HPLC检测,发酵上清液中重组人源性胶原蛋白的表达量最高达4.5 g/L,且在发酵过程中人源性胶原蛋白降解少,杂蛋白少,有利于后期的纯化。
发酵结束后,经固液分离、两步超滤粗纯以及CM离子交换层析即可获得高纯度的重组人源性胶原蛋白,如图3所示,粗纯重组人源性胶原蛋白样品上样CM FF高流速琼脂糖凝胶柱,穿柱为发酵色素物质及未挂柱的杂蛋白,收集5% B相洗脱峰即为目的蛋白,30% B相洗脱的为杂质。最后,将收集的5% B相洗脱液经超滤脱盐、冷冻干燥,即可获得纯品,纯品经HPLC检测纯度,结果如图4,纯度达95%以上。

图3 人源性胶原蛋白离子交换层析过程检测

图4 HPLC检测重组人源性胶原蛋白纯度色谱图
2.3 胶原的N端测序
蛋白质的生物合成起始于N端,是否获得与理论的N端序列,是重组蛋白的关键,因此,对于重组蛋白质N端序列的分析,是鉴定重组表达蛋白的最直接的方法。人源性胶原蛋白经N端测序分析,结果与预期设计的N端序列一致,序列如下:NH2-Gly-Pro-Pro-Gly-Glu-Pro-Gly-Asn-Pro- Gly-Lys-Pro-Gly-Ser-Pro。
2.4 胶原的分子量测定
分子质量作为蛋白质样品的主要特征参数之一,是确定一种新型蛋白、进行蛋白质后续研究活动的重要前提。本研究设计的重组人源性胶原蛋白理论分子量为38 kDa,但从图1和图2中可以看出,在SDS-PAGE结果中显示目的蛋白处于分子量Marker的45–66.2 kDa之间,大于理论分子量因此对纯化后的冻干样品进行MALDI-TOF/TOF分子量测定,以鉴定其实际分子量,结果显示为38 359 Da,与理论分子量一致 (图5)。分析电泳表观分子量大于实际分子量,可能与胶原蛋白的Gly-X-Y氨基酸组成有关。

图5 人源性胶原蛋白分子量测定结果
2.5 胶原的氨基酸分析
氨基酸组成分析是多肽蛋白质化学研究中最基本的内容之一。通过氨基酸组成分析可以初步了解多肽蛋白质的化学结构特点,为蛋白质结构与功能的研究提供科学的信息。重组人源性胶原蛋白经氨基酸组成分析见表1,结果显示实测氨基酸与理论氨基酸个数和摩尔百分比一致。
2.6 胶原的胶原酶降解分析
胶原酶具有特异性降解胶原蛋白特性,能够特异性地识别胶原蛋白序列中Pro-X-Gly-Pro序列 (该序列高频率出现在胶原中,很少发现于其他蛋白中) 并切割该序列中性氨基酸 (X) 和甘氨酸 (Gly) 之间的肽键,将胶原蛋白降解为大小不一的肽段。本实验结果显示,经胶原酶降解两批次生产的重组人源性胶原蛋白 (1213批和1214批)和牛Ⅰ型胶原,人源性胶原蛋白具有与牛Ⅰ型胶原蛋白相同的降解特性,降解后电泳图中只能观察到胶原酶的特征性条带,而牛血清白蛋白 (BSA) 几乎不能被降解,结果见图6。

表1 氨基酸分析结果
2.7 胶原冻干品的扫描电镜分析
图7展示了两张放大倍率分别为200、500倍的扫描电镜谱图,从图中可以看出人源性胶原蛋白冻干品具有明显的多孔网状结构,这样的网状结构预示其具有应用于生物医学材料领域的潜力。
2.8 胶原的细胞毒性检测
采用MTT法检测不同浓度重组人源性胶原蛋白促L929细胞增殖作用,阴性对照组及样品组细胞生长良好,根据计算的RGR值 (表2) 及细胞毒性评价表评价标准 (表3),对样品细胞毒性进行评价,样品组48 h和96 h,0.1–5 g/L浓度细胞毒性反应均为0级,而样品组10 g/L浓度细胞毒性反应为1级,分析原因是因为胶原浓度达10 g/L时,样品的渗透压已超过细胞的正常渗透压,从而影响了细胞的正常生长。
综上所述,重组人源性胶原蛋白无明显的细胞毒性,具有良好的细胞相容性,满足作为生物材料的要求。

图6 人源性胶原与牛Ⅰ型胶原降解分析

图7 人源性胶原蛋白冻干品的SEM图

表2 48 h和96 h细胞增殖率测定
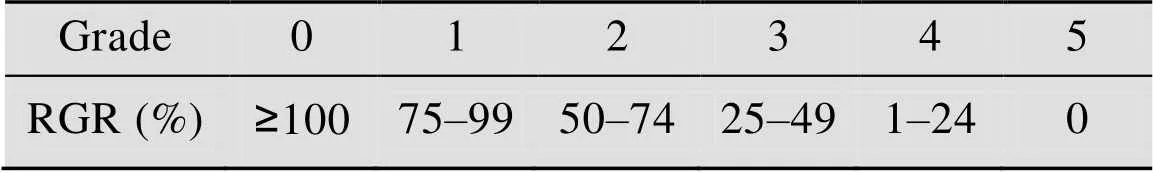
表3 细胞相对增殖率与细胞毒性分级
3 讨论
重组胶原蛋白作为一种优良的生物材料,已广泛得到应用,如2018年张斌杰等[10]利用重组人源胶原制备的凝胶可有效促进深Ⅱ度烧伤患者伤口愈合,有效提高愈合质量,2017年李伟娜等[11]发现毕赤酵母表达获得的Ⅲ型类人胶原在胃粘膜的修复具有显著的作用;2015年Islam等[12]将重组人胶原蛋白进行化学交联,获得重组人胶原基角膜替代物,展现了其优良的生物安全性和良好的光学和力学性能,为角膜疾病患者带来曙光。重组人源Ⅱ型胶原蛋白能刺激细胞外软骨基质的更新合成,被应用于软骨再生[13]。另外,重组胶原蛋白与其他天然生物材料、人工合成材料及纳米材料联合使用,使得复合材料既无免疫原性,同时又具备了良好的细胞相容性、一定的机械强度和可控的生物降解速率,以便为组织工程修复组织和器官缺损提供更为优良的支架材料[14]。以重组胶原蛋白为原材料的Ⅱ类医疗器械目前已广泛应用于临床,如山西锦波生物的医用重组人源胶原蛋白功能敷料[15]以及西安巨子生物的类人胶原蛋白敷料[16-18],在皮肤屏障功能损伤修复的临床应用中具有显著作用。
文中采用毕赤酵母发酵表达人源性胶原蛋白,获得的胶原降解少,发酵上清液表达量高达4.5 g/L,经过超滤粗纯及阳离子交换精纯即可获得纯度大于95%的人源性胶原蛋白,生产工艺简单,利于人源性胶原蛋白的产业化。同时,对于获得的人源性胶原蛋白进行表征,经过氨基酸N端测序、分子量测定、氨基酸分析及胶原酶降解试验,确定获得的蛋白与设计的理论人源性胶原蛋白一级结构一致;并经扫描电镜分析及细胞毒性试验,确定人源性胶原蛋白冻干品具有多孔纤维网状结构及优良的细胞相容性,预示其具备作为生物医学材料的潜质,为人源性胶原蛋白在敷料、组织工程、美容等方向的应用奠定基础。
[1] Wang RR, Wang HR. Research progress in preparation methods of collagen based biomaterials. Chem Ind Eng Prog, 2018, 37(2): 592–598 (in Chinese). 王瑞瑞, 王鸿儒. 胶原蛋白基生物功能材料制备方法研究进展. 化工进展, 2018, 37(2): 592–598.
[2] Avila Rodríguez MI, Rodríguez Barroso LG, Sánchez ML. Collagen: A review on its sources and potential cosmetic applications. J Cosmet Dermatol, 2018, 17(1): 20–26.
[3] Gómez-Guillén MC, Giménez B, López-Caballero ME, et al. Functional and bioactive properties of collagen and gelatin from alternative sources: A review. Food Hydrocoll, 2011, 25(8): 1813–1827.
[4] Tang YP, Zheng Q, Hu B, et al. Research progress on preparation and application of recombinant collagens. Sci Technol Food Ind, 2016, 37(18): 384–386 (in Chinese). 唐云平, 郑强, 胡斌, 等. 重组胶原蛋白制备及其应用研究进展. 食品工业科技, 2016, 37(18): 384–386.
[5] Yang X, Lu L. Recombinant human collagen and production method thereof: CN, 103122027A. 2012-11-26 (in Chinese). 杨霞, 陆路. 一种重组人源胶原蛋白及其生产方法: CN, 103122027A. 2012-11-26.
[6] Fan DD, Duan MR, Mi Y, et al. High density fermentation of recombinant.for production of human-like collagen. J Chem Ind Eng (China), 2002, 53(7): 752–754 (in Chinese). 范代娣, 段明瑞, 米钰, 等. 重组.工程菌高密度培养生产人源型胶原蛋白. 化工学报, 2002, 53(7): 752–754.
[7] Zhang H. Expression and purification of recombinant human collagen-like and its application in cosmetics[D]. Guangzhou: Jinan University, 2017 (in Chinese).张卉. 重组类人胶原蛋白的表达纯化及在化妆品中的应用[D]. 广州: 暨南大学, 2017.
[8] Gao LH, Yang SL, Chu WH, et al. Construction of human-like collagen expression vector and its expression in. J Nanjing Univ Sci Technol: Nat Sci, 2008, 32(2): 252–256 (in Chinese). 高力虎, 杨树林, 储卫华, 等. 类人胶原蛋白表达载体的构建及在毕赤酵母中的表达. 南京理工大学学报: 自然科学版, 2008, 32(2): 252–256.
[9] Li LB, Fan DD, Ma XX, et al. High-level secretory expression and purification of unhydroxylated human collagen α1(III) chain inGS115. Biotechnol Appl Biochem, 2015, 62(4): 467–475.
[10] Zhang BJ, Zhou LN. Application of recombinant human collagen gel combined with wound crusting in deep second degree burn patients. J Guangxi Med Univ, 2018, 35(3): 323–327 (in Chinese). 张斌杰, 周丽娜. 重组人源胶原蛋白凝胶联合创面磨痂术在深Ⅱ度烧伤患者中的应用. 广西医科大学学报, 2018, 35(3): 323–327.
[11] Li WN, Shang ZF, Duan ZG, et al. Production of gastric-mucosa protective collagen Ⅲ by. Chin J Biotech, 2017, 33(4): 672–682 (in Chinese). 李伟娜, 尚子方, 段志广, 等. 毕赤酵母高密度发酵产Ⅲ型类人胶原蛋白及其胃粘膜修复功能. 生物工程学报, 2017, 33(4): 672–682.
[12] Islam MM, Cėpla V, He CL, et al. Functional fabrication of recombinant human collagen- phosphorylcholine hydrogels for regenerative medicine applications. Acta Biomater, 2015, 12: 70–80.
[13] Stahl PJ, Romano NH, Wirtz D, et al. PEG-based hydrogels with collagen mimetic peptide-mediated and tunable physical cross-links. Biomacromolecules, 2010, 11(9): 2336–2344.
[14] Liu XQ, Chen X. Application progress of human-like collagen combining with natural, synthetic and Nano materials as tissue engineering scaffolds. Med Recapit, 2017, 23(7): 1258–1262 (in Chinese). 刘旭倩, 陈潇. 类人胶原蛋白联合天然和人工合成及纳米材料作为组织工程支架材料的应用进展. 医学综述, 2017, 23(7): 1258–1262.
[15] 刘宏业, 郭书萍, 白莉. 医用重组人源胶原蛋白功能敷料对二氧化碳激光术后创面修复的临床观察. 中国药物与临床, 2015, 15(10): 1458–1460.
[16] 杨海龙, 赵晓冬, 赵莉, 等. 点阵激光联合类人胶原贴敷料治疗黄褐斑的疗效观察. 当代医学, 2017, 23(7): 134–136.
[17] Lu XY, Gao D, Wang R, et al. Study on the effect of human-like collagen dressing on facial seborrheic dermatitis and skin barrier function. J Pract Dermatol, 2014, 7(1): 25–27 (in Chinese). 路雪艳, 高第, 王嵘, 等. 类人胶原蛋白敷料治疗面部脂溢性皮炎疗效观察及对皮肤屏障功能的影响. 实用皮肤病学杂志, 2014, 7(1): 25–27.
[18] 杨海龙, 赵晓冬, 孙瑞, 等. 点阵激光联合类人胶原贴敷料治疗浅表性凹陷性痤疮瘢痕. 中国医疗美容, 2016, (2): 51–52.
Preparation and characterization of recombinant human-source collagen
Zengmiao Hou, Xiaoying Li, Min Li, Jinfang Yang, Xiaolin Yang, and Jinli Zhao
Shaanxi HuiKang Bio-Tech Co Ltd., Xi’an 710054, Shaanxi, China
This study aimed to obtain a recombinant human-source collagen for industrialization. First, based on the Gly-X-Y sequence of human type I collagen, we optimized the hydrophilic Gly-X-Y collagen peptide, designed the human collagen amino acid sequence and the corresponding nucleotide sequence. Next, the expression vector pPIC9K-COL was constructed via endonuclease digestion technology. We obtained an engineering strain of human-source collagen by electrotransforming, and then it was fermented, purified and identified. As a result, the expression level reached 4.5 g/L and the purity was over 95%. After amino acid N-terminal sequencing, molecular weight analysis, amino acid analysis and collagenase degradation test, we confirmed that the obtained collagen was consistent with designed primary structure of human-source collagen. After freeze-drying, we analyzed the collagen by scanning electron microscope and cell cytotoxicity, confirming that the collagen has porous fiber reticular structure and superior cytocompatibility. This indicates that human-source collagen has potential to be applied as biomedical material. In conclusion, we successfully obtained the expected human-source collagen and laid a foundation to its further application.
collagen, human-source,, biomaterial
June 29, 2018;
September 12, 2018
Yanta District Science and Technology Enterprise Small Giant Growing Plan (No. XJR1504).
Jinli Zhao. Tel/Fax: +86-29-83395165; E-mail: zhjl999@163.com
西安市雁塔区科技企业小巨人计划(No. XJR1504) 资助。
2018-10-18
10.13345/j.cjb.180266
http://kns.cnki.net/kcms/detail/11.1998.Q.20181015.1457.004.html
(本文责编 郝丽芳)

