干旱胁迫对薄壳山核桃叶片丙二醛含量和3种抗氧化酶活性的影响
姜宗庆,李成忠,余 乐,汤庚国
(江苏农牧科技职业学院,泰州 225300)
随着全球气候变暖,干旱气候呈高频率出现态势。据不完全统计,全球干旱半干旱地区约占土地面积的40%,我国干旱半干旱地区占国土面积超过50%[1-4]。干旱胁迫强度达到一定程度后,植物水分平衡被打破,将会对植物造成永久性伤害[5]。随着干旱处理时间的延长,植物表现为根系活力明显下降,呼吸作用降低[6]。植物在干旱胁迫条件下,叶片细胞体积变小,膜系统受到破坏,光合器官受到影响,角质层变厚,光合速率和蒸腾速率出现不同程度的下降[7-10]。干旱胁迫会导致植物体内丙二醛(MDA)含量和抗氧化酶活性发生变化,干旱胁迫下植物体内MDA含量增高,其可以作为衡量植物耐旱性强弱的重要指标[11]。植物受干旱胁迫后产生大量活性氧自由基,超氧化物歧化酶(SOD)和过氧化物酶(POD)可以保护植物细胞免受其造成的伤害[12-13]。水分亏缺会引起植物叶片过氧化氢酶(CAT)活性增强,减缓植物细胞的膜脂质过氧化[14-15]。
薄壳山核桃(CaryaillinoensisK.Koch)原产于美国或者墨西哥,属胡桃科山核桃属落叶乔木,又称美国山核桃或长山核桃,被我国作为珍贵的多用途树种引进[16]。刘春风等[17]研究表明,薄壳山核桃树体具有较强的耐涝性,造林前景广阔。赵靖明等[18-19]研究认为,薄壳山核桃幼苗的生长量和光合作用在盐胁迫下显著降低。前人关于薄壳山核桃逆境生理的研究报道较少,特别是薄壳山核桃耐旱性生理机制研究鲜见报道。本试验探讨干旱胁迫下,薄壳山核桃叶片中丙二醛含量和3种抗氧化酶活性的变化,旨在为不同水分管理条件下薄壳山核桃的栽植提供理论依据。
1 材料与方法
1.1 试验地点和材料
试验地位于江苏农牧科技职业学院园林园艺系苗木基地(北纬32°27′30.28″,东经119°56′20.40″),属亚热带季风气候,常年平均气温14.5℃,年平均积温5 365.6℃,常年平均降雨日118d,年平均降水量992.5mm,年平均日照时数22 059h,无霜期215d。
试验材料为薄壳山核桃1年生盆栽实生苗,每盆1株,平均苗高25cm,平均地径4.5mm。盆钵规格为30cm×40cm(上缘直径×高),每盆装土约10kg。盆土质地为沙壤土,pH 6.8,有机质13.1%,速效氮4.65 mg/kg,速效磷2.28 mg/kg,速效钾5.49 mg/kg。
1.2 试验方法
采用单因素随机试验设计,参照夏鹏云等[20]的方法,将PEG-6000溶于霍格兰营养液中,配制4种不同质量浓度的渗透液,并设对照(CK,霍格兰营养液),共5个处理(表1)。试验于2016年4月下旬进行,选取生长基本一致的健壮薄壳山核桃苗,每个处理20盆,3次重复。每5d浇1次处理液,以浇透土壤为准。试验开始后每5d取样1次,共采样7次。采集叶片样品置于液氮中快速冷冻,然后置于-70 ℃冰箱保存待测。

表1 不同浓度PEG-6000渗透液处理
1.3 测定项目与方法
丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性和过氧化氢酶(CAT)活性分别采用硫代巴比妥酸法、氮蓝四唑(NBT)染色法、愈创木酚染色法和紫外吸收法测定[21-22]。
1.4 数据处理
试验数据处理和分析均采用Excel 2013软件进行。显著性分析采用SPSS 20.0软件,P<0.05表示差异显著。
2 结果与分析
2.1 干旱胁迫下薄壳山核桃叶片MDA含量的变化
由图1可以看出,随着干旱胁迫程度的加强和胁迫时间的延长,薄壳山核桃叶片膜脂过氧化程度加剧,细胞受到的伤害变大,各干旱胁迫处理叶片MDA含量均高于CK,表现为P4>P3>P2>P1>CK。轻度胁迫P1处理在胁迫5d时,MDA含量略有下降,与CK 差异不显著;其他干旱处理的MDA含量显著高于CK。随着干旱程度的加剧和胁迫的持续,薄壳山核桃叶片中的MDA含量表现出一直上升的趋势。胁迫开始至第15天,P1、P2和P3处理的MDA含量增速较慢,之后增速加大,而重度胁迫P4处理的MDA含量一直呈快速上升趋势,胁迫30d时各处理间MDA含量差异显著。
2.2 干旱胁迫下薄壳山核桃叶片SOD活性的变化
由图2可以看出,重度胁迫P4处理的叶片SOD活性一直呈下降趋势,P1、P2和P3处理的SOD活性随胁迫时间延长呈先上升后下降的变化趋势。胁迫第5天后,各干旱处理的SOD活性均开始下降,表现为CK> P1> P2>P3> P4。干旱胁迫10—15d时,P1和P2处理的SOD活性略有回升,之后继续下降,20d后各处理的SOD活性均显著低于CK,重度胁迫P4处理与其他处理差异显著。

图1 干旱胁迫下薄壳山核桃叶片MDA含量的变化Fig.1 Changes of MDA content in leaves ofC.illinoensis under drought stress

图2 干旱胁迫下薄壳山核桃叶片SOD活性的变化Fig.2 Changes of SOD activity in leaves ofC.illinoensis under drought stress
2.3 干旱胁迫下薄壳山核桃叶片POD活性的变化
由图3可以看出,胁迫开始至第5天,P4处理的叶片POD活性下降,而P1、P2和P3处理的POD活性上升,第5天之后,各干旱处理的POD活性均下降,20d后,各干旱处理的POD活性均显著低于CK,表现为CK> P3> P2>P1> P4。
2.4 干旱胁迫下薄壳山核桃叶片CAT活性的变化
由图4可以看出,胁迫开始至第5天,干旱处理P1、P2和P3的叶片CAT活性均处于上升趋势,第5天时各干旱处理的CAT活性均显著高于对照,随后下降。第15天时,P1、P2和P3处理的CAT活性基本接近对照,而P4处理明显低于对照。干旱胁迫20d之后,各干旱处理的CAT活性均低于对照,此后一直下降,至30d时各干旱处理均显著低于对照,表现为CK> P1> P2> P3> P4。
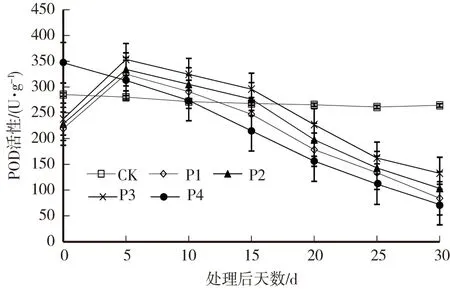
图3 干旱胁迫下薄壳山核桃叶片POD活性的变化Fig.3 Changes of POD activity in leaves ofC.illinoensis under drought stress
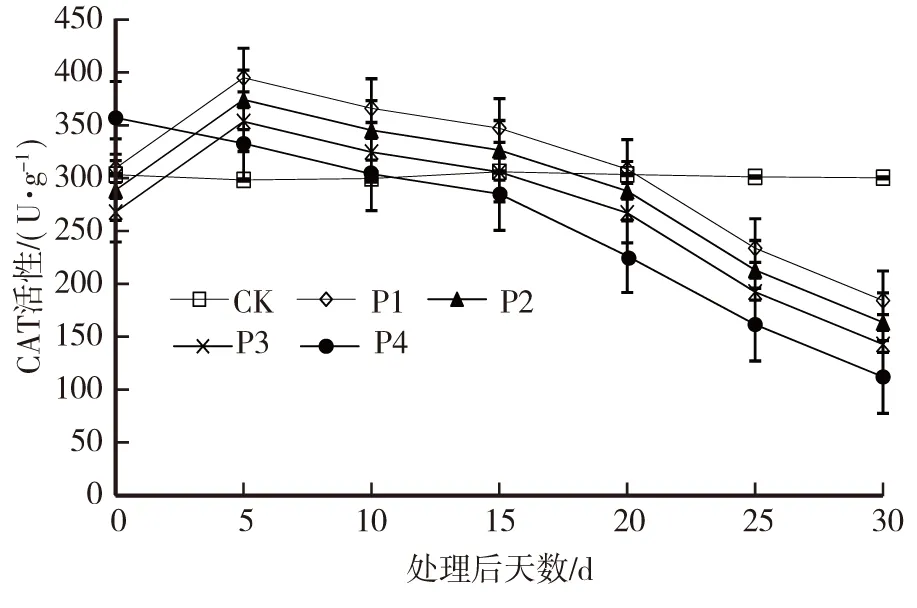
图4 干旱胁迫下薄壳山核桃叶片CAT活性的变化Fig.4 Changes of CAT activity in leaves ofC.illinoensis under drought stress
3 结论与讨论
水分亏缺是一种最普遍的影响植物生长的环境胁迫,胁迫强度与胁迫时长对植物均有影响[23]。MDA是植物受干旱胁迫时脂质过氧化作用的产物,可以用来表示植物细胞膜损伤程度[11]。本试验表明,薄壳山核桃叶片MDA含量随干旱胁迫强度增加而上升,重度胁迫P4处理的MDA含量最高,对照处理最低,各干旱处理叶片的MDA含量显著高于CK。随着胁迫时间延长,干旱处理薄壳山核桃叶片MDA含量继续上升,胁迫初期增速较慢,可能是因为薄壳山核桃在遭受干旱胁迫后的自身调节和保护,胁迫后期增速加大,说明随着干旱胁迫越来越重,叶片积累了大量的活性氧,从而促进了MDA的积累,导致叶片细胞膜的损伤不可逆。
当细胞脂质受到过氧化伤害时,植物体会调节保护酶活性来降低活性氧自由基带来的伤害,从而提高植物的抗逆性[24-27]。抗氧化酶活性可以反映植物膜系统受损伤程度,SOD、POD和CAT均是植物受逆境胁迫时起防御作用的重要保护酶[28-31]。本试验中,干旱处理的薄壳山核桃叶片SOD、POD和CAT活性均与对照差异显著。重度胁迫P4处理叶片的SOD、POD和CAT活性一直呈下降趋势,轻中度胁迫P1、P2和P3处理呈先上升后下降的变化趋势。随着胁迫时间延长,重度胁迫P4处理与其他处理的3种抗氧化酶活性均差异显著,胁迫初期叶片没有明显的伤害症状,胁迫末期各干旱处理的叶片表现出不同程度的脱水萎蔫,重度胁迫P4处理最为严重。其原因可能是薄壳山核桃植株在轻度干旱胁迫条件下,植物体内的保护酶会同时启动来抵御不良环境,植物具有一定的自身调节与适应机制,而重度干旱胁迫和持续干旱胁迫对细胞膜的伤害严重且不可逆。
综上所述,薄壳山核桃植株在轻度干旱胁迫条件下,能够调节自身SOD等保护酶活性来提高抗旱性,具有一定的抗旱耐旱能力;而在重度干旱胁迫条件下,遭受的胁迫伤害不可逆,说明保护酶的防御及自我修复能力存在一定阀值。

