蜂胶黄酮作为PPV灭活疫苗佐剂活性的研究
翟晓虎,徐传芬,张玲玲,贺卫华,马 霞,杨俊花
(1江苏农牧科技职业学院,泰州 225300;2新泰市汶南镇林业站,泰安 271200;3郑州市城市园林科学研究所,郑州 450000;4河南牧业经济学院,郑州 450046;5上海市农业科学院农产品质量标准与检测技术研究所,上海 201403)
猪细小病毒病是由猪细小病毒(Porcine parvovirus,PPV)引起的一种母猪繁殖障碍性疾病,其临床症状主要表现为母猪不孕、流产、畸弱胎或死胎等,给我国及世界养猪业造成巨大的经济损失。目前,该病尚没有特效治疗手段,疫苗免疫仍是预防该病的首选方法。2004年,上海市农业科学院率先研制成功了PPV灭活疫苗,以预防猪的细小病毒病[1]。
Joo等[2]发现家兔可作为PPV疫苗效力检验的实验动物,但豚鼠对PPV疫苗的血清学反应与猪相似,特别是在免疫油佐剂PPV疫苗后效果确切[3-6],因此,豚鼠是检验猪细小病毒病疫苗效力最理想的实验动物。
蜂胶作为猪细小病毒灭活疫苗免疫佐剂的研究已有报道[7],蜂胶黄酮(Propolis flavone,PF)是蜂胶的主要有效成分之一,具有抗炎、抗氧化、抗感染、抗过敏和增加免疫等作用[8-9]。以蜂胶黄酮作为佐剂的减蛋综合征(EDS-76)疫苗,免疫雏鸡后,其血液中T淋巴细胞比例显著增加,雏鸡免疫力提高[10]。本试验选取豚鼠作为猪细小病毒疫苗效检动物,探讨蜂胶黄酮作为猪细小病毒灭活疫苗佐剂对豚鼠体液免疫和细胞免疫的影响,以期为猪细小病毒灭活疫苗探寻更高效、安全的免疫佐剂提供参考。
1 材料与方法
1.1 材料
蜂胶购自禹州市凯旋药业有限公司,经鉴定为工蜂采集的植物树脂与其上颚腺、蜡腺等分泌物混合形成的固体胶状物。蜂胶黄酮(质量浓度相当于原药材1 g/mL)由河南牧业经济学院制药工程学院中兽医药教研室制备,黄酮含量为85%。PPV-SD1疫苗株和PK-15细胞均由山东省滨州畜牧兽医研究院提供。ELISA试剂盒购自R&D Systems Inc.。
1.2 动物饲养管理
99只健康水平良好,体重(300±5) g的豚鼠,购自北京中医药大学实验动物中心,PPV HI抗体效价呈阴性。饲养于标准的豚鼠笼中,每笼3只,每日早晨8:00定时饲喂,自由饮水,适应期2周。
1.3 PPV抗原的制备
按细胞常规培养方法[11]培养PK-15细胞,12—15 h后按5%的接种量接种PPV病毒,约有80%的细胞发生病变时收集病毒。豚鼠红细胞血凝试验检测血凝效价[12]30,同时检测病毒含量变化[12]26。
将收集的病毒置于37 ℃条件下,0.3%甲醛作用24 h灭活,不断搅拌。灭活病毒在PK-15细胞中连续传代3次,观察细胞病变以判断病毒灭活是否完全。取灭活后的PPV用于制备蜂胶黄酮佐剂和油佐剂PPV疫苗。
1.4 蜂胶黄酮佐剂PPV疫苗的制备
在灭活后的PPV中按病毒液与蜂胶黄酮3∶1(v/v)的比例加入蜂胶黄酮,按总体积的0.005%加入10%硫柳汞溶液,在3 000 r/min下使用胶体磨搅拌3—5 min,充分混合。
1.5 油佐剂PPV疫苗的制备
先将94%的白油与6%的司本-80混合,加入2%的硬脂酸铝,灭菌处理后用作油相;灭活后的PPV加入2%吐温-80作为水相,按照油相与水相5∶3(v/v)混合,按总体积的0.005%加入10%硫柳汞溶液,在10 000 r/min下使用胶体磨搅拌20 min,充分混合乳化。
1.6 疫苗的检验
1.6.1 无菌检验及甲醛、硫柳汞含量测定
参照《中华人民共和国兽用生物制品规程》(2000版)标准所述方法进行[13]。
1.6.2 安全检验
将24只豚鼠随机平均分为3组,每组8只,第1组每只左腿肌肉注射0.5 mL蜂胶黄酮PPV疫苗,第2组每只左腿肌肉注射0.5 mL油佐剂PPV疫苗,第3组每只注射同等体积生理盐水,每日观察临床症状,连续观察21 d。
1.7 试验设计
2015年9—11月,将经疫苗检验合格的所有实验动物随机分为5组,每组15只,分别进行如下处理:(1)左腿肌肉注射0.5 mL蜂胶黄酮佐剂PPV灭活疫苗(PFA);(2)肌肉注射油佐剂(OA)PPV灭活疫苗+口服1 mL蜂胶黄酮(终质量浓度0.05 g/mL)(OA-PFApo);(3)肌肉注射油佐剂(OA)PPV灭活疫苗+1 mL蜂胶黄酮(终质量浓度0.05 g/mL)(OA-PFAim);(4)肌肉注射油佐剂PPV 灭活疫苗0.5 mL(OA);(5)左腿肌肉注射0.5mL生理盐水作为空白对照,2周后相同剂量和给药方式进行二次免疫。
分别于首次免疫后的第7天(D7)、第14天(D14)、第21天(D21)、第28天(D28)、第35天(D35)和第49天(D49)对5个试验组每只豚鼠进行心脏采血,采血量0.5 mL。采用β-微量法测定各处理组血清中PPV HI抗体含量,于D7、D21、D35测定血清中IgG、IgM及细胞因子IFN-γ、IL-2含量。
1.6 数据分析
所有数据用SPSS软件进行Duncan多重分析,结果用“mean±SE”表示,P<0.05表示差异显著。
2 结果与分析
2.1 疫苗的检验结果
无菌检验及甲醛、硫柳汞含量测定结果显示:蜂胶黄酮佐剂和油佐剂PPV疫苗无菌检验均合格,甲醛、硫柳汞含量均符合规定。
安全检验结果显示:观察期内,各组豚鼠存活率为100%,且均未出现局部和全身的不良反应。
2.2 蜂胶黄酮对PPV疫苗HI抗体生成的影响
表1显示,首免后D7,PFA、OA-PFApo、OA-PFAim组HI抗体效价均显著高于OA组。首免后D14、D21,OA-PFAim组HI抗体效价显著高于PFA和OA-PFApo组,后者显著高于OA组。首免后D28,OA-PFAim组HI抗体效价显著高于OA-PFApo组,后者显著高于PFA和OA组。首免后D35、D42、D49,OA-PFAim组HI抗体效价均显著高于PFA、OA-PFApo和OA组(表1)。

表1 HI抗体效价的动态变化
注:同列数据标注不同字母表示差异显著(P<0.05);“-”表示HI抗体阴性
2.3 蜂胶黄酮对免疫PPV疫苗IgG生成的影响
首免后D7、D21、D35,PFA、OA-PFApo、OA-PFAim处理组血清IgG含量均显著高于OA组,但PFA、OA-PFApo、OA-PFAim处理组间差异不显著(图1)。
2.4 蜂胶黄酮对免疫PPV疫苗IgM生成的影响
首免后D7、D21,PFA和OA-PFAim组血清IgM含量显著高于OA-PFApo。OA-PFApo组显著高于OA组。首免后D35,PFA、OA-PFApo、OA-PFAim、OA组间血清IgM含量差异不显著(图2)。

图1 各组IgG的变化 Fig.1 Change of IgG level in serum of guinea pigs of different groups
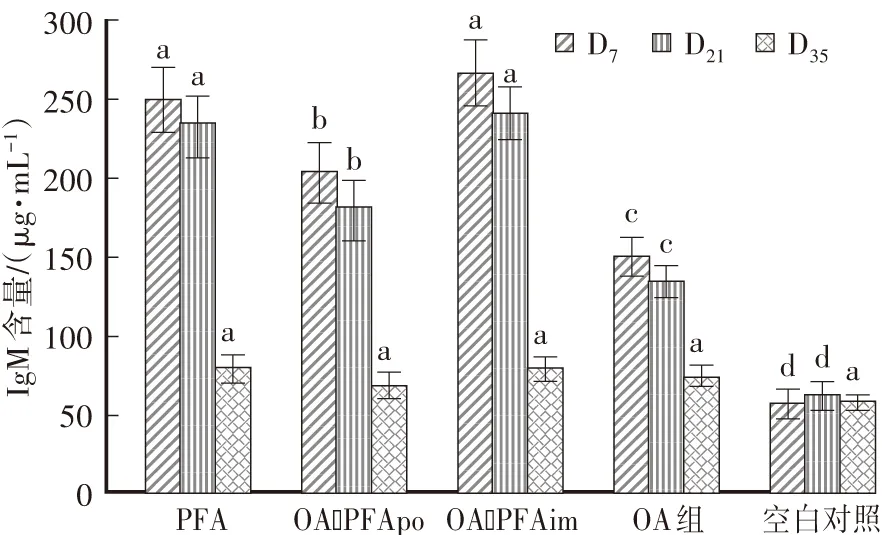
图2 各组IgM的变化 Fig.2 Change of IgM level in serum of guinea pigs of different groups
2.5 蜂胶黄酮对免疫PPV疫苗IFN-γ生成的影响
首免后D7、D21,PFA和OA-PFAim组血清IFN-γ含量显著高于OA-PFApo,OA-PFApo组IFN-γ含量显著高于OA组。首免后D35,各组血清IFN-γ含量差异不显著(图3)。
2.6 蜂胶黄酮对免疫PPV疫苗IL-2生成的影响
首免后D7、D21,PFA和OA-PFAim处理组的血清中IL-2水平显著高于OA-PFApo。OA-PFApo处理组的血清IL-2水平显著高于OA组。D35时,PFA和OA-PFAim组的血清IL-2水平显著高于OA组(图4)。
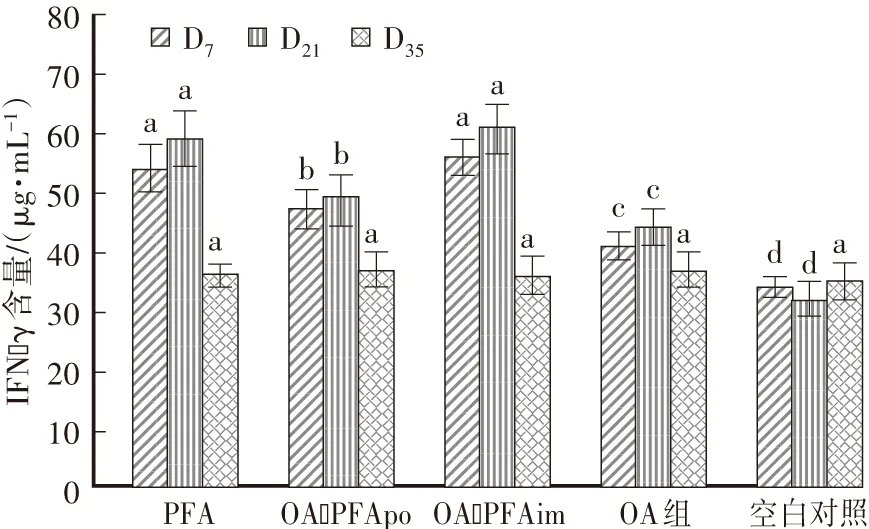
图3 各组IFN-γ的变化Fig.3 Change of IFN-γ level in serum of guinea pigs of different groups
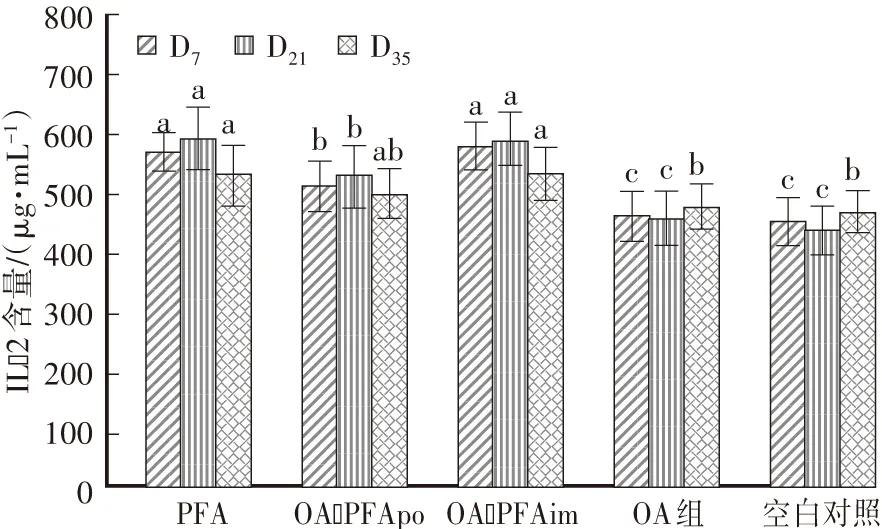
图4 各组IL-2的变化Fig.4 Change of IL-2 level in serum of guinea pigs of different groups
3 讨论
马霞等[14]用家兔模型确定了纳米蜂胶黄酮对猪细小病毒疫苗具有很好的佐剂活性,本试验以豚鼠为动物模型再次验证了蜂胶黄酮的佐剂活性,结果表明:与油佐剂组相比,蜂胶黄酮佐剂可以提高豚鼠的细胞免疫和早期体液免疫。免疫OAPPV疫苗同时肌注蜂胶黄酮可以显著提高豚鼠的体液免疫和细胞免疫,免疫OAPPV疫苗同时口服蜂胶黄酮只可以显著提高豚鼠的早期体液免疫。
将几种蜂胶黄酮的疫苗佐剂使用途径进行比较,结果表明:免疫OAPPV疫苗同时肌注蜂胶黄酮的方式最好,其次是蜂胶黄酮佐剂直接加到灭活PPV中制备疫苗,免疫OAPPV疫苗同时口服蜂胶黄酮的效果最差。由于油佐剂具有引起脓肿、致癌、佐剂性关节炎等不良反应[15-16],且从动物福利和动物性食品安全角度出发,也应该寻找相应的替代佐剂。蜂胶黄酮佐剂直接加到灭活PPV中制备疫苗的免疫效果在体液免疫特别是免疫早期显著优于油佐剂PPV疫苗,细胞免疫指标也显著优于油佐剂。因此,蜂胶黄酮可以作为一种安全的疫苗佐剂直接加入到灭活的PPV抗原中用于制备疫苗。
与油佐剂PPV疫苗相比,蜂胶黄酮佐剂PPV疫苗可以显著提高血清中IFN-γ、IL-2等细胞因子的含量,增强疫苗细胞免疫效果;并能够显著提高血清免疫早期IgG、IgM含量,增强机体的体液免疫效果。沈志强等[17]将蜂胶作为禽霍乱疫苗佐剂,可以促进早期特异性抗体的产生。此外,赵恒章等[18]比较了油佐剂、蜂胶和铝胶作为巴氏杆菌灭活苗的佐剂效果,显示油佐剂灭活苗和蜂胶灭活苗的保护期相似,但应用蜂胶佐剂灭活苗后,血清抗体水平上升速度比油佐剂苗快,且保护率较高。这种作用效果特点对免疫动物顺利度过疫苗免疫后抗体产生的空档期具有重要的意义。

