小麦 TaSPL17 基因在苗期对不同激素处理的响应
高新梅,张金民,崔桂宾,孙风丽,张 超,刘曙东,奚亚军
(1.西北农林科技大学农学院,陕西杨凌 712100; 2.商丘市农林科学院,河南商丘 476000)
SPL(SQUAMOSAPROMOTERBINDINGPROTEIN-LIKE) 基因家族具有高度保守的SBP结构域,参与调控植物根系的生长、叶片的发育、分枝/分蘖的生长、穗结构的形成以及对激素的响应等,在所有的绿色植物中都有发现[1]。2010年,Jiao[2]和Miura等[3]同时在水稻中克隆获得OsSPL14/OsIPA1基因,并发现该基因表达量受miRNA156调控,影响水稻株型的发育。OsSPL14基因过量表达会抑制水稻无效分蘖的生成,使茎秆粗壮,增加抗倒伏能力,最终可使产量增加10%[2]。近年来,在水稻中陆续发现OsSPL7、OsSPL17和OsSPL16基因可以负向调控水稻分蘖的形成[4-5];OsSPL16、OsSPL13正向调控水稻谷粒的大小[5-6];OsSPL14在不同组织中的差异表达受泛素化水平调控[7],能够直接与株型相关基因TB1以及独角金内酯(SLs)信号途径的D53结合[8-9],调控水稻植株形态的建成。与水稻相比,小麦SPL基因的研究较为滞后,2014年,Zhang等[10]对小麦基因组进行生物信息学分析,并预测了小麦中8个SPL基因的功能。通过分析不同种质资源SPLs基因等位点变化与农艺性状的关系发现,TaSPL20/TaSPL21对小麦株高和千粒重有较大影响[11]。TaSPL3和TaSPL17的基因序列中含有miRNA156识别位点,与OsSPL14有较高的同源性,可以上调分蘖相关基因TaTB1的表达,而这一过程受到TaD53的调控[12-13],说明TaSPL13/17基因参与SLs信号途径对小麦分蘖发育的调控过程。
独脚金内酯(SLs)作为一种新型植物激素,主要在植物根部合成后通过茎部向上运输,具有刺激寄生植物列当和独脚金种子的萌发、抑制植物分枝形成、调控植物根系生长和叶片衰老等生物学功能[14]。生长素是最早被用于植物科学研究的激素之一,主要在植物根尖、茎尖、初生叶片等幼嫩组织中合成,经过极性运输可以使不同器官之间出现生长素浓度差,调控植物的向性生长、根系的发育、分枝/分蘖的形成等植株形态的建成[15]。细胞分裂素常与其他激素一起调控植物的生长发育[16]。研究发现,独脚金内酯(SLs)、生长素(IAA)和细胞分裂素(CTK)在调控植株根系发育与分枝/分蘖的生长方面具有一定的联系,三者相互作用,共同影响植株形态的建成[17-18]。
张铁怀等[19]对TaSPL17基因进行半定量分析,发现该基因在小麦茎基部和根部都有表达;Kerr等[20]进一步研究发现,TaSPL17基因可以直接与SLs信号途径相互作用,调控植株分蘖的生长;目前尚未发现TaSPL17基因与IAA和CTK信号途径间的关系。为了探索独脚金内酯、生长素和细胞分裂素等途径与TaSPL17基因的关系,本研究使用不同浓度的独脚金内酯人工合成类似物GR24、生长素IAA、细胞分裂素6-BA处理小麦幼苗,检测TaSPL17基因的表达情况,探究TaSPL17基因与三种激素信号的关系,以期为TaSPL17基因的作用机制以及SLs、IAA和CTK三大激素信号途径的研究提供参考。
1 材料与方法
1.1 材 料
试验所用材料为陕西关中地区小麦主栽品种小偃22,选用当年收获的种子。取籽粒饱满,大小一致的小麦种子,使用砂培法进行种子萌发。7天后,挑选长势一致的幼苗在培养箱中进行水培。培养条件为15 ℃暗培养10 h,20 ℃光照培养14 h,光量子密度为300 μmol·m-2·s-1(TES-1339)。水培液为1/2霍格兰氏营养液,每隔2 d 更换一次培养液。幼苗长至三叶期时,选取长势相同的植株分别种在不同的花盆进行水培,每盆4株。
1.2 激素处理
在培养液中分别施加不同浓度的独脚金内酯人工合成类似物GR24、生长素IAA和细胞分裂素6-BA,进行激素处理。GR24处理浓度为0、0.04、0.4和4 μmol·L-1,IAA和6-BA处理浓度相同,均为0、0.001、0.1和10 μmol·L-1。培养5 h,重复3次。取小麦根部和0.5 cm的茎基部在液氮中速冻,-80℃保存备用。
1.3 TaSPL17 基因的表达分析
用RNAiso Plus(TaKaRa,日本)提取小麦总RNA。用PrimeScripTMRT反转录试剂盒(TaKaRa,日本)按照说明书进行cDNA第一链的合成。以TaActin基因(F:GCCGTTCTGTCC TTGTATGC,R:CCTGACCATCAGGCATCT CA)为内参,用TB GreenTMPremix Ex TaqTMⅡ荧光定量试剂盒(TaKaRa,日本)在QuantStudioTM 7 FlexReal-Time PCR System (ABI,美国)进行实时荧光定量反转录PCR(qRT-PCR),检测TaSPL17基因(F:CGACTCGCCG CATCCTTT,R:CTGCTGTATGCG TGGTGGC)的相对表达量。反应体系与程序按照试剂盒说明书进行,其中循环数为40,退火温度为60℃,延伸时间为31 s。
用2-△△CT法计算TaSPL17基因的相对表达量,用IBM SPSS Statistics 22 软件对数据进行方差分析和LSD多重比较分析。
2 结果与分析
2.1 GR24对小麦苗期TaSPL17基因表达的影响
为了研究SLs对小麦苗期TaSPL17基因表达的调控,用不同浓度的GR24处理小麦幼苗根系,利用qRT-PCR技术检测TaSPL17基因的相对表达量,结果(图1)发现,不同浓度的GR24处理后,小麦根部和茎基部TaSPL17基因的表达量均出现极显著下降,其表达水平与处理所用的GR24浓度成反比。与根部相比,小麦茎基部TaSPL17基因表达量的下降程度较高,在GR24浓度为0.04 μmol·L-1时即下降了70%左右,而根中只下降了30%左右,但随着浓度的增加,茎基部TaSPL17的表达量变化不如根中明显。这进一步说明,在调控小麦苗期根系的生长和茎基部发育中,TaSPL17基因与SLs途径有一些联系,特别是在调控小麦茎基部发育时,二者关系较为密切。
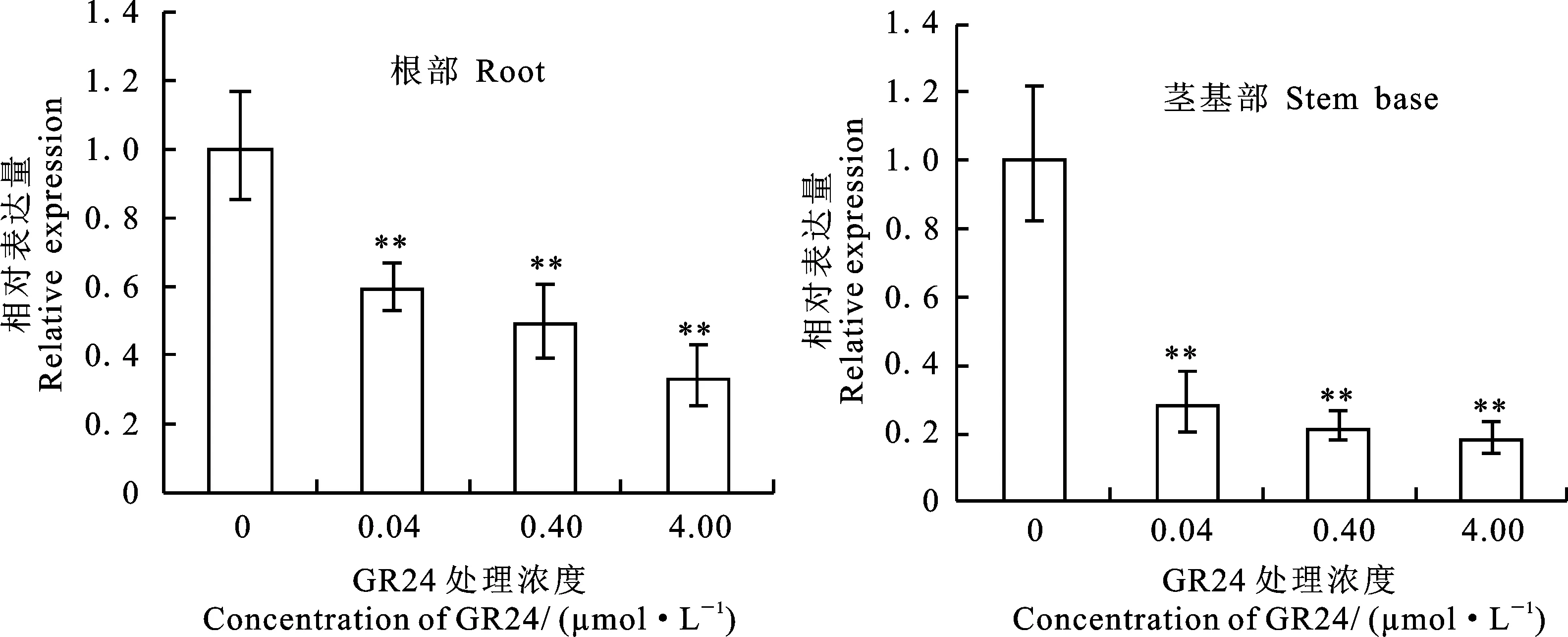
* 和**分别表示激素处理与对照间差异显著(P<0.05)和极显著P<0.01)。下同。
*and** mean significant difference between hormone treatments and CK at 0.05 and 0.01 levels,respectivly.The same in tables 2 and 3.
图1GR24对小麦苗期根部和茎基部TaSPL17基因表达的影响
Fig.1EffectofGR24onTaSPL17geneexpressionattherootandstembaseofwheatseedlings
2.2 外源IAA对小麦苗期 TaSPL17 基因表达的影响
在探究TaSPL17基因与IAA信号的关系中,参考经典的植物根、茎、芽对生长素敏感性曲线,采用不同浓度的IAA处理小麦幼苗,检测TaSPL17基因的表达情况,结果发现,外源施加IAA可以显著下调小麦苗期TaSPL17基因的表达(图2)。与正常小麦植株相比,外源施加IAA会使小麦苗期根部和茎基部TaSPL17基因的表达量出现极显著性下降;并且IAA处理浓度为0.1 μmol·L-1(促进芽生长的最适浓度)时,TaSPL17基因在2个部位中的表达量均降到最低,继续增加IAA的浓度,TaSPL17的表达量反而上升。进一步对比TaSPL17在根部和茎基部对生长素的响应,发现在IAA浓度为0.001 μmol·L-1时根中TaSPL17的表达量降低了51%,而茎基部中降低了82%。说明在小麦苗期根部与茎基部的生长发育中TaSPL17基因与生长素途径具有一定的联系,其中二者在茎基部的联系更加紧密。
2.3 6-BA对小麦苗期 TaSPL17 基因表达的影响
细胞分裂素是调控植物器官发育的重要植物激素之一,有关研究认为其主要是和生长素协同作用调控分生组织的分化。IAA/CTK比值直接影响植物侧根发育与腋芽分生组织的分化[21]。用不同浓度的6-BA处理小麦幼苗,检测小麦苗期根部和茎基部TaSPL17基因的表达情况。从图3可以发现,与对照相比,外源施加6-BA使小麦幼苗根部和茎基部的TaSPL17基因表达量出现显著降低;其中根部TaSPL17基因在6-BA处理浓度为0.001 μmol·L-1时表达量最低,并且随着6-BA处理浓度的升高基因的表达量出现上升趋势;而茎基部TaSPL17基因的表达量随6-BA处理浓度的升高持续下降。表明在小麦苗期根系和茎基部分蘖芽的生长中,TaSPL17基因与6-BA所起的作用有一定的联系。

图2 IAA对小麦苗期根部和茎基部 TaSPL17 基因表达的影响

图3 6-BA对小麦苗期根部和茎基部 TaSPL17 基因表达的影响
3 讨 论
植物根的形成与多种因素有关,生长素在其中起关键作用,适宜浓度的生长素可以直接促进侧根原基的启动[22],也可以通过调控根部细胞分裂素的合成来影响不定根的发生[23]。细胞分裂素可以独立调控不定根的发育,也可以与生长素共同作用调控根的发育[24]。独脚金内酯可以依赖于不同植物激素,正向调节拟南芥初级根的伸长和分生组织细胞数的增加,负向调节侧根的形成,如GR24处理拟南芥幼苗可以降低根部生长素运输载体PIN1的浓度,调节根部参与侧根原基发育的生长素通量,进而调控侧根的生长发育[25-26]。
本研究发现IAA、6-BA、GR24处理小麦幼苗,都可以使小麦根部TaSPL17基因的表达量降低,说明TaSPL17对小麦苗期不定根生长的作用,有一部分可以通过生长素、细胞分裂素和独脚金内酯途径完成。并且本研究参考经典的植物根、茎、芽对生长素敏感性曲线,进行不同浓度IAA处理小麦幼苗,发现TaSPL17基因的表达在0.1 μmol·L-1处出现了最低值,推测TaSPL17基因与 IAA信号途径关系较为密切。Yu等[27]在拟南芥中研究发现,miRNA156过量表达或者其靶基因SPLs缺失都可以增加拟南芥侧根的数量;外源施加生长素IAA,处理12 h后,miRNA156和SPLs都有极显著的增加,说明miRNA156-SPLs参与了生长素对拟南芥侧根发育的调控。本研究发现,在外源IAA处理后,TaSPL17基因表达量出现下降,这与Yu等[27]发现的AtSPLs表达水平上升的结果相反,这可能与供试物种与时间不同有关,具体原因还有待进一步验证。
生长素主要在植物根尖、茎尖、初生叶片等幼嫩组织中合成,由植物形态学上端极性运输到形态学下端,抑制侧芽的生长,形成顶端优势。细胞分裂素可以直接下调分蘖相关基因TB1/BRC1的表达来激活侧芽的生长,独脚金内酯可以直接或间接上调TB1/BRC1的表达来抑制侧芽的生长,二者对TB1/BRC1调控过程是分开独立的[28-29]。对豌豆和拟南芥的研究发现,生长素可以通过调控细胞分裂素和独脚金内酯生物合成相关基因的表达调节茎间细胞分裂素和独脚金内酯的浓度,进而影响侧芽的生长[30-31]。同时,细胞分裂素和独脚金内酯也可以通过调控茎中生长素运输载体PIN1的浓度调节侧芽处生长素的浓度[32]。由此可见,植物分枝/分蘖的形成是由生长素、细胞分裂素和独脚金内酯等激素相互作用,共同调控的结果。
本研究用IAA、6-BA、GR24处理小麦幼苗,发现小麦茎基部TaSPL17基因的表达量都会出现显著下调,说明TaSPL17基因在调控小麦苗期分蘖芽生长过程中,可能参与了生长素、细胞分裂素和独脚金内酯途径。有研究发现,TaSPL17基因可以直接与分蘖相关基因TB1结合,激活TB1的转录,抑制植株分蘖的形成,并且在分子机制的研究中发现,TaD53可以在一定程度上抑制TaSPL17基因与TB1结合,同时过量的SLs可以反馈调节TaD53基因,使TaD53蛋白发生降解[9,13]。本试验发现,不同浓度的GR24处理小麦幼苗,可以抑制小麦茎基部TaSPL17基因的表达,推测外源施加GR24会使小麦中TaD53发生降解,对TaSPL17基因与分蘖相关基因TB1结合的抑制作用减弱,使TaSPL17基因的转录水平下降。

