小麦近等基因系幼穗二棱期转录组分析
李文静,赵新颖,纪萌琦,郭 鑫,郭 红,邓志英,田纪春
(山东农业大学农学院/作物生物学国家重点实验室/小麦品质育种研究室/山东小麦玉米周年高产高效生产协同创新中心,山东泰安 271018)
小麦是世界主要的粮食作物之一,全世界有30%以上的人口以小麦为主粮[1]。抽穗期是与小麦适应性直接相关的一个性状,对小麦适应环境具有至关重要的作用[2-3]。小麦穗分化期根据其在分化过程中所出现的形态特征,可以分为9个时期,依次为茎叶原基分化期、生长锥伸长期、单棱期、二棱期、颖片原基分化期、小花原基分化期、雌雄蕊原基分化期、药隔形成期和四分体形成期,其发育进程直接影响小麦抽穗开花时间[4-5],其中,二棱期与小麦抽穗期的关系最密切[6-8]。研究抽穗期不同材料间二棱期差异表达基因,对挖掘和解析开花期相关基因、推进小麦育种进程具有重要价值。
转录组测序(RNA-seq)技术可以在没有完整基因组序列的前提下,对转录组产物mRNA进行高通量测序,全面快速地获得某一物种特定组织或器官在某一状态下的完整表达信息。作为一种宏观的整体论方法,转录组学改变了以往选定单个基因或少数几个基因的研究模式,将植物功能基因组学研究带入了一个全新的高速发展时代。利用该技术,Zhang等[9]以荔枝休眠芽和圆锥花序形成期的花芽为材料,发现大量差异表达基因富集在激素代谢和信号转导途径上;Kumar等[10]以小麦HD2329为材料,检测到1 525个显著差异表达转录本与高温胁迫相关,其中27个在高温胁迫下显著上调;高温明显影响细胞代谢、蛋白质磷酸化和氧化还原过程;Wei等[11]对小麦品种农大211的籽粒和茎叶转录组进行高通量测序分析,检测到61 393个基因参与籽粒发育过程,其中,7 355个差异表达基因在籽粒中上调表达,许多与糖类和蛋白质代谢相关的转录本和转录因子在籽粒中大量富集。
小麦基因组比较复杂,其穗发育分子机制的研究进展比较缓慢[12-15]。近期,Feng等[16]利用中国春进行了小麦花发育不同阶段的转录组分析,试图找到特定发育阶段的调控基因;Wang等[17]测定了90个冬小麦品种二棱期转录组,并进行差异表达基因与性状的相关性分析,发现了控制小麦穗结构的调控因子。小麦近等基因系的遗传背景高度相似,有利于排除背景差异造成的干扰,是解析遗传机制的良好材料。因此,本研究拟选取抽穗期明显不同的两个近等基因系二棱期幼穗为材料,利用RNA-seq转录组测序方法筛选差异表达基因,通过功能注释与通路分析,建立小麦穗发育早期的分子学研究平台,为解析小麦抽穗期调控机制、挖掘小麦抽穗期相关基因奠定理论基础。
1 材料与方法
1.1 供试材料与处理方法
从BC5的F3群体(由DH60和Y57构建,Y57为轮回亲本)通过前景和背景标记选择,筛选到背景回复率接近100%的近等基因系96-2,抽穗期与Y57相差10 d;96-2在四叶期时已达到二棱期,而Y57则在五叶期时达到二棱期。以近等基因系Y57(抽穗期196 d)和96-2(抽穗期184 d)为材料,挑选其饱满无病害的种子在室温下发芽后,转移至人工智能气候箱(浙江宁波江南仪器厂)中4 ℃春化4周。春化完成后,挑选长势一致的植株种植在山东农业大学温室(16 h光/8 h暗,18~25 ℃),单株种植,每个材料种植100 株,3个重复。白天采取自然光,夜晚用白炽灯补光,使光照时间达到16 h。植株达到三叶期时开始观察幼穗发育阶段。两天取样一次,每个材料选取5 株健壮、生长均匀的植株,用解剖针除去叶片,在体视显微镜(PS24C)下进行观察,并记录每个时期幼穗的表型发育情况。到达二棱期时,每个材料取25~30个幼穗,立即投放到液氮中,然后保存于-80 ℃冰箱中备用。
1.2 RNA文库构建及转录组测序
采用Trizol提取法分别提取Y57和96-2幼穗总RNA,并用NanoDrop 2000检测RNA浓度和OD260/OD280、OD260/OD230比值。用Agilent 2000进一步检测RNA浓度和28S/18S比值。每个样取1 μg总RNA,利用Oligo(dT)的磁珠富集纯化mRNA;在富集得到的mRNA中加入fragmentation buffer,将mRNA进行随机打断;以打断的mRNA为模板,用六碱基随机引物合成第一条cDNA链,然后加入缓冲液、dNTPs、RNase H和DNA polymerase I合成第二条cDNA链;利用AMPure XP beads纯化cDNA;对纯化的双链cDNA再进行末端修复、加A尾并连接测序接头;用AMPure XP beads选取合适大小的目的片段(300~400 bp),通过PCR得到cDNA文库。
文库检测合格之后,由北京百迈客生物科技有限公司使用HiSeq2500进行高通量测序,测序读长为PE125。将测序得到的Raw data进行数据过滤(去除测序接头序列、重复冗余序列、低质量序列),获得高质量序列数据clean data。采用TopHat2[18]将各样品测序得到的clean data与中国春参考基因组进行序列比对以获得mapped data。
1.3 qRT-PCR分析
从差异表达基因中挑选2个表达趋势不同的基因,利用Primer-NCBI 在线设计软件(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计引物,对ID为Traes_5DL_9CC4EC839(F:5′ -TGAAGGCCAAGGTTGAGACA,R:5′-CGCT GGATGAATGCTGGTAGTTG)和Traes_6DL_7892214C8(F:5′-TGCGGGTCAAATGCGTC GTC,R:5′-CCAGAAGTTGCCGTCGTCCAT C)的基因进行实时荧光定量PCR 分析。将各样品的RNA 采用第1 链cDNA 合成试剂盒(TaKaRa)反转录为cDNA,以反转录产物为模板,以Actin(F:5′-ACCTTCAGTTGCCCAGC AAT-3′; R:5′-CAGAGTCGAGCACAATACC AGTTG-3′)为内参,采用QIAGEN 公司的SYBR Green RT-PCR 试剂盒,利用ABI 7500荧光定量PCR仪(ABI )进行检测。反应体系20 μL:2×Mix 10 μL,引物各(10 μmol·L-1) 0.4 μL,cDNA 2 μL,ROX校准液 0.4 μL,6.8 μL ddH2O。反应程序:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s ,40个循环。熔解曲线分析:95 ℃ 15 s,60 ℃ 60 s;95 ℃ 30 s,60 ℃ 15 s。 每对引物均设置空白对照;3次重复。采用相对定量2-ΔΔCt法进行结果分析。
1.4 基因表达差异分析
利用FPKM[19]值反映对应基因的表达量,使用EBSeq[20]进行差异表达基因分析,获得两个样品间的差异表达基因集。在差异表达基因检测过程中,将Fold Change≥2且FDR<0.01作为筛选标准。差异倍数(fold change)表示两样品(组)间表达量的比值。采用Benjamini-Hochberg法校正差异显著性P值,得到错误发现率(false discovery rate,FDR)。
1.5 差异表达基因功能注释分析
使用BLAST软件将差异表达基因与Nr(non-redundant protein sequence database in GenBank)、Swiss-Prot(Swiss-Prot protein sequence database) KEGG数据库的序列进行比对,获得注释信息。利用比对软件BLASTX,将差异表达基因与COG(clusters of orthologous groups of proteins)数据库进行比对分析,获得差异表达基因的COG功能注释及其分类;利用Blast2GO[21]软件将差异表达基因序列与GO(gene ontology)数据库进行比对,进行功能注释,然后利用WEGO软件[22]对GO功能分类统计。将差异表达基因与KEGG(Kyoto encyclopedia of genes and genomes)数据库进行BLASTX比对,获得差异表达基因相对应的Pathway注释信息。
2 结果与分析
2.1 近等基因系幼穗发育形态及表型分析
Y57与96-2幼穗分化起始时间一致(图1),均在三叶期开始分化,但Y57的伸长期至单棱期和单棱期至二棱期持续时间均比96-2相应时期长。四叶期时,Y57刚进入单棱期,而96-2已处于二棱期;五叶期时,Y57到达二棱期,96-2已处于雌雄蕊分化期;七叶期时,Y57到达雌雄蕊分化期,96-2处于药隔形成期。除了抽穗期以外,其他性状二者均没有显著差异(表1)。

A~D依次为Y57伸长期、单棱期、二棱期、雌雄蕊分化期;E~H依次为96-2伸长期、二棱期、雌雄蕊分化期、药隔形成期。
A-D indicate elongation stage,single ridge stage,double ridge stage,and pistil and stamen differential stage of Y57,resepectively; E-H indicate elongation stage,double ridge stage,pistil and stamen differential stage,and anther separation stage of 96-2,respectively.
图1近等基因系幼穗发育动态
Fig.1Developmentofyoungspikeofnearisogeniclines

表1 近等基因系(NIL)96-2和Y57表型分析Table 1 Phenotypic data of near-isogenic lines(NIL) 96-2 and Y57
同列数据后不同字母表示差异显著(P<0.05)。
Different letters following data at same column indicate significant differences between NILs at 0.05 level.
2.2 RNA转录组测序产量分析
通过高通量测序,Y57和96-2分别获得25 123 097和30 481 790条pair-end read,每个样品均获得6.3 G以上的碱基,各样品Q30碱基百分比均大于85.5%(表2),表明转录组测序得到的结果可靠。Y57和96-2与中国春基因组比对成功的read数量分别为38 021 371和42 375 610,占总read数的63.11%和69.51%,比对到参考基因组唯一位置的read数在clean read 中所占的比率分别为56.07%和61.59%(表2),表明两个样品的read数与参考基因组的比对效率较高,可以进行下一步分析。

表2 测序数据评估及比对分析Table 2 Statistical results of sequencing data
2.3 差异表达基因分析
采用FPKM值作为衡量基因表达水平的指标,在差异表达基因检测过程中,以Y57为对照组,将Fold Change≥2且FDR<0.01作为筛选标准。共筛选出395个差异表达基因(图2),其中,上调和下调基因分别为138个和257个,与Nr数据库对比得到382个注释基因。对筛选出的差异表达基因根据其相同或相似表达模式进行了聚类分析(图3),发现有6种模式,其中,基因在2个材料中的差异表达主要在前5种模式上。在上调表达基因中,表达量差异最大的2个基因均编码丝氨酸/苏氨酸蛋白磷酸酶2A,log2(Y57 FPKM/96-2 FPKM)值分别为7.36和5.74。
2.4 差异表达基因COG分类分析
对已注释的382个差异表达基因进行比对和功能注释,结果表明,在COG功能分类体系中,共有103个差异表达基因获得了功能注释,涉及20个COG功能类别(图4)。其中,一般功能基因(general function prediction only)所占比例最大,有25个基因;其次为信号传导(signal transduction mechanism)和转录(transcription)相关基因,分别有15和13个。

火山图中每个点表示一个基因,红色点表示基因表达没有达到显著性差异,蓝色点表示基因表达达到显著性差异。
Each dot indicates one gene. The red dot shows no significant difference of gene expression, and the blue dot is the gene expression with significant difference.
图2差异表达基因统计及其火山图
Fig.2Statisticsofdifferentiallyexpressedgenesanditsvalcanochart
2.5 差异表达基因GO分类分析
对已注释的382个差异表达基因进行GO功能注释和分类统计。共有298个基因获得GO功能注释,主要为细胞组分(cellular component)、分子功能(molecular function)和生物学过程(biological process) 3大类别,分别包含17、17和20个功能分类(图5)。在细胞组分分类中,涉及细胞组分(cell part)的差异表达基因(DEG)所占比例最多,占85.23%,其次是涉及细胞(cell)和细胞器(organelle)的DEG,分别占80.53%、73.83%;而涉及到细胞外基质部分(extracellular matrix part)、胶原三聚体(collagen trimer)、病毒体(virion)及其组分(virion part)的DEG所占比例最低。在分子功能分类中,与结合相关的DEG所占比例最多,占64.42%,其次是与催化活性(catalytic activity)和核酸结合转录因子活性(nucleic acid binding transcription factor activity)相关DEG,分别占45.97%和12.08%。在生物学过程中,与细胞进程(cellular process)相关的DEG所占比例最多,占75.50%,其次为与代谢过程(metabolic process)相关的DEG,占74.16%;而与生物附着(biological adhesion)和运动力(locomotion)相关DEG所占比例不到0.1%。
2.6 差异表达基因KEGG通路分析
将382个已注释的差异表达基因与KEGG数据库进行比对,共有63个基因富集到35个KEGG通路中,其中,在光合作用-天线蛋白(photosynthesis-antenna protein,ko00196)和甘油磷脂代谢(glycerophospholipid metabolism,ko00564)通路上的富集基因显著高于其他通路(P<0.05)。进一步分析发现,富集在光合作用-天线蛋白通路上的差异表达基因均上调表达(表3),涉及穗发育的代谢途径主要有植物生理节律(ko04712)、淀粉与糖代谢(ko00500)、光合作用(Photosynthesis)和植物激素信号转导(ko04075)途径。
2.7 功能注释为转录因子的分类分析
对在nr数据库中得到功能注释的差异表达基因进行分析,发现功能注释为转录因子的差异表达基因有19个(表4)。6 个差异表达基因属于WRKY转录因子家族,它们在Y57中的表达量均显著小于96-2。属于Myb家族(4 个)、AP2/ERF家族(4 个)和C3H家族(2 个)的差异表达基因均下调。两个MADS-box 基因表达趋势相反,一个上调一个下调。这些家族转录因子调控植物多个生长发育过程,部分基因影响植物抽穗开花时间和花器官的形成。

不同的颜色表示每个基因表达水平的高低。
Different colours mean different gene expression levels.
图3近等基因系间差异表达基因的热点图
Fig.3Heatmapofthedifferentexpressiongenesofthetwonearisogeniclines
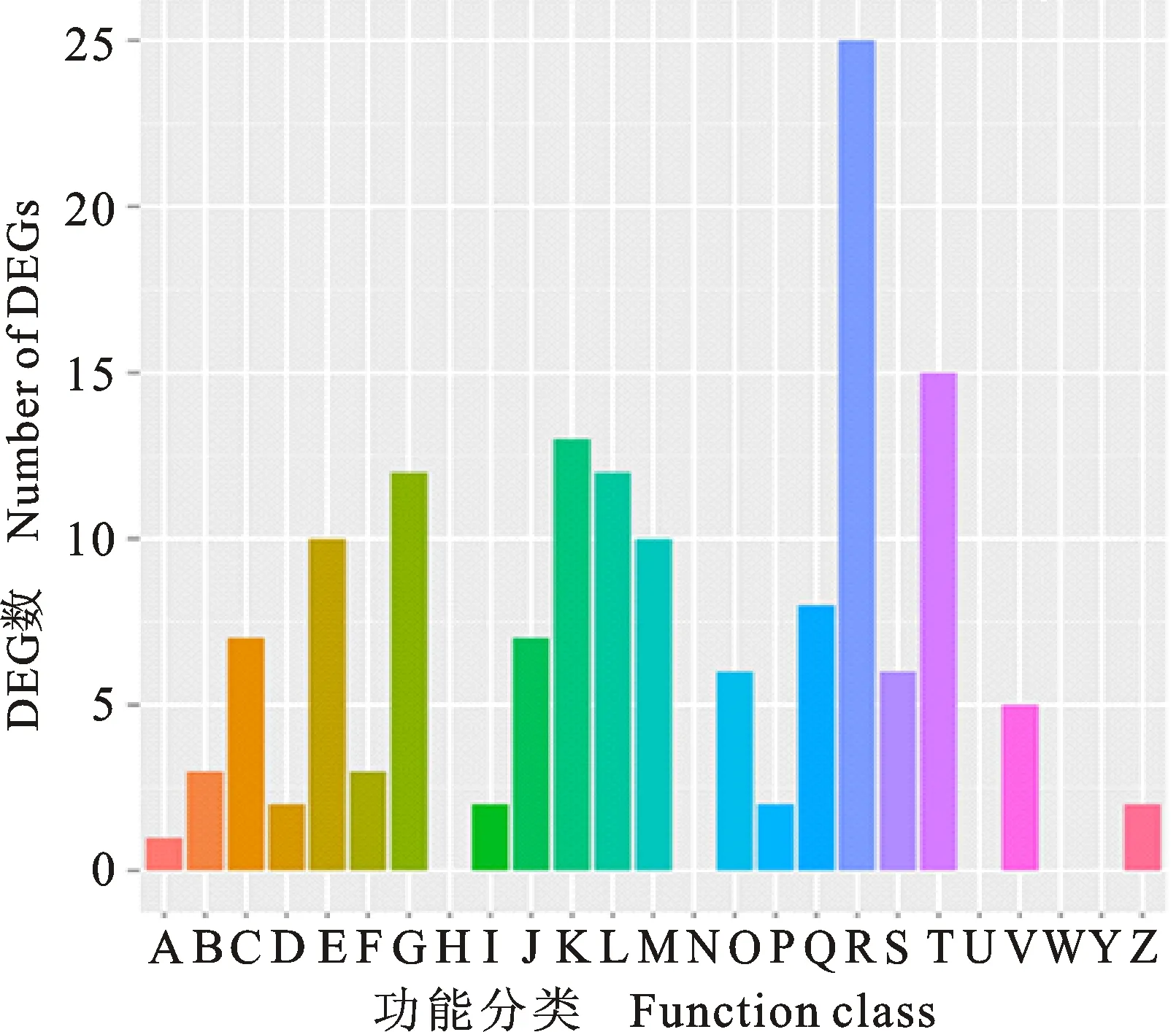
A:RNA加工与修饰; B:染色质结构与变化; C:能量产生与转化; D:细胞周期调控与分类,染色体重排; E:氨基酸运输与代谢; F:核苷酸转运输与代谢; G:碳水化合物运输与代谢; H:辅酶运输与代谢; I:脂质转运与代谢; J:翻译,核糖体结构与生物合成; K:转录; L:复制、重组与修复; M:细胞壁、膜生物发生; N:细胞运动; O:蛋白质翻译后修饰与转运,分子伴侣; P:无机离子转运与代谢; Q:次生代谢物合成、运输与代谢; R:一般功能; S:功能未知; T:信号转导; U:细胞内运输,分泌和囊泡运输; V:防御机制; W:细胞外基质结构; Y:核结构; Z:细胞骨架。
A:RNA processing and modification; B:Chromatin structure and dynamics; C:Energy production and conversion; D:Cell cycle control,cell division,chromosome partitioning; E:Amino acid transport and metabolism; F:Nucleotide transport and metabolism; G:Carbohydrate transport and metabolism; H:Coenzyme transport and metabolism; I:Lipid transport and metabolism; J:Translation,ribosomal structure and biogenesis; K:Transcription; L:Replication,recombination and repair; M:Cell wall/membrane/envelope biogenesis; N:Cell motility; O:Posttranslational modification,protein turnover,chaperones; P:Inorganic ion transport and metabolism; Q:Secondary metabolites biosynthesis,transport and catabolism; R:General function prediction only; S:Function unknown; T:Signal transduction mechanisms; U:Intracellular trafficking,secretion,and vesicular transport; V:Defense mechanisms; W:Extracellular structures; Y:Nuclear structure; Z:Cytoskeleton.
图4差异表达基因COG功能分类
Fig.4COGfunctionclassificationofdifferentiallyexpressedgenes

C1:细胞组分; C2:细胞; C3:细胞器; C4:膜; C5:细胞器部分; C6:细胞膜部分; C7:大分子复合物; C8:胞外区; C9:细胞连接; C10:膜封闭腔; C11:胞外区要素; C12:核仁; C13:细胞外基质; C14:细胞外基质部分; C15:病毒体; C16:病毒体组分; C17:胶原三聚体; M1:结合; M2:催化活性; M3:转运活性; M4:核酸结合转录因子活性; M5:电子载体活性; M6:结构分子活性; M7:分子转导活性; M8:受体活性; M9:酶调节活性; M10:抗氧化活性; M11:蛋白结合转录因子活性; M12:营养库活性; M13:鸟苷酸交换因子活性; M14:金属伴侣活性; M15:翻译调节活性; M16:蛋白标签; M17:通道调节活性; B1:细胞反应过程; B2:代谢过程; B3:单生物体过程; B4:刺激应答; B5:生物学调控; B6:组织或生物起源细胞组件; B7:发育过程; B8:定位; B9:多细胞生物体过程; B10:生殖生长过程; B11:多生物体过程; B12:信号; B13:生长; B14:免疫系统过程; B15:生殖; B16:节律过程; B17:生物附着; B18:生物阶段; B19:运动; B20:细胞致死。
C1:Cell part; C2:Cell; C3:Organelle; C4:Membrane; C5:Organelle part; C6:Membrane part; C7:Macromolecular complex; C8:Extracellular region; C9:Cell junction; C10:Membrane-enclosed lumen; C11:Extracellular region part; C12:Nucleoid; C13:Extracellular matrix; C14:Extracellular matrix part; C15:Virion; C16:Virion part; C17:Collagen trimer; M1:Binding; M2:Catalytic activity; M3:Transporter activity; M4:Nucleic acid binding transcription factor activity; M5:Electron carrier activity; M6:Structural molecule activity; M7:Molecular transducer activity; M8:Receptor activity; M9:Enzyme regulator activity; M10:Antioxidant activity; M11:Protein binding transcription factor activity; M11:Protein binding transcription factor activity; M12:Nutrient reservoir activity; M13:Guanyl-nucleotide exchange factor activity; M14:Metallochaperone activity; M15:Translation regulator activity; M16:Protein tag; M17:Channel regulator activity; B1:Cellular process; B2:Metabolic process; B3:Single-organism process; B4:Response to stimulus; B5:Biological regulation; B6:Cellular component organization or biogenesis; B7:Developmental process; B8:Localization; B9:Multicellular organismal process; B10:Reproductive process; B11:Multi-organism process; B12:Signaling; B13:Growth; B14:Immune system process; B15:Reproduction; B16:Rhythmic process; B17:Biological adhesion; B18:Biological phase; B19:Locomotion; B20:Cell killing.

表4 编码为转录因子的差异表达基因Table 4 Differentially expressed genes encoding transcription factors
2.8 qRT-PCR结果验证
从差异表达基因中挑选4个表达明显不同的基因进行验证,其中2个是表达趋势不同的基因(Traes_5DL_9CC4EC839和Traes_6DL_7892214C8),另外2个是表达量显著不同的基因(Traes_5DL_52EC7112A和Traes_3DS_92091AAD4)。利用实时荧光定量PCR分析这4个基因在2个材料中的相对表达水平,对转录组数据进行可靠性验证。结果发现,4个基因的转录组测序结果与荧光定量结果一致(图6);通过对三个不同发育时期的转录组测序基因表达水平和基因相对表达量的相关性分析可知,Traes_5DL_9CC4EC839和Traes_6DL_7892214C8基因在YM57和96-2中的相关系数分别为0.951,0.644,0.994和0.961; Traes_3DS_92091AAD4和Traes_5DL_52EC7112A.2基因在YM57和96-2中的相关系数分别为1、0.667、1和0.762,都达显著水平,表明转录组测序结果可靠。

A、C、E、G为转录组测序结果,B、D、F、H为RT-PCR结果; A和B是基因Traes_5DL_9CC4EC839的验证结果;C和D是基因Traes_6DL_7892214C8的验证结果;E和F是基因Traes_3DS_92091AAD4的验证结果;G和H是Traes_5DL_52EC7112A.2基因的验证结果;4L、5L、7L分别代表四叶期、五叶期、七叶期。
A,C,E,G are the result of transcriptome sequencing;B,D,F,H are the result of qRT-PCR; A and B are the result of the gene Traes_5DL_9CC4EC839;C and D are the result of the gene Traes_6DL_7892214C8; E and F are the result of the gene Traes_3DS_92091AAD4;G and H are the result of the gene Traes_5DL_52EC7112A.2; 4L,5L,7L are the 4th leaf age,the 5th leaf age,the 7th leaf age,respetively.
图6转录组测序结果与RT-PCR结果比较
Fig.6ComparisonofRNA-seqversusqRT-PCRdataforselectedgenes
3 讨 论
生产上普遍种植的小麦是异源六倍体,含有A、B、D三个基因组,基因组大约17 G。普通小麦的形成涉及3个原始祖先物种和两次天然杂交,乌拉尔图、拟斯卑尔托山羊草和粗山羊草分别是小麦A、B、D基因组的供体[23]。虽然目前A和D基因组测序和草图绘制已经完成[24-25],与水稻、玉米等作物相比,小麦分子基础研究还很薄弱,遗传背景了解还比较少。近几年来基于Illumina 测序平台的RNA-seq技术已成为快速而全面地建立植物分子基础平台的有力工具[26-27]。
小麦穗发育是一个受多基因和环境调控的复杂过程,二棱期是与小麦抽穗期关系最密切的时期。本研究利用RNA-seq测序技术获得Y57和96-2比对到参考基因组(中国春)上的reads数分别为38 021 371和42 375 610,但是2个材料在二棱期仅筛选出395个差异表达基因,其中上调基因138个,下调基因257个。这也说明了Y57和96-2遗传背景高度一致,减少了遗传背景对差异表达基因筛选的影响。而Feng等[16]利用普通小麦中国春进行了小麦花不同发育时期的转录组分析,其中找到在二棱期特异表达的基因464个,这些基因主要富集在核酸绑定(nucleic acid binding)、转录调控活性(transcription regulator activity)、转录因子活性(transcription factor activity)及DNA绑定等功能。将本研究找到的这些差异基因在Nr数据库进行注释,其中382个基因获得了功能注释;有298个基因获得GO功能注释,这些差异表达基因的功能也主要集中在结合(binding)、催化活性(catalytic activity)和核酸结合转录因子活性(nucleic acid binding transcription factor activity)等方面,与Feng等[16]研究结果类似。Wang等[17]利用90个冬小麦品种在二棱期早期及小穗原基形成期进行了转录组分析,并将获得的差异表达基因与穗部相关性状进行了相关性分析,发现小穗数与基因表达水平呈显著相关,其次是小花数和穗粒数; 由此可知,二棱期是小麦穗部发育形成的关键时期。对本研究获得的差异基因进行COG功能注释,有103个基因获得COG功能注释,只有63个基因被注释到KEGG代谢通路中。注释基因信息之所以缺失,一方面可能是因为小麦基因组测序还没有完成,无法对整个基因组进行功能注释; 另一方面,目前对小麦转录组学研究还处于初级阶段,现在的研究主要集中在小麦抗逆性方面[14,28],基因功能注释信息不够丰富,生物信息数据库还不够完善,部分序列或基因无法获得相应的功能注释信息。
本研究发现,Traes_5DL_52EC7112A和Traes_3DS_92091AAD4为丝氨酸/苏氨酸蛋白磷酸酶2A同源基因,且它们在Y57中几乎不表达而在96-2中表达量较高。Janssens等[29]和Yu等[30]都表明丝氨酸/苏氨酸蛋白磷酸酶2A(PP2A)在信号转导和细胞生长、分化方面起重要的调控作用,能够促进植物生长发育。拟南芥的PP2A显著影响生长素转运[31]。由此推测,这两个基因可能与小麦幼穗分化有关,对小麦抽穗期有正调控作用。
本研究中,差异表达基因中有多个WRKY、MADS-box、Myb-like和ERF/AP2转录因子。ERF/AP2和WRKY转录因子是许多植物生长发育过程,如应答生物和非生物胁迫、种子萌发、ABA信号转导等的主要调控因子。Kiseleva等[32]认为ERF/AP2和WRKY转录因子可能影响小麦抽穗期,在大豆[33]和芒草[34]中也发现了控制开花期的WRKY转录因子。已有大量研究证明MADS-box基因家族参与生长点的确定、春化过程、开花时间调控和果实成熟等多个重要发育过程[35-37]。在拟南芥中发现Myb-like家族转录因子是昼夜节律钟和花青素合成途径中的调控因子[38],昼夜节律钟可以通过调控下游基因的表达控制植物开花时间。Myb-like家族转录因子对小麦抽穗期的作用还需要进一步研究。
在生物体内,不同的基因产物相互协调行使生物学功能,对差异表达基因的通路注释分析有助于进一步解读基因的功能。本研究KEGG分析结果表明,差异表达基因显著富集在光合作用-天线蛋白和甘油磷脂代谢通路上。筛选到参与光合作用-天线蛋白通路中的Lhca2、Lhcb1、Lhcb2、 Lhcb3和Lhcb4差异表达基因均上调表达。它们是光系统Ⅰ和光系统Ⅱ的组成部分,参与光吸收和光信号转导。在光周期控制开花反应中,植物通过光受体感受外界的光信号并将光信号传递到昼夜节律钟系统控制植物的开花时间[39],推测这些基因可能通过光周期途径正调控小麦抽穗期。对甘油磷脂代谢通路对穗发育的影响还有待于进一步研究。本研究还对差异表达基因进行了GO和COG功能分类,差异表达基因主要涉及植物生长发育细胞部分、结合、细胞运输过程、代谢过程、信号转导机制和转录等,说明参与小麦幼穗分化前期差异表达基因主要集中于细胞内,DNA、RNA和蛋白质等代谢旺盛,为细胞分裂、生长和分化提供信息、能量和物质基础。

