小麦强弱势粒胚乳淀粉体和蛋白体发育及物质积累研究
汪巧菊,陈昕钰,冉莉萍,李 波,董召娣,余徐润,熊 飞
(1. 扬州大学生物科学与技术学院,江苏扬州 225000; 2. 扬州大学广陵学院,江苏扬州 225000)
胚乳是小麦颖果的重要组成部分,占粒重的85%以上,其主要的贮藏物质是淀粉和蛋白质。淀粉和蛋白质的种类及其组分的比例与小麦的加工品质密切相关[1-2]。近年来,有关小麦颖果胚乳发育的研究较多。王蔚华等[3]和封超年等[4]系统阐述了小麦胚乳细胞增殖的动态过程及其与粒重的关系。王 忠等[5]系统研究了小麦胚乳细胞及其淀粉粒、蛋白体的发育过程。荆彦平等[6]从细胞水平研究了内胚乳细胞的发育和淀粉体的生长规律。Chen等[7]对关于不同发育阶段小麦胚乳空间结构内的蛋白体发育规律的研究表明,小麦胚乳不同区域内蛋白体的积累和分布存在显著差异。Yu等[8]还对不同发育天数的软、硬质小麦胚乳淀粉粒发育和淀粉组分和理化性质进行了深入研究。
颖果发育与穗位密切相关。一般将穗上生长发育早、充实好、粒重高的颖果称为强势粒;而穗上生长发育迟、充实差、粒重低的颖果则被称为弱势粒[9]。弱势粒的发育不良不仅严重限制了大穗型小麦高产潜力的发挥,还直接影响小麦品质。因此,弱势粒充实差、粒重低、品质差的原因分析和控制途径已成为农业技术人员的研究热点。国内外学者主要从组织形态学角度研究了谷类作物的强弱势粒胚乳发育的差异,研究作物以水稻为主。靳德明[10]通过光镜、透射电镜和扫描电镜观察,发现水稻强势籽粒胚乳细胞的发育是个连续的过程,而弱势籽粒胚乳细胞的发育是个不连续的过程。关于小麦,已有研究主要从不同小麦品种胚乳发育过程中蛋白体和淀粉体的发育差异或同一品种强弱势粒淀粉积累和酶活性等方面进行了研究[11-13],而有关小麦强弱势粒发育差异的研究尚不多见,尤其从细胞学角度对小麦强弱势粒胚乳淀粉体和蛋白体发育的研究还鲜见报道。因此,本研究以大穗型小麦品种宁麦13为材料,观察其颖果发育过程中的外观形态变化以及胚乳储藏物质的积累过程,旨在揭示小麦强、弱势粒发育差异的机理,为提高小麦产量、改善小麦品质提供理论依据。
1 材料与方法
1.1 试验材料
试验于2016年9月至2017年5月在江苏省扬州大学农学院试验田进行。小麦品种为宁麦13,由国家小麦改良中心提供。在小麦开花期采用记号笔点开颖花与植株上挂牌相结合的方法来标记颖花的开花日期,在小麦生长期进行常规化管理。
1.2 小麦强弱势粒划分
颖果强弱势粒的划分参照Wang等[14]的方法。强势粒为麦穗中部的4~12小穗的第1、2穗位籽粒,而弱势粒位于麦穗上部和下部(若小穗有4个籽粒,取第3、4位籽粒;若小穗有3个籽粒,取第3位籽粒;若有2个或1个籽粒则视为弱势粒)。
1.3 颖果形态观察
采集花后3、5、7、9、11、14、17、20、24和28 d的小麦颖果,每时期均随机选取有代表性的颖果在体视显微镜下观察颖果外部形态的发育过程。
1.4 颖果淀粉、蛋白质及其组分含量的测定
取成熟的小麦颖果,参照Zhu等[15]的方法测定颖果的总淀粉、支链淀粉和直链淀粉含量,参照郑先哲[16]的方法测定颖果的蛋白质及其组分含量。每个样品随机统计3个颖果作为重复,各颖果均取自不同的麦穗。
1.5 强弱势粒显微结构的观察和淀粉粒度分布统计
采集花后8、10、12、15和20 d的小麦颖果,参照Xiong等[17]的方法观察其显微结构,每个样品随机统计3个颖果作为重复,各颖果均统计6张显微照片。参照Yu等[18]的方法统计淀粉粒径分布。
1.6 胚乳细胞中淀粉体和蛋白体相对面积的统计
参照Xiong等[19]的方法统计胚乳细胞中淀粉体和蛋白体的相对面积。
1.7 数据处理
采用Microsoft Excel 2007和SPSS 19.0软件分析处理数据,采用LSD法进行显著性分析。
2 结果与分析
2.1 小麦强弱势粒的形态变化
从图1可以看出,花后3~17 d,小麦强弱势粒的形态变化明显,增长较快,随后缓慢增长。弱势粒的形态大小始终小于强势粒,且花后3~11 d时表现尤为明显。颖果颜色呈现出由白色变为绿色再变为黄棕色的变化趋势,且强势粒的绿色时间持续较长。
2.2 小麦强弱势粒胚乳发育的差异
由图2可知,花后8 d,弱势粒的背部和腹部均未出现蛋白体,而强势粒的背部和腹部有较小的蛋白体,且强势粒的平均淀粉体数(图2-C和图2-D)较弱势粒(图2-A和图2-B)多2.8个,强势粒淀粉体的相对面积较弱势粒大0.022(图3)。花后10 d,强势粒背部的淀粉体数多于弱势粒(图2-E和图2-G),但腹部无明显差异(图2-F和2-H),强势粒的淀粉体相对面积较弱势粒大0.018,其淀粉体数较弱势粒多1.3个(图3-A和图4);强弱势粒腹部的蛋白体积累量高于背部(图2-E和图2-G),且强势粒的蛋白体相对面积较弱势粒大0.006(图3-B)。花后12 d,强弱势粒腹部的蛋白体和淀粉体数(图2-J和图2-L)均多于背部(图2-I和图2-K),其中强势粒的蛋白体和淀粉体的相对面积分别较弱势粒大0.004和0.057,其淀粉体数较弱势粒多1.4个(图3和图4)。花后15 d,弱势粒腹部出现小淀粉体,而背部无变化(图2-M和图2-N),强势粒的背部和腹部均出现小淀粉体(图2-O和图2-P),且其淀粉体和蛋白体的相对面积分别较弱势粒大0.057和0.004,淀粉体数则较弱势粒多9.5个(图3和图4)。花后20 d,弱势粒腹部的小淀粉体数少于背部(图2-Q和图2-R),而强势粒则表现为腹部多于背部(图2-S和图2-T),且强势粒的淀粉体数以及淀粉体、蛋白体的相对面积均高于或大于弱势粒(图3和图4)。此外,扫描电镜结果(图5)显示,强势粒的胚乳质地较致密,胚乳淀粉体和蛋白体的充实度饱满,而弱势粒的胚乳质地较疏松,胚乳内蛋白体和淀粉体结合不紧密。综上所述,强弱势粒胚乳蛋白体和淀粉体的积累量在小麦不同部位的发育程度均存在显著差异,整体表现为强势粒的胚乳结构更紧致、充实度更高。
图下方的数字为颖果发育天数。
Numbers atthe bottom of the picture represent days of caryopsis development.
图1小麦强弱势粒颖果形态发育过程
Fig.1Morphologicaldevelopmentofsuperiorandinferiorgrainsinwheat

A、E、I、M、Q:花后8、10、12、15、20 d的小麦弱势粒胚乳背部;B、F、J、N、R:花后8、10、12、15、20 d的小麦弱势粒胚乳腹部;C、G、K、O、S:花后8、10、12、15、20 d的小麦强势粒胚乳背部;D、H、L、P、T:花后8、10、12、15、20 d的小麦强势粒胚乳腹部;Nu:细胞核;SG:淀粉粒;PB:蛋白体;标尺:10 μm。
A,E,I,M,Q:The endosperm back of inferior grains in wheat at 8,10,12,15,and 20 days after anthesis;B,F,J,N,R:The endosperm belly of inferior grains in wheat at 8,10,12,15,and 20 days after anthesis;C,G,K,O,S:The endosperm back of superior grains in wheat at 8,10,12,15,and 20 days after anthesis;D,H,L,P,T: The endosperm belly of superior grains in wheat at 8,10,12,15,and 20 days after anthesis;Nu:Nucleus;SG:Starch granules;PB:Protein; Scale bar:10 μm.
图2强弱势粒胚乳细胞发育过程
Fig.2Endospermcelldevelopmentprocessofsuperiorandinferiorgrains
2.3 小麦强弱势粒粒径分布的差异
以10 μm为界限划分小麦胚乳中A、B型淀粉粒的粒径,粒径<10 μm为B型淀粉粒,粒径>10 μm为A型淀粉粒。由图6可知,强势粒(图6-A和图6-C)的B型淀粉粒数多于弱势粒(图6-B和图6-D);强势粒和弱势粒的淀粉粒径分布均呈单峰型(图6-C和图6-D),强势粒中0~2 μm的淀粉粒数显著高于弱势粒,在其他粒径范围内两者的差异不明显。

图3 强弱势粒胚乳细胞中淀粉体(A)和蛋白体(B)相对面积的差异
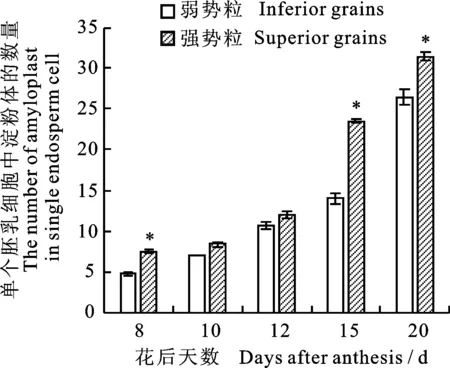
图4 强弱势粒胚乳细胞中淀粉体数目的差异
2.4 小麦强弱势粒蛋白质和淀粉含量的差异
蛋白质和淀粉的积累量直接决定小麦产量,而两者组分的含量及其比例又直接影响小麦的品质和加工用途。由表1可知,强势粒的蛋白质、醇溶蛋白、麦谷蛋白、淀粉及支链淀粉的含量均显著高于弱势粒,但弱势粒的直链淀粉含量显著高于强势粒。

图5 小麦强弱势粒胚乳细胞超微结构的差异

A:强势粒淀粉粒光学显微镜图;B:弱势粒淀粉粒光学显微镜图;C:强势粒淀粉粒度分布;D:弱势粒淀粉粒度分布。
A:Optical microscope images of starch granulesin superior grains;B:Optical microscope images of starch granulesin inferior grains;C:Starch size distribution in superior grains;D:Starch size distribution in inferior grains.
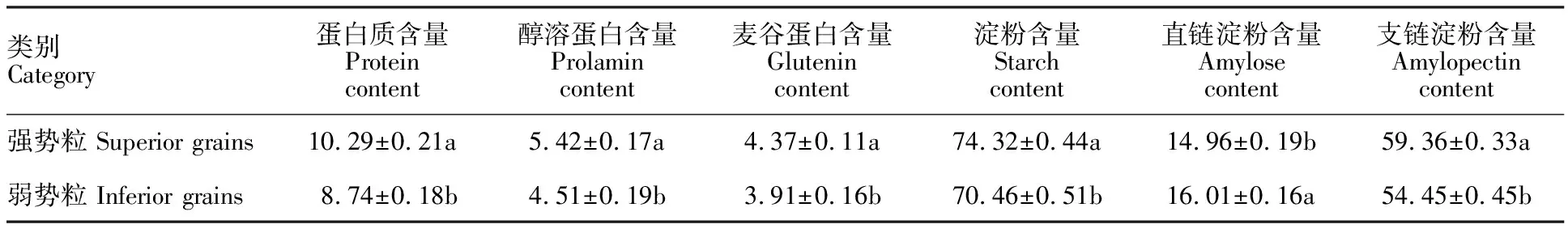
图6 小麦强弱势粒淀粉粒形态观察及其粒度分布
表中数据为“平均值±标准差”。同列数据后小写字母不同表示数据间差异显著(P<0.05)。
The data in the table are “mean±standard deviation”.Different lower-case letters following data within same column indicate significant differences at 0.05 level.
3 讨 论
小麦颖果发育前期以果皮发育为主,后期随着果皮逐步降解变薄胚乳开始发育,主要表现为胚乳细胞的增殖和生长。郭艳艳等[20]和顾蕴洁等[21]研究发现,小麦胚乳细胞从花后6 d急剧增加,花后20~23 d胚乳细胞数目基本稳定,这与本研究观察到的强弱势粒颖果的形态特征基本一致。这可能是因为胚乳细胞的增殖和生长对颖果体积的变化有一定的时间效应[22],前期胚乳细胞的增殖和生长是颖果体积变化的重要因素,而后期胚乳细胞的生长体积已经逐渐饱和,表现为细胞内储藏物质的积累,故体积变化相对不明显。而强弱势粒颖果的形态差异也可能与其胚乳细胞增殖的多少以及单个细胞的形态大小有关[13,23-24]。
本研究表明,小麦不同部位的强弱势粒的蛋白体和淀粉体的积累均存在明显差异,这可能与营养物质的运输有关。Chen等[7]认为小麦胚乳营养运输是通过“筛管-维管束-珠心”途径运输,然后珠心突起传递细胞再经胚乳传递细胞装载至胚乳细胞,那么从胚乳腔运输至背部的距离就长于腹部,而运输的养分也可能先沉积在远离胚乳腔的位置而后再沉积在距胚乳腔较近的位置,这可能是强弱势粒中不同位置的蛋白体和淀粉体的积累存在明显差异的原因。而Yu等[8]研究发现珠心突起传递细胞和胚乳传递细胞分别在花后6 d和9 d开始分化,因此强、弱势粒间淀粉体和蛋白体的积累差异可能与两者的分化时间有关。另外,强势粒中的小淀粉粒较多,这可能与胚乳发育过程中小淀粉体的出现时间以及强弱势粒的灌浆时间有关。
本研究显示,强势粒的总淀粉含量高于弱势粒,而其直链淀粉含量低于弱势粒,这与Wang等[14]的研究结果一致。蛋白质及其组分的含量是影响小麦面粉加工品质的主要因素[26],其中醇溶蛋白和谷蛋白为储藏蛋白,且在发育阶段占颖果质量的8%~10%[27]。谷蛋白是影响面团强度(弹性)的主要因素,而醇溶蛋白关系则与面团的黏度和延展性有关[28]。一般情况下,小麦的蛋白含量与其面粉加工品质呈正相关,蛋白含量越高,面粉加工品质也较高。本研究中,强、弱势粒的谷蛋白和醇溶蛋白含量存在差异,这可能与蛋白中高分子量谷蛋白亚基和低分子量谷蛋白亚基含量不同有关[29]。

