粪肠球菌胶原黏附素ace基因对生物被膜形成的影响
强 华, 宋立罡, 林任玺, 刘光英
肠球菌是常见的条件致病菌,许多医院感染均与之密切相关。在肠球菌引起的感染中,许多部位如前列腺小管、口腔感染根管、心内膜炎瓣膜、细支气管等均可观察到肠球菌生物被膜的存在[1-2],表明细菌生物被膜的形成在肠球菌感染中起作用。对肠球菌生物被膜形成基因的探讨成为肠球菌致病机制的研究方向之一。已有研究表明,肠球菌esp、明胶酶gelE、分选酶srt、fsr调节因子和ebpR等基因有利于粪肠球菌生物膜形成[3-7]。在临床心内膜炎感染患者血清中胶原结合蛋白ACE抗体检测率较高[8],ACE是粪肠球菌的表面黏附蛋白,是肠球菌的毒力因子之一。本研究通过微量滴定板法以及激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察比较粪肠球菌ace+、ace-菌株生物膜形成力的差别,探讨粪肠球菌ace基因影响生物膜形成从而促进感染发生发展的致病机制。
1 材料与方法
1.1材料
1.1.1菌株及质粒 粪肠球菌野生株U8-ace-,分离自临床泌尿道感染标本,PCR筛选鉴定ace基因阴性,药敏实验壮观霉素敏感;粪肠球菌空质粒对照株EU8-ace-、粪肠球菌转化株ZU8-ace+由本实验室构建保存;pTEX5646质粒含整段ace基因、携壮观霉素抗性基因以及pAT 392穿梭质粒由美国德克萨斯大学Barbara E. Murray教授馈赠。
1.1.2试剂 质粒提取纯化试剂盒(日本Takara生物工程公司);MH 肉汤(美国 Difco 公司);吖啶橙、溴化乙锭(美国Sigma公司)。35 mm培养皿、96孔微量滴定板(美国Corning Incorporated公司)。
1.1.3仪器 酶标仪(iMark680,美国BioRad公司);共聚焦激光扫描显微镜(LSM780,德国Zeiss公司)。
1.2方法
1.2.1粪肠球菌ace基因转化株构建 通过 PCR 及药敏实验筛选ace阴性、壮观霉素敏感的粪肠球菌原始株U8-ace-,采用简便法制备粪肠球菌U8-ace-感受态细胞,通过电击转化方法,将pAT 392空质粒以及pTEX5646质粒(含整段ace基因,携壮观霉素抗性基因以及pAT 392穿梭质粒)分别转入粪肠球菌U8-ace-感受态中,电击混合液在含壮观霉素的选择培养基上培养,挑选菌落进行PCR、测序等鉴定,获得空质粒对照株EU8-ace-,转化株ZU8-ace+。
1.2.2粪肠球菌ace基因阳性、阴性菌株不同温度下早期黏附能力比较 各取野生株U8-ace-,空质粒对照株EU8-ace-,转化株ZU8-ace+菌液(1×107CFU/mL),接种到96孔微量滴定板,每菌株24孔,每孔100 μL,分别于37 ℃和46 ℃下孵化6 h,吸去菌液,PBS 轻柔冲洗3次,洗去浮游细菌,0.1%番红染色30 min,倒置、干燥,用酶标仪测定孔板底部OD595值。
1.2.3微量滴定板法比较粪肠球菌ace基因阳性、阴性菌株生物被膜形成能力[9-10]将U8-ace-,EU8-ace-,ZU8-ace+菌液(1×107CFU/mL)加入96孔细胞培养板中,每孔200 μL,46 ℃培养3,6,12,24,36及48 h,各点培养5孔,设1孔PBS空白对照。吸去培养液,PBS缓冲液洗去浮游细菌,甲醛固定,结晶紫染色15 min,PBS缓冲液冲洗,80∶20乙醇-丙酮溶解结晶紫,测定各孔OD570值,每孔测3次。生物被膜形成力评价标准[6]:未形成生物膜:OD570≤0.5;生物膜形成力弱:0.5
1.2.4CLSM观测比较粪肠球菌ace基因阳性、阴性菌株生物被膜 将20 mm×20 mm灭菌玻片放入35 mm细胞培养皿内,将U8-ace-,EU8-ace-,ZU8-ace+菌液1 mL(菌密度5×106CFU/mL)分别滴至玻片表面,静置1 min,加入BHI培养液1.5 mL,封口膜封闭,46 ℃分别培养6,12,18,24,48及72 h,各点培养5个标本。弃培养液,PBS冲洗浮游菌,在盖玻片表面滴加100 μL AO/EB染液,于暗室孵育15 min,灭菌PBS冲洗2次后用吸水纸吸干水分,用透明指甲油密封。置于CLSM下观察并收集图像。CLSM观察条件:氩激光514/488 nm,物镜×20。生物膜标本由内(生物膜与玻片相贴的一面)向外(生物膜游离的一面)沿Z轴逐层扫描,得到生物膜的断层扫描图象。取最外一层和玻片之间的距离测量生物膜厚度。生物膜的细菌密度和活菌比例计算选用断层扫描图象中间一层的数据进行分析。CLSM断层扫描图象中的荧光量表示生物膜内细菌密度。生物膜活菌比例=绿荧光量/(绿荧光量+红荧光量)[10]。

2 结 果
2.1粪肠球菌ace基因阳性、阴性菌株不同温度下早期黏附能力比较 分别取野生株U8-ace-,空质粒对照株EU8-ace-,转化株ZU8-ace+菌液于37 ℃和46 ℃培养后,测定初步黏附能力OD595[11],单因素方差分析。结果表明,野生株U8-ace-、空质粒对照株EU8-ace-37 ℃培养与46 ℃培养的早期黏附OD595值比较,差别无统计学意义(P>0.05);转化株ZU8-ace+于37 ℃与46 ℃培养的早期黏附OD595值比较,差别有统计学意义(P<0.01)。实验表明,46 ℃体外条件下培养,ace转化变异株或表达ACE蛋白,更有利粪肠球菌的早期黏附(表1)。
表137 ℃,46 ℃下野生株U8-ace-与转化变异株ZU8-ace+早期黏附OD595值比较
Tab 1The initial adhesionOD595values of wild strains and transformants at 37 ℃,46 ℃

菌 株OD59537℃46℃U8-ace-0.0353±0.01650.0348±0.0271EU8-ace-0.0332±0.01720.0341±0.0191ZU8-ace+0.0368±0.01380.0957±0.0262△
与37 ℃OD595值比较,△:P<0.01.
2.2粪肠球菌ace基因阳性、阴性菌株生物被膜形成能力比较 微量滴定板法比较肠球菌野生株U8-ace-、空质粒对照株EU8-ace-、转化株ZU8-ace+生物被膜形成能力,各菌株的生物被膜形成能力随培养时间延长而提高,粪肠球菌转化株ZU8-ace+在各时段的生物膜形成能力均比野生株U8-ace-、空质粒对照株EU8-ace-的强。经单因素方差分析,ZU8-ace+与U8-ace-比较,差别有统计学意义(P<0.01);EU8-ace-与U8-ace-比较,差别无统计学意义(P>0.05,图1)。
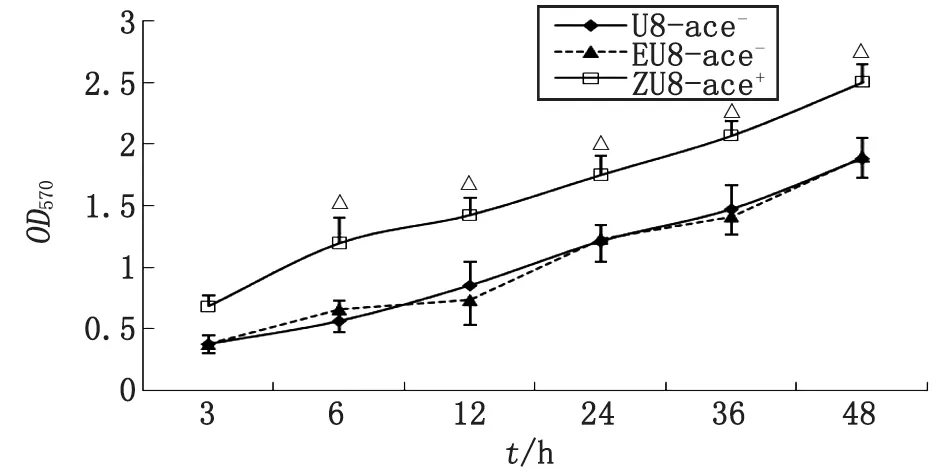
ZU8-ace+与U8-ace-比较,△:P<0.01.图1 ace+,ace-粪肠球菌体外生物膜形成能力Fig 1 The biofilm formation ability of ace+,ace- E.faecalis in vital
2.3CLSM观测比较粪肠球菌ace基因阳性、阴性菌株生物被膜情况
2.3.1ace+,ace-粪肠球菌生物被膜平均厚度比较 在生物被膜形成各阶段,粪肠球菌转化株ZU8-ace+所形成生物膜的平均厚度均高于野生株U8-ace-,经单因素方差分析,ZU8-ace+与U8-ace-比较,差别有统计学意义(P<0.01);EU8-ace-与U8-ace-比较,差别无统计学意义(P>0.05,图2)。
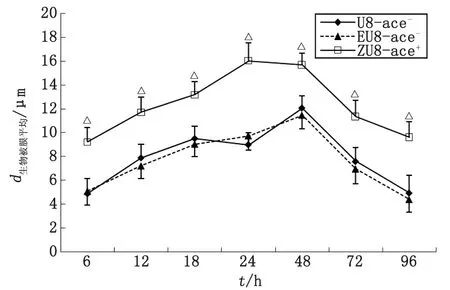
ZU8-ace+与U8-ace-比较,△:P<0.01.图2 ace+,ace-粪肠球菌生物被膜在各阶段的平均厚度Fig 2 The average thickness of ace+,ace-E.faecalis biofilm at different stages
2.3.2ace+,ace-粪肠球菌生物被膜中层内细菌密度比较 生物膜内层、中间层的细菌密度相对较大,而外层较低。取生物膜中层进行粪肠球菌转化株ZU8-ace+与野生株U8-ace-生物被膜密度比较,结果表明,粪肠球菌转化株ZU8-ace+所形成的生物被膜密度比野生株U8-ace-的高,经单因素方差分析,ZU8-ace+与U8-ace-比较,差别有统计学意义(P<0.01);EU8-ace-与U8-ace-比较,差别无统计学意义(P>0.05,图3)。

ZU8-ace+与U8-ace-比较,△:P<0.01.图3 ace+,ace-粪肠球菌生物被膜中层细菌密度Fig 3 The bacterial density of ace+,ace- E.faecalis biofilm at intermediate layer
2.3.3ace+,ace-粪肠球菌生物被膜内活菌比例比较 取生物膜中层比较粪肠球菌转化株ZU8-ace+与野生株U8-ace-生物被膜的活菌比例,结果表明,粪肠球菌转化株ZU8-ace+生物被膜活菌比例高于野生株U8-ace-,经单因素方差分析,ZU8-ace+与U8-ace-比较,差别有统计学意义(P<0.01);EU8-ace-与U8-ace-比较,差别无统计学意义(P>0.05,图4)。
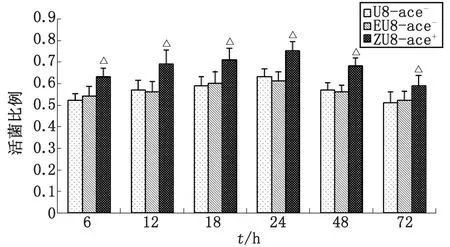
ZU8-ace+与U8-ace-比较,△:P<0.05.图4 ace+,ace-粪肠球菌生物被膜中层活菌比例Fig 4 The proportion of viable bacteria of ace+,ace- E.faecalis biofilm at intermediate layer
3 讨 论
肠球菌胶原结合蛋白是肠球菌表面黏附素,与金黄色葡萄球菌CAN胶原蛋白黏附素高度同源,为MSCRAMM家族成员,可以介导粪肠球菌黏附细胞外的基质蛋白,如层黏连蛋白、胶原蛋白Ⅱ及胶原蛋白Ⅳ等[12]。Singh等的研究表明,ACE抗体在肠球菌心内膜炎患者的血清中检出率高,ACE蛋白在体内感染表达较普遍,但体外粪肠球菌ACE蛋白表达的温度与体内有差别。体外条件下,绝大多数粪肠球菌于46 ℃培养有利于表达ACE蛋白[11,13]。本研究表明,野生株及空质粒对照株在37 ℃培养的早期黏附值与46 ℃培养的比较,差别无统计学意义(P>0.05),而ace+转化株于46 ℃培养的早期黏附值比37 ℃培养的大(P<0.01),说明46 ℃体外条件下,ace转化变异株表达了ACE蛋白,有利于粪肠球菌早期黏附,也支持这一结论。
细菌黏附是细菌感染宿主的第一步,在肠球菌毒力因子研究中,对黏附素的研究近年来较为广泛。同时,细菌生物被膜在感染致病中的意义也越来越受重视。肠球菌生物被膜的形成在呼吸道感染、泌尿道感染尤其是留置管相关泌尿道感染、感染性心内膜炎等医院感染中都具有重要意义。强华等报道粪肠球菌心内膜炎抗原EfaA有利于细菌生物被膜形成[5],其他黏附素如肠球菌胶原结合蛋白ACE是否有利于细菌生物被膜的形成未见报道。本研究结果表明,在CLSM观察下,ace+粪肠球菌在不同培养时间点所形成的生物膜厚度、生物膜细菌密度以及生物膜活菌比例均高于ace-菌;微量滴定板法测定生物膜形成能力,各培养时间点ace+转化株的OD570值均大于ace-野生株,而ace-空质粒转化对照株与ace-野生株比较,差别无统计学意义,提示粪肠球菌胶原黏附素ace基因有利于肠球菌体外生物被膜的形成,可为体内动物模型生物被膜形成的研究提供相互验证。肠球菌胶原蛋白黏附素有促进细菌黏附细胞外基质蛋白的作用[14],该黏附素也有可能增强细菌间黏附能力从而促进生物被膜的形成。研究认为,肠球菌ace基因在大鼠心内膜炎模型以及泌尿道感染模型中具有毒力作用[8,15]。本研究进一步探讨了粪肠球菌ace基因与生物被膜形成的相关毒力机制,为肠球菌生物被膜研究及肠球菌泌尿道、呼吸道感染等医院感染的防治提供新思路。

