电子烟烟液及其主要化学成分的体外细胞毒性评价
陈 欢,韩书磊,张 森,史智浩,侯宏卫,胡清源
国家烟草质量监督检验中心,郑州高新技术产业开发区枫杨街2号 450001
近年来,电子烟以“保健”“戒烟”“清肺”等为宣传口号,以网络为主要营销途径,在世界范围的销量呈快速增加趋势。大多数电子烟产品宣称其比传统卷烟的危害性更小[1]。然而,目前对电子烟的毒性评价研究较少。Bahl等[2]采用 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐法(MTT法)对电子烟烟液的细胞毒性进行评价,结果表明不同电子烟烟液的细胞毒性相差很大。Behar等[3]的进一步研究表明,电子烟产品中的肉桂添加剂成分与细胞毒性有关,会对电子烟消费者的健康产生影响。目前关于电子烟气溶胶中有害成分及细胞毒性评价研究也有报道[4-6]。电子烟与普通卷烟的主要差异在于电子烟是通过雾化器雾化电子烟烟液形成气溶胶,由于不需要经过传统卷烟的高温燃烧过程,不同化合物在烟液雾化为气溶胶过程中的变化主要体现在递送规律方面,因此大多数成分并不会发生化学性质方面的改变。可见,考察电子烟烟液的细胞毒性对于评价不同电子烟产品的生物学毒性具有重要意义。
常用的细胞毒性评价方法主要包括MTT法、中性红吸收法、CCK-8法、WST-1实验、乳酸脱氢酶(Lactate dehydrogenase,LDH)实验及溴脱氧尿嘧啶核苷(BrdU)掺入实验等。各种方法的检测原理不同,优缺点也不一样。MTT、CCK-8和WST-1实验主要以活细胞线粒体经脱氢酶转化后形成的甲瓒的量表征细胞活性,其中MTT生成的是不溶于水的蓝紫色甲瓒,需要用有机溶剂溶解后再进行测定;WST-1和CCK-8生成的是水溶性的黄色甲瓒,无需洗涤和有机溶剂溶解就可以直接测定,因而重复性和灵敏性比MTT法更高[7]。中性红实验以细胞溶酶体摄入中性红染料的能力表征细胞活性,虽然该方法的准确性和灵敏性也较高,但是中性红溶液需要现配现用,实验操作较为繁琐[8]。LDH实验通过检测细胞膜受损后释放到培养液中的乳酸脱氢酶的活性来表征细胞活性[8]。该方法操作简单、重复性好,对损伤细胞膜毒物的检测灵敏性和准确性较高。BrdU实验的原理是将一种胸腺嘧啶核苷类似物BrdU掺入细胞合成的DNA中,在细胞DNA合成期时,BrdU会与胸腺嘧啶产生竞争并掺入到新合成的DNA中,利用BrdU抗体对掺入到DNA的BrdU的特异性识别可以检测细胞活性[9]。该方法能敏感地评价会对DNA和DNA的合成造成损伤的物质[10]。
考虑到不同细胞活性评价方法的准确性和便捷性,本研究中分别采用LDH、BrdU、WST-1和CCK-8四种细胞毒性测定方法来评价电子烟烟液有关细胞膜损伤、细胞增殖和细胞活性等方面的细胞毒性,以筛选出检测灵敏及检测结果准确可靠的电子烟体外细胞毒性评价方法。同时,根据不同细胞系对测试化合物敏感程度的差异,分别采用中国仓鼠卵巢细胞(CHO细胞)和人肺癌细胞(A549细胞)进行相同电子烟烟液的细胞毒性评价对比,以筛选出适用于电子烟烟液细胞毒性评价的细胞株。本实验中选择16种电子烟烟液样品进行考察,通过气相色谱仪检测主要成分烟碱、1,2-丙二醇和丙三醇的含量,并分析主要化学成分与电子烟烟液细胞毒性的相关性,旨在准确评价电子烟烟液的细胞毒性及其主要成分对细胞毒性的影响,为电子烟烟液细胞毒性的研究提供参考。
1 材料与方法
1.1 材料、试剂和仪器
CHO和A549细胞(中国科学院上海生命科学院细胞库提供);16种电子烟烟液,均通过网络途径采购。
烟碱(AR,国家烟草质量监督检验中心提供);丙三醇、1,2-丙二醇(AR,美国Sigma公司);RPMI-1640培养基、0.25%胰蛋白酶及胎牛血清(美国Gibco公司);LDH试剂盒、BrdU试剂盒及WST-1试剂盒(瑞氏Roche公司);CCK-8试剂盒[东仁化学科技(上海)有限公司]。
MD Spectramax M5酶标仪(美国Molecular Device公司);456-GC气相色谱仪(配FID检测器,美国Bruker Daltonics公司)。
1.2 方法
1.2.1 细胞培养和染毒
CHO和A549细胞采用含有10%胎牛血清的RPMI-1640培养基培养,当细胞生长至汇合率为70%~80%时,采用0.25%的胰酶消化成单细胞悬液,在显微镜下计数后,向96孔细胞培养板(除最外周36孔)中加入100 μL 1×105个细胞/mL的单细胞悬液。细胞接种24 h后移除培养液,采用0.1 mol/L的磷酸盐缓冲液洗涤1次后加入染毒液。每个处理进行6个平行实验,细胞存活率表达均为平均值±标准偏差。
1.2.2 细胞毒性检测
(1)LDH法。细胞接种24 h后开始染毒,分别设置正常对照组(不染毒)、不同剂量的电子烟烟液染毒组和LDH最大释放组(不染毒,用于检测细胞可释放LDH酶的最大量),正常对照组和LDH最大释放组均每孔加入100 μL的细胞培养基,电子烟烟液染毒组每孔加入100 μL不同浓度的电子烟烟液染毒溶液,96孔板的最外周36个孔中选择其中6个孔作为培养基背景对照,再选择6个孔加入最高电子烟烟液染毒溶液作为染毒溶液背景对照。在染毒步骤结束前15 min,向LDH最大释放组中加入5 μL裂解液,继续孵育15 min。向96孔板每孔中加入100 μL新配制的LDH反应混合液,避光反应15 min后,每孔加入50 μL终止液,振荡10 s。使用酶标仪检测每孔在490 nm波长处的吸光值,参比波长为630 nm。
(2)BrdU掺入法。细胞接种24 h后开始染毒,分别设置正常对照组(不染毒),电子烟烟液染毒组和培养基背景对照组。空白对照组中每孔加入100 μL细胞培养基、电子烟烟液染毒组中每孔加入100 μL电子烟烟液染毒溶液。染毒结束前2 h,每孔加入10 μL的BrdU染料,继续孵育2 h,然后开始BrdU掺入量的检测。吸除溶剂后每孔加入200 μL的细胞固定和变性溶液,室温下孵育30 min。吸除培养孔中的溶液后,每孔加入100 μL过氧化物酶标记的抗BrdU抗体,室温下孵育90 min。用300 μL清洗液清洗细胞培养板3次,每孔加入100 μL酶反应底物,反应30 min,检测370 nm处的吸光度值。
(3)WST-1法。细胞接种24 h后开始染毒,分别设置正常对照组(不染毒、染毒组、阳性对照组(200 μg/mL SDS)和培养基背景对照组。染毒结束后,每孔加入10 μL WST-1试剂,继续于37℃、5%CO2条件下孵育2 h。振荡1 min后使用酶标仪检测每孔在450 nm波长处的吸光值,参比波长为630 nm。
(4)CCK-8法。细胞接种24 h后开始染毒,分别设置正常对照组(不染毒、染毒组、阳性对照组(200 μg/mL SDS)和培养基背景对照组。染毒结束后,每孔加入10 μL CCK-8试剂,继续于37℃、5%CO2条件下孵育2 h。振荡1 min后使用酶标仪检测每孔在450 nm波长处的吸光值,参比波长为630 nm。
1.2.3 气相色谱法检测电子烟烟液中的烟碱、1,2-丙二醇和丙三醇
样品前处理:称取约0.1 g电子烟烟液样品,精确至0.1 mg,置于50 mL锥形瓶内,再加入10 mL含有内标1,3-丁二醇和2-甲基喹啉的异丙醇溶液(1,3-丁二醇作为1,2-丙二醇和丙三醇内标,2-甲基喹啉作为烟碱内标),振荡20 min后取约1 mL进样分析。每个样品应平行测定两次。仪器分析条件为:
色谱柱:DB-ALC1(30 m×0.32 mm×1.80 µm);程序升温方式:初始温度100℃,保持1 min,以15℃/min速率升至220℃,保持6 min;总运行时间为15 min;载气:氦气;载气流速:1.8 mL/min;尾吹气:20 mL/min;空气:450 mL/min;氢气:40 mL/min;进样口温度:250℃;检测器温度:275℃;进样量:1 µL;分流比:50∶1。
1.2.4 数据处理
(1)LDH实验中细胞存活率的计算公式:

式中:A为实验组对应的吸光度值。下同。
(2)BrdU、WST-1和CCK-8实验中细胞存活率的计算公式:

(3)采用GraphPad Prism 5软件进行IC50值计算和图形绘制,采用SPSS 20.0进行单因素ANOVA方差分析、t检验、Tukey多重比较和Pearson相关分析。
2 结果与讨论
2.1 不同方法检测的电子烟烟液的细胞毒性
采用LDH、BrdU、WST-1和CCK-8实验对电子烟烟液的细胞毒性测定结果如图1和表1所示。可以看出,染毒3 h后,所有方法均能检测到电子烟烟液的细胞毒性,CCK-8法计算的IC50值最低(81.81 mg/mL),其次依次为WST-1、BrdU及LDH实验。另外,采用CCK-8实验计算的细胞毒性最低效应浓度(LEC)为20 mg/mL,远低于LDH(100 mg/mL)、WST-1(70 mg/mL)和BrdU(50 mg/mL)实验的LEC值,说明采用CCK-8实验评价电子烟烟液染毒3 h后的细胞毒性最为敏感。暴露24 h后,所有方法获得的电子烟烟液细胞毒性剂量-效应关系比3 h更明显。可见,采用CCK-8实验评价电子烟烟液染毒24 h后的细胞毒性最为敏感。综上可知,LDH、BrdU、WST-1和CCK-8实验4种方法均能用来检测电子烟烟液的细胞毒性且均能获得显著的细胞毒性-效应曲线,但是各种方法检测电子烟烟液细胞毒性的敏感性不同,其中CCK-8实验的敏感性最高,其次依次为WST-1、BrdU和LDH实验。
4种方法敏感性差异的主要原因可能是,除了与各方法的检测原理有关外,还与电子烟烟液本身的化学性质有关。电子烟烟液的主要成分为丙三醇和1,2-丙二醇,而这两种物质是细胞膜主要组分甘油三酯的重要组成成分,可能对保持细胞膜的完整性具有一定的积极作用,对于主要通过检测细胞膜破损释放乳酸脱氢酶活性的LDH实验来说,检测的敏感性相对较低。WST-1和CCK-8实验主要通过检测线粒体上的琥珀酸脱氢酶的活性来表征细胞毒性,由于线粒体是细胞内能量的生产中心,与细胞内各种生理活动均有着紧密的联系,因而无论细胞内的何种生理活动受到有毒物质的损害后,均会间接反映线粒体电子呼吸链上氧化还原酶的活性。BrdU通过细胞内DNA的合成来表征细胞的增殖和活性,因而细胞内DNA合成相关活性受到有害因素的抑制或者损伤后,BrdU实验能通过细胞内DNA的合成情况来准确反映细胞的增殖和生长活性。由于电子烟烟液主要的细胞毒性源于氧化应激[11],因而WST-1和CCK-8实验比BrdU实验评价电子烟烟液的细胞毒性更为敏感。WST-1和CCK-8的实验原理相似,但是两者琥珀酸脱氢酶反应底物的化学结构不同,CCK-8的底物是WST-1的升级产品,与琥珀酸脱氢酶产生的甲瓒更稳定且更易溶于水,因此CCK-8实验检测电子烟烟液细胞毒性的灵敏度更高。

图1 LDH、BrdU、WST-1和CCK-8实验测定的电子烟烟液细胞毒性Fig.1 Cytotoxicity of e-liquids tested by LDH,BrdU,WST-1 and CCK-8 methods
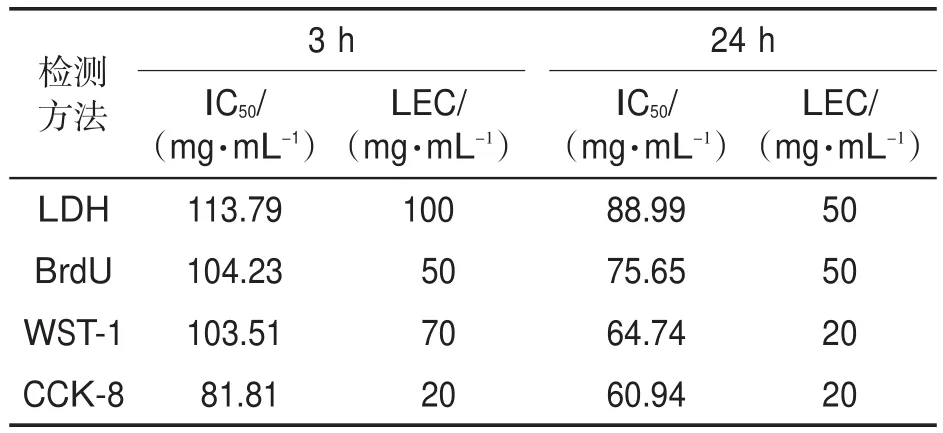
表1 不同方法评价电子烟烟液染毒3和24 h的IC50和LEC值Tab.1 Values of IC50and LEC tested by different methods after 3 and 24 h exposure to e-liquids
2.2 不同细胞系对电子烟烟液细胞毒性的敏感程度

图2 两个电子烟烟液样品对A549细胞和CHO细胞的细胞毒性Fig.2 Cytotoxicity of two e-liquids to A549 and CHO cell lines
CHO细胞和A549细胞易于培养,生长速度快,维护成本低,是烟草行业体外毒性评价常用的两种细胞系。本实验中以CCK-8实验为细胞毒性检测方法,对CHO细胞和A549细胞在评价电子烟烟液细胞毒性时的敏感程度进行了分析,以获得更适用于电子烟烟液细胞毒性评价的细胞系。由图2可知,随着电子烟烟液A和B的染毒剂量增加,细胞毒性逐渐增大,具有显著的剂量-效应关系。虽然t检验表明电子烟烟液样品A和B的浓度分别为70和20 mg/mL时,CHO细胞的存活率才显著低于A549细胞的存活率(P<0.000 1),但是Tukey多重比较结果表明,当电子烟烟液样品A和B的浓度为分别为40和20 mg/mL时CHO细胞的存活率就已经开始与空白对照组具有极显著差异(P<0.000 1),而A549细胞在电子烟烟液样品A和B的浓度为分别达到50和40 mg/mL时才开始与空白对照组具有极显著差异(P<0.000 1)。因此,CHO细胞比A549细胞对这两个电子烟烟液的细胞毒性更为敏感。
另外,比较这两个电子烟烟液对A549细胞和CHO细胞的IC50值发现,电子烟烟液A和B对CHO细胞的IC50值(54.85和46.13 mg/mL)均比A549细胞的IC50值(59.77和50.47 mg/mL)更低。因此,CHO细胞比A549细胞对电子烟烟液的毒性更加敏感,更适合于电子烟烟液细胞毒性的评价。由于CHO细胞为亚二倍体细胞,A549细胞为亚三倍体细胞,A549细胞对毒物引起的毒性反应修复和耐受性更强,因此其对电子烟烟液细胞毒性的敏感性比CHO细胞差。
2.3 电子烟烟液的细胞毒性及其细胞毒性与主要成分含量的相关性
选择CHO细胞为测试细胞系、CCK-8实验为检测方法,对市售的16种电子烟烟液的细胞毒性进行了普查分析。表2为16种电子烟烟液的IC50值。由表2可知,不同电子烟烟液的细胞毒性相差较大(最高相差5.47倍)。1,2-丙二醇和丙三醇是电子烟烟液的主要溶剂,含量分别为49.17%~77.55%和4.66%~46.94%,二者总量约占电子烟烟液的80%以上。电子烟烟液中烟碱含量为0~2.84%,检出率在87.5%以上,烟碱最高约占电子烟烟液的3%。其他成分的总量为1.96%~33.34%,大多数在10%以下。不同生产厂家的电子烟烟液中化学成分的种类和含量存在较大差异,检出的烟气关注有害成分[12]包括:羰基化合物(如甲醛、乙醛、丙烯醛、丙酮及甲基苯甲醛等)、多环芳烃(如蒽、菲、1-甲基菲及芘等)、烟草特有亚硝胺(如NNN、NNK、NAT及NAB等)、重金属(如镉、镍、铅、砷及铬等)、烟草生物碱(如可替宁、麦斯明、新烟草碱、假木贼碱、β-雪茄碱及去甲基烟碱等)以及挥发性有机物(如甲苯、间二甲苯及3-甲基丁基-3-甲基丁酸乙酯等)等。
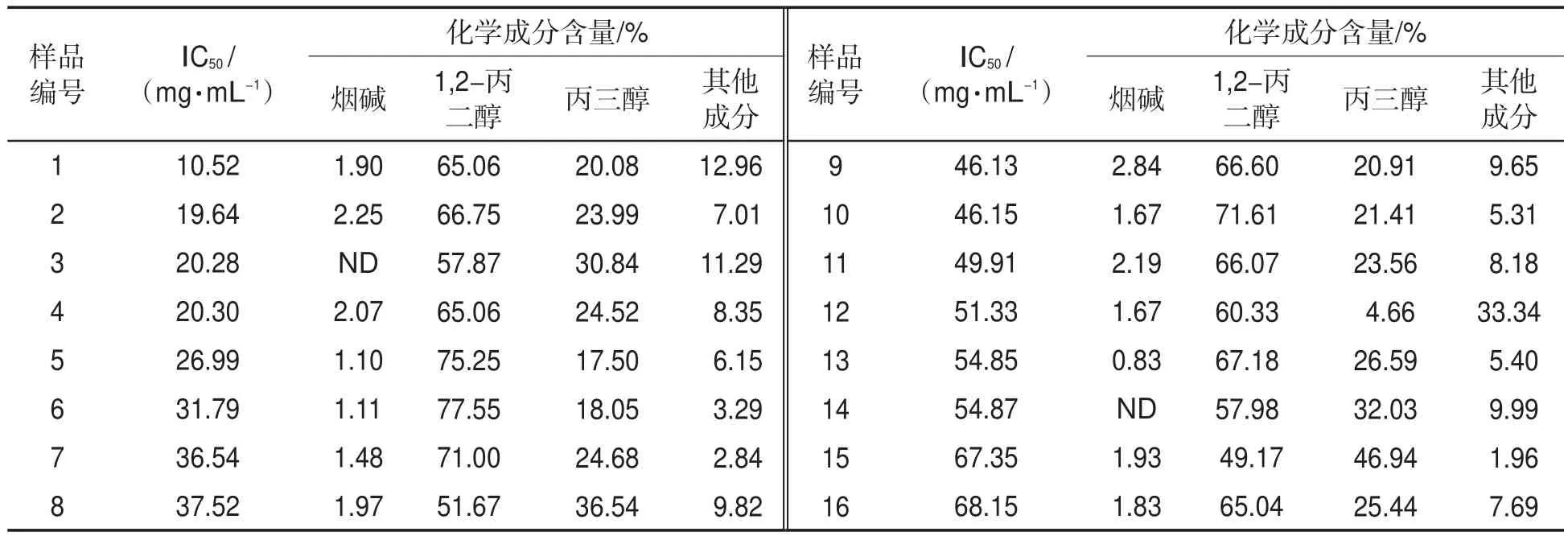
表2 16种电子烟烟液的细胞毒性IC50值及其主要化学成分含量①Tab.2 IC50values and contents of main components in 16 e-liquids
将16种电子烟烟液的IC50值与其主要成分烟碱、1,2-丙二醇、丙三醇的含量水平进行线性回归和Pearson相关分析,结果如图3所示。可以看出,烟碱、1,2-丙二醇、丙三醇及其他成分含量的总和与对应电子烟烟液的IC50值间线性回归相关系数R2值均小于0.1。另外,烟碱、1,2-丙二醇、丙三醇及其他成分总和的含量与对应电子烟烟液IC50值间的Pearson线性相关系数分别为0.026(P=0.924),-0.303(P=0.254),0.263(P=0.326)及-0.013(P=0.962),且均无显著相关性(P>0.05)。说明16种电子烟烟液中的烟碱、1,2-丙二醇和丙三醇与电子烟烟液的细胞毒性无显著线性相关性。

图3 16种电子烟烟液IC50值与烟碱(A)、1,2-丙二醇(B)、丙三醇(C)及其他成分(D)含量的一元线性回归分析结果Fig.3 One-dimensional linear regression analysis between IC50values of contents of nicotine(A),1,2-propylene glycol(B),glycerol(C)and other components(D)in 16 e-liquids
原因可能是:①所分析的样品数量较少,因而所得的线性关系不明显;②由于单个物质之间对细胞毒性可能存在交互作用,因此这些主要成分与电子烟烟液的细胞毒性可能存在非线性关系。为此,需进一步对更多样品中的成分和毒性进行检测,并在此基础上深入探索电子烟液中的这些主要成分是否与电子烟烟液存在非线性关系。
3 结论
通过对不同细胞毒性实验、不同测试细胞系等条件的筛选,确定了适用于电子烟烟液细胞毒性评价的方法,即以CHO细胞作为测试细胞系,采用CCK-8实验评价电子烟烟液的细胞毒性。对通过网络途径采购的16种电子烟烟液的细胞毒性进行了分析,考察了细胞毒性与电子烟烟液主要成分之间的相关性。尽管不同电子烟产品烟液的细胞毒性相差很大(最高相差5.47倍),但是本实验中所分析的16种电子烟烟液的细胞毒性的差异与其主要成分(烟碱、1,2-丙二醇和丙三醇)的含量并无显著的线性关联。

