胃癌组织中NEDD4L的表达及其临床意义
蒋兴旺,闫 强,张尚鑫,孙若川,李德关,鲁明典,张 震,李永翔
胃癌发病率在我国连年居高不下,是我国第二大常见肿瘤[1],要降低胃癌的总体死亡率,早期发现并及时治疗是非常重要的,而早期胃癌并无明显症状,多数患者就诊时已是中晚期。手术治疗是胃癌的首选治疗方式,但对于中晚期患者,手术预后不佳。泛素化是人体内的蛋白质修饰系统,能够介导膜蛋白、细胞周期调控因子、转录因子、癌蛋白和抑癌蛋白等底物蛋白的降解、稳定和重定位,该过程受到激活酶(E1s)、结合酶(E2s)及蛋白酶(E3s)的严密调控。泛素化在肿瘤发生发展的各方面都发挥着重要作用,该过程的紊乱可能会导致机体发生肿瘤或其他疾病[2]。
神经前体细胞表达发育下调样基因4(neural precursor cell-expressed developmentally down-regulated 4 like,NEDD4L)又称Nedd4-2,属于E3泛素连接酶Nedd4家族,NEDD4L可作用于上皮钠通道(ENaC),协助维持体内钠平衡、维持血压等[3]。已有研究[4-5]表明NEDD4L在多种肿瘤中发挥重要作用,但其在胃癌中的作用尚不明确。该研究通过检测胃癌组织、癌旁正常组织中NEDD4L的表达情况及其与胃癌患者的预后、分化程度、浸润深度和TNM分期等临床病理参数之间的关系,以分析其对临床判断胃癌预后的参考价值。
1 材料与方法
1.1病例资料胃癌组织标本中用于免疫组化的标本收集自2006年12月~2008 年9月医院普外科手术切除组织,术后病理明确诊断为胃癌,均具有完整的病理与相关随访资料。共包含124例胃癌组织与25例随机选取的癌旁正常组织(距肿瘤边缘>5 cm),将组织样本制作成组织芯片,进行免疫组化检测。其中男96例,女28例;年龄29~80岁,平均60.86岁,中位年龄60岁,≥61岁有63例,<61岁有61例;肿瘤直径≥6 cm有83例,<6 cm有41例;淋巴结转移阳性有83例,阴性有41例;肿瘤浸润深度较浅的(T1和T2)有26例,较深的(T3和T4)98例;根据第七版AJCC (the American Joint Committee on Cancer)TNM分期标准,Ⅰ~Ⅱ期52例,Ⅲ~Ⅳ期72例。另收集2016年8~10月于安徽医科大学第一附属医院普外科手术切除的25对新鲜胃癌及配对癌旁正常组织标本(距肿瘤边缘>5 cm),-80 ℃保存待用,所有患者均被告知并签署知情同意书,实验方案得到医院伦理委员会审核及批准。
1.2主要试剂和仪器TRIzol(上海翊圣生物科技公司);逆转录试剂盒、SYBR Green荧光定量PCR试剂盒(日本Toyobo公司);NEDD4L抗体(美国Proteintech Group公司);二抗(上海碧云天生物技术公司);Western blot 化学发光液(美国Millipore公司)。384孔PCR板;7900H型实时荧光定量PCR 仪(美国Applied Biosystems公司)。
1.3方法
1.3.1定量PCR 取适量胃癌和癌旁正常组织提取mRNA反转成cDNA,以此作为模板进行定量PCR反应,以β-actin作为内参,NEDD4L F:5′-TCC AATGGTCCTCAGCTGTTTA-3′,R: 5′-ATTTTCCACG GCCATGAGA-3′;β-actin F:5′-CTCCATCCTGGCCTC GCTGT-3′,R: 5′-GCTGTCACCTTCACCGTTCC-3′,反应条件设置如下:95 ℃变性10 min,然后95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸40 s,以上三步进行40个循环。所用仪器为美国 Applied Biosystems(ABI)公司7900H型实时荧光定量PCR仪,使用384孔定量板作为反应容器,每个样品重复3个复孔。目的基因的相对表达水平采用2-ΔΔCt法计算。
1.3.2Western blot 提取胃癌和癌旁正常组织中的总蛋白,然后经过上样、电泳(80 V电泳30 min后换110 V电泳约1 h 30 min)、转膜(0.3 A,1 h 30 min)、封闭(5%脱脂牛奶封闭液)、孵育(一抗稀释比1 ∶1 000,二抗稀释比1 ∶5 000)、显影(AB液按1 ∶1配制)后,采用image J软件分析目的条带与β-actin的灰度值之比表示目的蛋白的相对表达水平。
1.3.3免疫组化 石蜡标本切成4 μm厚的切片,然后经过脱蜡、抗原修复、孵育一抗、孵育二抗、显色、封片后,在显微镜下观察,采用免疫反应积分法(IRS)[即染色强度(SI)与阳性细胞百分率(PP)的乘积评分。阳性细胞评分按阳性细胞占总细胞数的百分比例评分,分为四级:≤25%(1分);26%~50%(2分);51%~75%(3分);>75%(4分)。染色强度评分,共四级,标准为:无色(-,0分);淡黄色(+,1分);棕黄色(++,2分);棕褐色(+++,3分)。为便于分析结果,按IRS分数将结果分为两组,分别为[IRS≤2,低表达(阴性)组]和[IRS>2,高表达(阳性)组]。
1.4统计学处理使用SPSS 17.0软件进行数据分析,采用t检验进行组间均数比较,NEDD4L表达与临床病理参数之间的分析采用Pearson χ2检验,生存曲线分析采用Kaplan-Meier法,并采用Log-Rank检验,采用Cox回归模型进行多因素分析,以P<0.05为差异有统计学意义。
2 结果
2.1NEDD4L在胃癌和癌旁正常组织中低表达定量PCR结果显示,在多数(72%,18/25)的胃癌组织中,NEDD4L mRNA水平均明显低于其对应的癌旁正常组织(P<0.05);蛋白质免疫印迹法结果显示NEDD4L在胃癌组织的平均灰度值(0.55±0.49)明显低于癌旁正常组织(1.27±0.51)(t=0.012 5,P<0.01),见图1;免疫组化结果显示NEDD4L蛋白主要定位于细胞质,见图2,且NEDD4L在胃癌组织标本中的阳性率为45.97%(57/124)明显低于癌旁正常组织标本的72%(18/25)(χ2=5.64,P<0.05)。
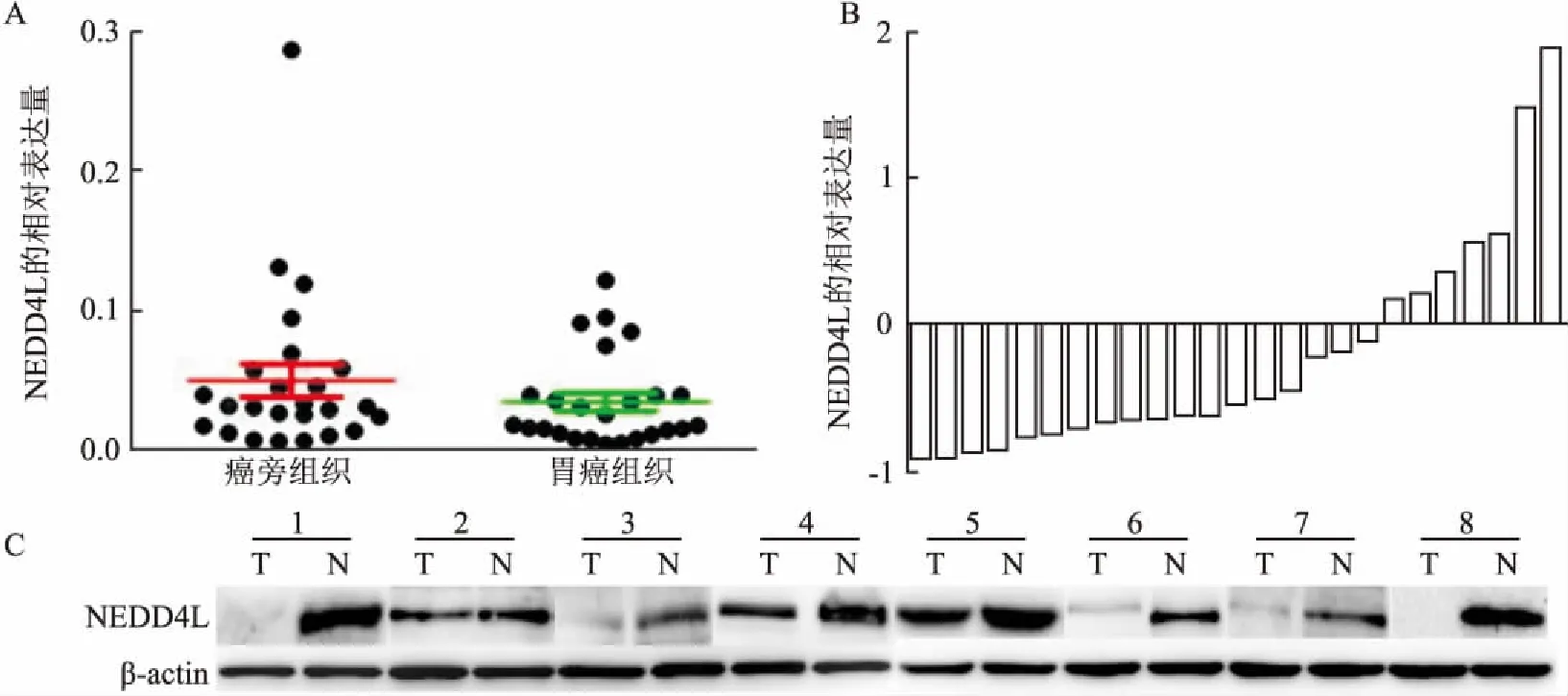
图1 NEDD4L在胃癌组织(T)和癌旁组织(N)中mRNA和蛋白表达A、B:NEDD4L在胃癌组织和癌旁组织中mRNA的相对表达量;C:NEDD4L在8对(1~8)胃癌组织(T)和癌旁组织(N)中蛋白的相对表达量
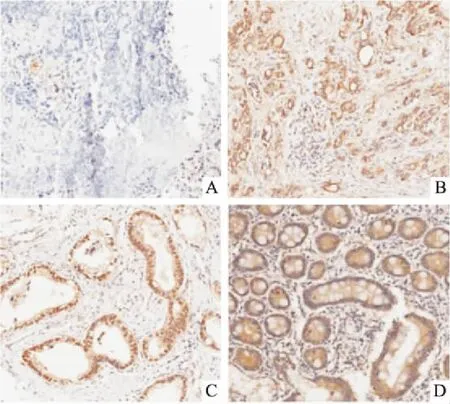
图2 胃癌组织和癌旁组织中NEDD4L的免疫组化结果 ×200
A:低分化胃癌组织;B:中分化胃癌组织;C:高分化胃癌组织;D:癌旁正常组织
2.2NEDD4L在胃癌组织中的表达与临床病理参数之间的关系胃癌组织中NEDD4L蛋白的表达与分化程度(P<0.05)、浸润深度(P<0.05)和临床TNM分期(P<0.05)显著相关,而与其他病理参数无显著相关性,见表1。
2.3生存分析Kaplan-Meier生存分析表明浸润深度、肿瘤大小、临床TNM分期、分化程度、淋巴结转移及NEDD4L的表达水平均与胃癌患者预后生存期相关,见表2;高表达NEDD4L的患者其平均生存时间(mean survival time,MST)要明显高于低表达NEDD4L的患者(59.1个月vs37.7个月,P<0.001),见图3;单因素Cox回归分析表明浸润深度、肿瘤大小、TNM分期、分化程度、淋巴结转移状态以及NEDD4L的表达水平均与胃癌患者生存期密切相关;多因素Cox回归模型分析结果表明NEDD4L的表达水平(HR=0.467,95%CI:0.260~0.838,P<0.05)是胃癌的独立预后因素,见表3。

表1 胃癌组织中NEDD4L的表达与临床病理参数之间的关系

表2 胃癌病理参数与患者预后关系的分析
3 讨论
近年来有多项研究表明,NEDD4L在肿瘤的发展中扮演着重要角色。Hu et al[6]报道NEDD4L在前列腺癌组织中低表达,而且NEDD4L表达降低和肿瘤的侵袭性正相关。He et al[7]发现NEDD4L的下调在恶性脑胶质瘤中和肿瘤的侵袭性增强以及患者的不良预后相关。在肺癌以及肝癌也发现类似情况[8-9]。Gao et al[10]发现NEDD4L在胃癌组织中的低表达与患者的不良预后相关,但该研究样本量相对较小,且未包含正常对照,临床意义有限。

图3 NEDD4L表达与胃癌患者术后生存期的生存曲线分析
本研究结果显示NEDD4L在胃癌组织中的mRNA和蛋白质表达水平相对于癌旁正常组织明显降低,提示NEDD4L基因的低表达或许参与胃癌发生过程;大样本量组织芯片的免疫组化结果也显示NEDD4L在胃癌组织中的表达明显低于正常对照,临床病理参数分析表明肿瘤分化程度、浸润深度和临床TNM分期均与NEDD4L蛋白的表达显著相关,提示NEDD4L可能与胃癌细胞的增殖和侵袭密切相关,在胃癌发展中发挥重要作用;生存分析结果表明NEDD4L的下调与胃癌患者较短的生存期显著相关,NEDD4L高表达是胃癌患者良好预后的独立预测因子。

表3 临床病理参数及患者预后的Cox回归分析
本研究虽然探讨了NEDD4L在胃癌和癌旁正常组织中的表达差异及NEDD4L表达与胃癌患者预后的关系,但是并没有深入研究其作用的内在分子机制,关于NEDD4L在肿瘤中发挥作用的具体分子机制,目前相关报道有限,还有待进一步研究。
综上所述,NEDD4L在胃癌组织中的表达与肿瘤组织分化程度、浸润深度和临床TNM分期负相关,而且NEDD4L高表达的胃癌患者预后较好,这表明NEDD4L在胃癌的发生发展中可能发挥着重要作用,随着研究的深入,NEDD4L有可能作为胃癌诊断和治疗的新靶标。

