刷状聚磷酸酯包载阿霉素形成的纳米颗粒对胰腺癌BxPC-3细胞株的杀伤效应
杨席席,任 乐,高 萌,许 朝,余 跃
胰腺癌是一种恶性程度高,病情进展迅速,且预后较差的消化道肿瘤,5年存活率目前已不足5%[1-2]。大多数患者被诊出时已错过手术机会,目前临床中晚期多以化疗为主。阿霉素(doxorubicin,Dox)是一种广谱的肿瘤化疗药物,临床上已应用于多种癌症的治疗,但Dox对骨髓及心脏等明显的毒副作用,限制了其在临床癌症治疗的应用[3-4]。聚乙二醇(polyethylene glycol,PEG)修饰的聚磷酸酯化合物近年来越来越受到人们的关注,在多种癌症治疗方面有显著疗效,PEG修饰的纳米颗粒可以有效增加其药物的水溶性,且随其密度增大,可以显著延长血液中循环,这些将使得其包载的药物能够在肿瘤部位富集而发挥更强的抗肿瘤效应[5-6]。该研究旨在设计不同PEG密度刷状聚磷酸酯纳米颗粒,探究其被胰腺癌细胞摄取差异,及对胰腺癌细胞的杀伤效应,为进一步将聚磷酸酯纳米材料应用于胰腺癌临床治疗提供理论参考。
1 材料与方法
1.1材料阿霉素盐酸盐/Dox购自北京华丰有限公司;NoPEG-NP、LowPEG-NP、HighPEG-NP系华南理工大学杨显珠教授馈赠;人胰腺癌细胞系BxPC-3购自上海细胞库;噻唑蓝(MTT)购自美国Sigma -Aldrich公司;RPMI-1640培养基购自美国 Invitrogen公司。
1.2方法
1.2.1纳米颗粒的制备 将已制备的刷状聚磷酸酯聚合物NoPEG-NP、LowPEG-NP、HighPEG-NP和Dox溶于二甲亚砜(DMSO)溶液中,再通过搅拌、透析、浓缩等过程将Dox通过疏水间作用力包载其中而获得纳米颗粒NoPEG-NPDox、LowPEG-NPDox及HighPEG-NPDox。
1.2.2纳米颗粒的粒径(particle size,PS)及其血清稳定性检测 分别取制备好的纳米颗粒NoPEG-NPDox、LowPEG-NPDox及HighPEG-NPDox溶液各100 μl加入到不同的比色皿中,用动态光散射仪(dynamic light Scatterometer,DLS)来检测颗粒PS,温度控制在25 ℃,需重复此实验3次。其次为了了解各种纳米药物是否能在血清中稳定存在,将其加入含10% 胎牛血清的RPMI-1640 溶液中边孵育边缓慢搅拌,然后用DLS分别检测不同纳米颗粒在相应时间点的PS大小,分析其稳定性。
1.2.3细胞培养 BxPC-3细胞系用含10% 胎牛血清、1%双抗的RPMI-1640 培养液培养于恒温孵育箱中(37 ℃、5% CO2),当细胞生长到对数期时,即贴壁面积达80%~90%时,用0.25%胰酶消化。
1.2.4FACS检测纳米颗粒NoPEG-NPDox、LowPEG-NPDox、HighPEG-NPDox及游离阿霉素(Free Dox)各组细胞摄取差异 将生长状态良好的BxPC-3细胞植入24孔板,每孔约10万细胞。将孔板放到恒温培养箱中进行培养过夜,次日用RPMI-1640完全培养基配置含游离 Dox或纳米颗粒NoPEG-NPDox、LowPEG-NPDox、HighPEG-NPDox,使Dox浓度均为3 μg/ml。温箱孵育2 h,每组3个平行孔,后取出培养板,吸去其中旧的含有颗粒和纳米药物的培养基,后向板中加入适量1×PBS缓冲液清洗3次,充分洗去孔板中药物残留。接下来向每孔中加入等量0.25%的胰酶进行消化,温箱孵育3~5 min 终止消化,后将其转移至事先准备好的洁净流式管中进行离心,4 ℃、1 000 r/min、5 min,结束后去除上清液,加入适量缓冲液重悬(250 μl左右),流式上样检测,后用FlowJo 7.6.1.处理数据,算出不同组细胞摄取的Dox量。
1.2.5MTT法检测不同纳米颗粒及游离Dox各组对细胞的杀伤效果 将生长状态良好的BxPC-3细胞种植于96孔板中,5 000细胞/孔。将其置于温箱孵育过夜,次日分别加入用RPMI-1640完全培养液配制的含Dox浓度为0.50、 1.00、2.00、4.00 μg/ml的游离Dox和聚磷酸酯纳米颗粒NoPEG-NPDox、LowPEG-NPDox、HighPEG-NPDox,500 μl孔, 每组设4个平行孔,另外设置只含细胞不做任何处理的细胞孔作为空白对照。温箱孵育4 h,后取出弃去旧的培养液,换上新的RPMI-1640完全培养基,继续培养48 h,期间倒置显微镜下仔细观察细胞生长状态,培养结束后向板中加入由培养液和已过滤除菌的MTT溶液混合,浓度为1 mg/ml,100 μl/孔,温箱孵育4 h后取出向板中加入事先配置好20% SDS细胞裂解液(100 μl/孔),放置温箱中继续培养,8 h后拿出用酶标仪进行检测,用软件Excel 2013、SPSS 16.0和GraphPad.Prism.v 5.0.处理测好的对应孔的吸光度(optical density,OD)值,计算细胞存活率:细胞存活率(%)= (药物细胞组OD值-空白对照组OD值) / (非光照不加药细胞组OD值-空白对照组OD值) ×100%。
1.2.6活死细胞染色法检测各组纳米颗粒细胞杀伤情况 BxPC-3细胞种板步骤基本同流式检测,将完全培养液配制的含Dox浓度为4 μg/ml的游离组和纳米颗粒分别加入到相应的孔板中,培养箱孵育4 h后取出弃去旧的培养液,换上新的培养基,继续温箱孵育48 h,后将PBS配好的死细胞染色液溴乙非啶豪莫二聚体(4 μmol/L)和活细胞染色液钙黄绿素乙酰甲酯( 2 μmol/L)加入孔板中,100 μl/孔。室温孵30 min,后用荧光显微镜观察并拍照保存,最后用软件Image J处理相应数据。
2 结果
2.1不同聚磷酸酯纳米药物的PS、分布及其血清中的稳定性首先通过核磁表征等证明成功合成了刷状聚磷酸酯纳米颗粒NoPEG-NPDox、LowPEG-NPDox和HighPEG-NPDox。通过DLS检测证明制备好的纳米颗粒NoPEG-NPDox、LowPEG-NPDox或HighPEG-NPDox的PS,大小约为95 nm,见图1A。PEG壳层的存在阻止了这些运载有Dox 纳米颗粒的聚集成团,将颗粒置于10%胎牛血清的RPMI-1640培养基中培养,随着时间的延长,颗粒的PS也基本在一个固定PS范围内进行波动,说明其在血液中可以稳定存在,血清稳定性好,见图1B。
2.2FACS结果显示三种纳米颗粒中P(CEP30-EEP10)/Dox/NoPEG-NPDox被胰腺癌细胞摄取更多在细胞完成温箱孵育摄取2 h后,FACS检测每组细胞中摄取的Dox量见图2B。胰腺癌细胞和三种纳米颗粒共孵育2 h后,NoPEG-NPDox胞内的Dox平均荧光强度(mean flourscence indensity,MFI)约为LowPEG-NPDox组的2倍(t=8.845,P<0.001),LowPEG-NPDox组约为HighPEG-NPDox(t=8.367,P<0.001)的1.6倍,其中三组颗粒的Dox的荧光量均低于Free Dox组,NoPEG-NPDox的荧光量仅略低于游离组,各组间差异有统计学意义(P<0.001)。
2.3MTT法显示纳米颗粒NoPEG-NPDox对细胞的杀伤作用更强加药孵育后3种纳米药物抑制细胞的生长作用为NoPEG-NPDox组强于LowPEG-NPDox组,其次是HighPEG-NPDox组,其中Free Dox组略强于NoPEG-NPDox组。如Dox浓度为4.0 μg/ml时,Free Dox组对细胞的抑制率为82.40%,接近85%,而NoPEG-NPDox组抑制率也达到了77.55%,接近于80%,已和游离组细胞抑制率相近,而其余两组LowPEG-NPDox和HighPEG-NPDox相对较弱,分别只有58.85%和39.74%,均明显低于NoPEG-NPDox组。见图3、表1。
2.4各种纳米颗粒对细胞的杀伤情况活死细胞染色法结果显示:红色代表死细胞,绿色代表活细胞,见图3B,加药培养后NoPEG-NPDox组单个视野下死细胞所占比例高于LowPEG-NPDox组(t=7.594,P<0.01),LowPEG-NPDox组强于HighPEG-NPDox组(t=7.921,P<0.01),其中Free Dox组略高于NoPEG-NPDox组(t=7.754,P<0.01),各组间差异有统计学意义。见图3。
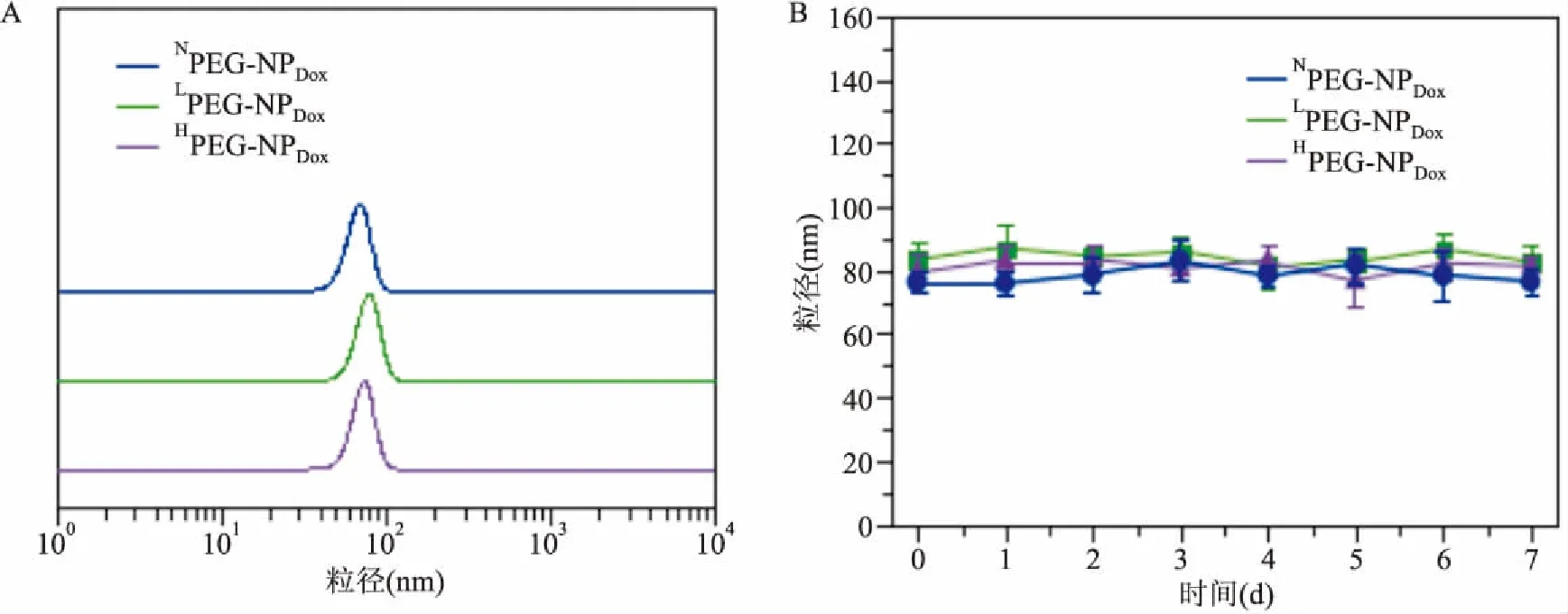
图1 颗粒相关性质的表征

图2 FACS检测3种纳米颗粒被细胞摄取情况
A:流式峰图;B:柱状图;1:NoPEG-NPDox组;2:LowPEG-NPDox组;3:HighPEG-NPDox组;4:Free Dox组;与NoPEG-NPDox组比较:***P<0.001;与LowPEG-NPDox组比较:△△△P<0.001;与HighPEG-NPDox组比较:###P<0.001

表1 加药孵育后各处理组在不同Dox浓度下对BxPC-3细胞生长的抑制率
与Free Dox比较:*P<0.01,**P<0.001;与NoPEG-NPDox比较:△P<0.01,△△P<0.001;与LowPEG-NPDox比较:#P<0.01,##P<0.001
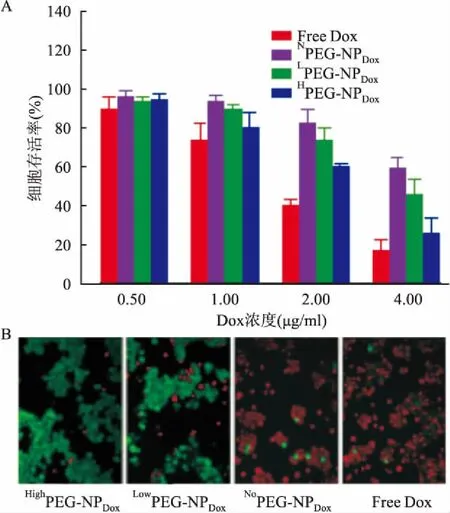
图3 三种颗粒对细胞的杀伤情况
A:MTT法检测各组颗粒被细胞摄取后对细胞产生的杀伤情况;B:活死细胞染色法检测各组纳米颗粒对细胞的杀伤效应
3 讨论
Dox通过细胞膜进入癌细胞作用于其DNA,进而产生较强的抗肿瘤药理特性,临床上已用于多种癌症的治疗。但Dox在杀伤肿瘤细胞的同时也对正常组织产生了一定的毒副作用,这些都限制了其在临床癌症治疗的应用。纳米载药体系,是通过一系列包埋、囊封、吸附的方式将临床药物同纳米载体相结合后形成一种稳定的纳米载药系统,它可以增加药物的水溶性,减轻其对正常组织的毒副作用,使得纳米药物在肿瘤部位通过肿瘤的高渗透及滞留效应完成在肿瘤部位的富集,为后期药物在肿瘤部位发挥疗效提供基础[7]。此外也有相关研究[8]报道了酸度响应的超支化纳米材料包载Dox后显示增强的乳腺癌抑制效应。
PEG修饰的聚磷酸酯的化合物近年来越来越受到人们的关注,在多种癌症治疗方面有显著疗效,已在相关文献[9-10]中报道。本研究选用不同密度PEG修饰聚磷酸酯纳米载药体系,PEG修饰后可显著改善药物的水溶性,为后期体内实验药物在血液中能够稳定存在,延长血液中长循环奠定基础。FACS结果显示纳米颗粒NoPEG-NPDox被细胞摄取更多,多于LowPEG-NPDox及HighPEG-NPDox,这可能是由于纳米颗粒的PEG密度越大时,会使得其柔韧性增加,抵抗细胞摄取的能力越强,因此没有PEG链修饰的NoPEG-NPDox在三种颗粒中相对摄取最好,而Free Dox属于小分子物质,可以通过扩散的形式进入细胞,故同等条件下游离组相对纳米颗粒摄取多一些[11]。因NoPEG-NPDox在肿瘤细胞内Dox含量相对最多,故后续MTT实验中NoPEG-NPDox的细胞杀伤效果要强于LowPEG-NPDox,再者HighPEG-NPDox。且Dox浓度为4.0 μg/ml,NoPEG-NPDox的细胞杀伤效果和游离组接近,为80%左右,说明通过纳米载药系统有效地提高了Dox对胰腺癌细胞的杀伤作用。
综上所述,本体外研究证明了纳米颗粒NoPEG-NPDox能够更好地被胰腺癌细胞摄取,后期杀伤癌细胞效应更强。在细胞水平上,PEG的密度影响细胞对其的摄取量,PEG密度越大,细胞摄取越少,而且虽然游离Dox的摄取量要多于NoPEG-NPDox,但因游离的Dox其本身毒副作用的存在,且体内应用时它极易被血液系统清除,而要达到体内抑瘤效应时,其对正常组织的毒副作用远大于抑瘤作用,故远期应用方面,其整体效果远不及聚磷酸酯纳米药物,后者可以避免血液的清除,在血液中长期稳定存在,更多的纳米药物在肿瘤部位富集,进而对肿瘤部位产生更强杀伤效应。而不同PEG密度纳米药物在体内应用时其体内循环情况是否和细胞水平一样,有待进一步研究,为临床实践及应用提供更多的价值参考。

