Wnt/β-catenin信号通路对小鼠海马神经干细胞的影响
张先虎,朱俊德,龙婷婷,王俊婕,康朝胜
我国每年死于脑血管和神经系统疾病的患者约130万,在我国致死和致残原因中均名列第一[1]。因此,如何治愈或延缓脑血管和神经系统病变成为亟需解决的问题。神经干细胞(neural stem cells, NSCs)是来源于中枢神经系统的多能干细胞,可以分化为神经元、胶质细胞等多种神经细胞[2]。NSCs可为神经损伤的修复提供源源不断的原材料,但是其发挥修复损伤的调控机制仍不是十分清楚。Wnt/β-catenin信号通路是神经发育过程中的一条基本通路,可调控NSCs细胞周期的进程,促使NSCs增殖,但是其对NSCs分化方向的影响却没有达成共识[3-4]。该实验通过研究Wnt3a激活Wnt/β-catenin信号通路后对小鼠海马源性 NSCs的增殖与分化的影响,寻找调控NSCs增殖和分化的关键因素,以期为神经系统疾病的预防与治疗提供新的思路。
1 材料与方法
1.1材料随机选取20只新生24 h昆明种小鼠(体质量2~3 g),清洁级,合格证号:SCXK(黔)[2018-0001],由贵州医科大学实验动物中心提供,实验过程中对动物处理严格执行动物伦理学标准。DMEM/F12(1 ∶1)培养基与B27 复合物购自美国 Gibco 公司;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮细胞生长因子(epidermal growth factor, EGF)、Wnt3a蛋白购自美国 Peprotech 公司;胎牛血清(FBS)、多聚赖氨酸购自美国 Sigma 公司;磷酸盐缓冲液(PBS)、0.25% TRYpsin/EDTA、青霉素-链霉素溶液购自美国Hyclone 公司;巢蛋白(Nestin)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、鼠单克隆5-溴-2-脱氧尿核苷(Brd U)、鼠单克隆神经元特异烯醇化酶(neuron-specific enolase,NSE)、兔抗鼠单克隆巢蛋白(Nestin)与兔IgG SABC-FITC免疫组化染色试剂盒购自武汉博士德生物公司;4,6-联脒-2-苯基吲哚溶液(DAPI)、抗荧光淬灭封片剂购自北京Solarbio公司;25 cm2细胞培养瓶、6孔板、15 ml 离心管购自无锡耐思生物科技有限公司。
1.2方法
1.2.1NSCs分离及培养 新生24 h昆明种小鼠断头处死,无菌条件下冰上取出双侧大脑,放入盛有4 ℃ PBS 溶液培养皿中漂洗,然后分离海马组织,仔细剥离脑膜及血管将海马组织剪碎至2.0 mm 左右,加入0.25% Trypsin/EDTA 2.0 ml,37 ℃消化后用枪头轻柔吹打至乳糜状,加入10% FBS终止消化。300目筛网滤过后成细胞悬液,细胞悬液用PBS 溶液清洗一次后加入NSCs完全培养基(DMEM/F12、20 ng/ml bFGF、20 ng/ml EGF、20 ng/ml B27、100 U/ml青霉素、100 μg/ml链霉素),以细胞浓度为1×106/ml接种于25 cm2细胞培养瓶。37 ℃、5% CO2条件下培养,每2~3 d半量换液一次,6~7 d传代。
1.2.2NSCs传代培养 无菌条件下将细胞悬液转移至离心管中,1 000 r/min离心5 min后弃上清液,加入0.05% Trypsin/EDTA 复合消化酶500 μl,37 ℃消化后用枪头轻柔吹打20次,加入2.0 ml PBS稀释消化酶,1 000 r/min离心5 min后弃上清液,加入NSCs完全培养基重悬细胞,调整细胞浓度为1×106/ml。
1.2.3NSCs诱导分化 预先将6孔板以多聚赖氨酸包被。取培养3 d的NSCs悬液2.0 ml,1 000 r/min离心5 min后弃上清液,分别以NSCs培养基、NSCs分化培养基(DMEM/F12、20 ng/ml B27、10% FBS、100 U/ml 青霉素、100 μg/ml链霉素)2.0 ml重悬,接种至6孔板,每组2个孔加入并标记。37 ℃、5% CO2条件下培养2 d后,行免疫荧光鉴定。
1.2.4NSCs及分化细胞免疫荧光鉴定 取出6孔板,吸出上清液,经清洗、4%多聚甲醛固定、0.1% Triton X-100 通透、3% H2O2灭活内源性过氧化物酶后滴加正常山羊血清封闭液(1 ∶10),室温封闭,20 min,甩干,不洗。分别滴加Nestin、NSE、GFAP单克隆抗体(1 ∶100),对照组不加一抗,用 0. 01 mol/LPBS 代替;湿盒中4 ℃过夜孵育后PBS清洗。分别滴加生物素标记小鼠IgG(1 ∶100)、羊抗鼠IgG(1 ∶100),37 ℃孵育30 min,PBS清洗。滴加SABC-FITC(1 ∶100),37 ℃孵育30 min,PBS清洗。加入 DAPI 进行细胞核染色,室温避光孵育 5~10 min,PBS清洗(500 μl/孔×5 min×3次)。加入抗荧光淬灭封片剂,荧光显微镜下观察。
1.2.5NSCs的Wnt3a处理及分组 将传代2~3次所得NSCs分为正常对照组(sham组)与Wnt3a组,Wnt3a组再分为Wnt3a低剂量组(10 μg/ml)、Wnt3a中剂量组(25 μg/ml)和Wnt3a高剂量组(50 μg/ml)。
1.2.6CCK-8检测 将各组处理后的神经球制成NSCs单细胞悬液,以2×104/孔的密度种植于96孔板内,96孔板的周围一圈加无菌PBS培养液(因为周围一圈最容易蒸发,添加水可缓解蒸发)。按实验顺序在每孔中加入100.0 μl相应组别的培养基,培养48 h,同时设立仅加培养基但不含NSCs的孔作为空白对照。培养结束后,每孔内加入浓度10%的10.0 μl CCK-8溶液,37 ℃孵育6 h。用全波长酶标仪在450 nm处检测吸光度(OD)值。每组细胞设置3个复孔,每个实验重复3次。结果判定:OD值与培养体系中所含的活细胞数成正比,OD值越大代表培养体系中的细胞数量越多,因此,相同的培养时间内,OD值越大说明细胞增殖的越多,增殖的能力越强。
1.2.7流式细胞仪检测 将上述分组处理后的NSCs培养48 h;收集细胞后用PBS洗涤细胞一次(离心2 000 r/min、5 min),收集细胞并调整细胞浓度为1.0×106/ml,取1.0 ml单细胞悬液;制备的单细胞悬液离心后,去除上清液,在细胞中加入体积分数为75%冷乙醇500 μl固定(4 ℃过夜),染色前用PBS洗去固定液,细胞悬液用200目筛网过滤一次;加入100 μl RNase A 37 ℃水浴30 min;再加入400 μl PI染色混匀,4 ℃避光30 min;上机检测,记录激发波长488 nm处红色荧光;流式细胞术分析。
1.2.8Western blot检测 将上述分组处理后的NSCs培养48 h后置于6孔培养板中诱导贴壁,经过自然分化6 d后,将所得细胞进行裂解、离心提取蛋白,BCA 蛋白定量后,进行 SDS-PAGE 凝胶电泳和转膜,用溶于TBST的5%脱脂牛奶进行封闭, 室温孵育1 h后,加入GFAP、NSE单克隆抗体(1 ∶100),室温孵育1 h,置于4 ℃环境中过夜,过夜后室温下复温30~60 min,然后用TBST洗涤,随即加入相应二抗(1 ∶200),室温孵育1 h,孵育完成后用TBST洗涤。加入曝光液后,拍照分析。

2 结果
2.1NSCs原代培养结果完整分离出新生24 h小鼠海马组织,见图1;原代细胞培养1 d 后可见部分无突起、折光性良好的“满天星”样的悬浮细胞,见图2A;2~3 d 后可见由不同数目细胞组成的、大小不等的细胞球,形态规则,细胞的折光性强,悬浮稳定,呈“桑葚”状,见图2B;5~7 d后可见大量神经细胞球,部分神经细胞球可见中心折光性减弱,如“黑帽”样,见图 2C,此时位于内部的细胞大量坏死,细胞悬浮稳定性下降,开始出现贴壁分化的现象。
图1 新生24 h小鼠海马组织

图2小鼠海马组织NSCs原代培养×200
A:原代培养1 d的NSCs;B:原代培养2~ 3 d的NSCs球;C:原代培养5~ 7 d的NSCs球
2.2免疫荧光检测结果原代培养的小鼠海马干细胞Nestin染色阳性,并且聚集而成球形,见图3A。NSCs贴壁后12~24 h出现以NSCs为中心向外周的细胞迁移,呈“齿轮”状;迁移的细胞突起增多,胞体增大,见图3B 。神经元诱导培养基培养2 d的NSCs经NSE免疫荧光检测,可见到胞体呈圆形,周围有短突起样的神经元,见图3C。NSCs经GFAP免疫荧光检测可见到具有较长突起的星形样胶质细胞,部分交织成网状,见图3D。
2.3CCK-8法检测结果NSCs不同处理组培养48 h后细胞增殖活力结果见图4。与sham组比较,Wnt3a低剂量组在450 nm处的OD值增加,差异有统计学意义(t=4.576,F=1.445,P<0.01);与Wnt3a低剂量组相比,Wnt3a中剂量组在450 nm处的OD值增加,差异有统计学意义(t=2.628,F=2.089,P<0.05);与Wnt3a中剂量组相比,Wnt3a高剂量组在450 nm处的OD值增加,差异有统计学意义(t=6.364,F=2.770,P<0.01)。
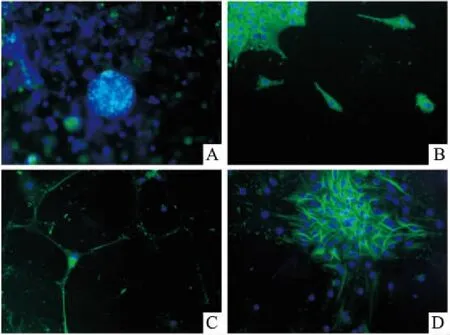
图3 NSCs及分化细胞的免疫荧光法鉴定结果 ×200
A:NSCs球,Nestin染色;B:NSCs球出现细胞迁移,Nestin染色;C:神经元,NSE染色;D:星形胶质细胞,GFAP染色

图4 各组NSCs的CCK-8值
与Sham组比较:*P<0.01;与Wnt3a低剂量组比较:#P<0.05;与Wnt3a中剂量组比较:▼P<0.01
2.4流式细胞仪检测结果NSCs不同处理组培养48 h后细胞周期见图5A~5D。与sham组比较,Wnt3a低剂量组细胞所处G1期比例降低,差异有统计学意义(t=2.706,F=3.840,P<0.05);与Wnt3a低剂量组相比,Wnt3a中剂量组细胞所处G1期比例降低,差异有统计学意义(t=2.519,F=1.024,P<0.05);与Wnt3a中剂量组相比,Wnt3a高剂量组细胞所处G1期比例降低,差异有统计学意义(t=2.682,F=2.680,P<0.05)。与sham组比较,Wnt3a低剂量组细胞所处(S+G2)期比例增加,差异有统计学意义(t=2.812,F=3.490,P<0.05);与Wnt3a低剂量组相比,Wnt3a中剂量组细胞所处(S+G2)期比例增加,差异有统计学意义(t=2.789,F=1.440,P<0.05);与Wnt3a中剂量组相比,Wnt3a高剂量组细胞所处(S+G2)期比例增加,差异有统计学意义(t=2.459,F=1.432,P<0.05)。见图5E。

图5 流式细胞仪检测Wnt3a对NSCs周期的影响
A: 正常对照组(sham组);B: Wnt3a低剂量组;C:.Wnt3a中剂量组;D: Wnt3a高剂量组;E: G1期和(S+G2)期的变化;与Sham组比较:*P<0.05;与Wnt3a低剂量组比较:#P<0.05;与Wnt3a中剂量组比较:▼P<0.05
2.5Westernblot法检测结果与sham组比较,Wnt3a低剂量组NSE蛋白相对表达量增加,差异有统计学意义(t=7.343,F=1.136,P<0.01);与Wnt3a低剂量组相比,Wnt3a中剂量组NSE蛋白相对表达量增加,差异有统计学意义(t=11.59,F=1.417,P<0.001);与Wnt3a中剂量组相比,Wnt3a高剂量组NSE蛋白相对表达量增加,差异有统计学意义(t=5.005,F=1.235,P<0.01)。见图6B。与sham组比较,Wnt3a低剂量组GFAP蛋白相对表达量降低,差异有统计学意义(t=4.070,F=2.136,P<0.01);与Wnt3a低剂量组相比,Wnt3a中剂量组GFAP蛋白相对表达量降低,差异有统计学意义(t=2.488,F=4.259,P<0.05);与Wnt3a中剂量组相比,Wnt3a高剂量组GFAP蛋白相对表达量降低,差异有统计学意义(t=76.03,F=4.413,P<0.01)。见图6。

图6 Western blot检测Wnt3a对NSCs分化的影响
A:各组NSE、GFAP蛋白表达变化;B:NSE/β-actin相对灰度值比较;C:GFAP/β-actin相对灰度值比较;1:sham组,2:Wnt3a低剂量组,3:Wnt3a中剂量组,4:Wnt3a高剂量组;与sham组比较:*P<0.01;与Wnt3a低剂量组比较:#P<0.001;与Wnt3a中剂量组比较:▼P<0.01
3 讨论
NSCs是一类表达特殊标志蛋白Nestin,具有自我更新能力、多向分化潜能、低免疫源性等基本特征的神经祖细胞[5-6]。在哺乳动物中,NSCs主要存在于侧脑室的室管膜下区和海马齿状回的颗粒下层两个部位[7]。NSCs可以不断增殖并迁移至神经系统的不同部位,分化为不同类型的神经元或神经胶质细胞,构成神经系统的各种结构。NSCs的增殖和分化有利于神经系统的生长、发育和修复,这为神经系统的病变提供了有效的治疗思路[8]。如何获得稳定成熟的NSCs,成为研究NSCs需要解决的首要问题。本实验中观察到自小鼠海马分离的细胞在无血清培养基中大部分逐渐死亡、贴壁,少量悬浮生长,经2~3 d可形成稳定的细胞球,经免疫荧光检测Nestin染色阳性,证明是NSCs。NSCs培养5~7 d后即可传代,传代3~4次即可见到纯度较高的NSCs。在本实验中, 对所得NSCs进行一定的诱导,显示NSCs可分化为表达NSE的神经元和表达GFAP的星形胶质细胞。
Wnt3a由352个氨基酸组成,是Wnt(Wingless-related MMTV integration site)基因家族成员中最早表达的一种蛋白,也是最重要的一种蛋白,在整个中枢神经系统发育的过程中持续表达。Wnt3a主要通过激活经典的Wnt/β-catenin信号通路表达作用。Wnt3a与细胞膜上的受体Frizzled(Fz)和共受体低密度受体相关蛋白-6(Lrp6)结合,促使下游胞质调节蛋白糖原合成酶激酶失活,胞质内β-catenin 数量增多并进入细胞核,后者达到一定水平后进入细胞核,在胞核中β-catenin与转录因子家族TCF(T cell factor)/LEF(Lymphoid Enhancer Factor)形成复合体诱导靶基因的转录和表达,从而产生靶细胞的增殖、分化等一系列生物学效应[9]。
Wnt/β-catenin信号通路对NSCs的增殖具有明显作用。体内研究[10]显示创伤性脑损伤后Wnt3a和β-catenin蛋白在损伤侧皮层和海马区的含量增加,这说明Wnt3a通过经典的Wnt/β-catenin信号通路促进神经细胞的增殖,从而修复损伤的神经组织。体外实验也表明Wnt3a的表达上调时NSCs的增殖能力显著提高[11]。本实验结果显示,不同处理组培养NSCs 48 h后,与sham组比较,随着Wnt3a浓度的增加,NSCs相应的在450 nm处OD值增加;所处G1期比例降低,(S+G2)期比例升高;这表明Wnt/β-catenin信号通路激活后NSCs大量进入细胞周期,蛋白质合成增加,物质代谢活跃,处于分裂期的细胞比例提高,增殖能力越强。
Wnt/β-catenin信号通路对NSCs的定向分化具有明显的调控作用,但是对于具体的分化方向目前还没有统一的认识。有研究[12-13]表明,在体外胚胎大鼠海马NSCs培养实验中,在培养基中添加Wnt3a蛋白,同样可增加分化神经元的数量,而减少星形胶质细胞分化的数量。还有研究[14]显示,在体外NSCs培养过程中,加入Wnt3a蛋白可促进NSCs向神经元及星形胶质细胞的分化。但是还有一部分研究[15]表明Wnt3a在调节NSCs增殖的同时,将促进胶质细胞分化的增多,并降低神经元分化的比例,同时通过抑制Wnt3a信号通路的表达将有效增强NSCs向神经元分化的比例。在本研究中,不同处理组培养NSCs 48 h后,用Western blot法检测不同组别的NSE和GFAP的表达量,与sham组比较,Wnt3a组的NSE蛋白相对表达量明显提高,GFAP蛋白相对表达量明显降低。这表明Wnt3a可促进NSCs向神经元的分化,抑制对星形胶质细胞方向的分化,而且这一作用随着Wnt3a含量的提高而加强。
综上所述,本实验成功获得新生24 h小鼠海马的NSCs,并可稳定传代;Wnt/β-catenin信号通路激活后促进NSCs增殖以及向神经元的分化,这为NSCs应用于神经系统疾病的预防与治疗提供了理论依据。

