BGC823中ND5基因突变对其蛋白影响的生物信息预测
李 恋,沈晓玲,张明昱, 包丽丽,纳仁高娃
呼吸链由4个功能相对独立的蛋白复合物组成,复合物Ⅰ是电子转运链上最大、最复杂的酶。真核生物中,复合物Ⅰ由45个不同的蛋白亚基构成,其中仅7个蛋白由线粒体基因编码,包括重要亚基ND5,其余由核基因编码[1]。线粒体基因无组蛋白保护,易受到环境中高浓度氧化物损伤而突变,有研究[2-3]证明线粒体突变会降低NADH脱氢酶活性,使细胞供能失衡引起疾病。线粒体突变与MELAS综合征[4]、帕金森病[5]、肿瘤[6]等有关,甚至与肿瘤发生发展及预后相关[7]。细菌[8]、哺乳动物[9-10]复合物Ⅰ的结构已解析,但人细胞中复合物Ⅰ的重要亚基ND5结构及功能没有详细报道。该研究采用生物信息学方法预测、比较分析正常细胞和BGC823中ND5差异, 为深入探究ND5基因突变与胃癌关系奠定理论基础。
1 材料与方法
1.1材料通过基因组提取试剂盒(北京天根生化科技有限公司)提取得到的BGC823总DNA。
1.2方法
1.2.1PCR反应并测序 设计两对引物扩增ND5(1-2)、ND5(3-4)两个片段,扩增体系(50 μl):DNA模板100 ng,dNTP(2.5 mmol/L)3 μl,上、下游引物(10 μmol/L)各2 μl,10×Buffer 5 μl,Taq酶0.5 μl,超纯水补足体积至50 μl。PCR反应条件:94 ℃预变性5 min,进入热循环:94 ℃变性30 s,退火30 s(退火温度见表1),72 ℃延伸90 s,30个循环。

表1 扩增ND5基因引物表
PCR产物ND5(1-2)、ND5(3-4)两个片段在1%的琼脂糖凝胶上进行电泳,检测条带特异性并切胶纯化后由奥科生物技术公司和华大基因测序。
1.2.2生物信息学比较分析 ProtParam用于分析ND5蛋白质理化性质;用EASE-MM分析稳定性;采用ProtScale 、TMHMM预测蛋白质的亲/疏水性和跨膜区;借助PredictProtien和Swiss-Model在线预测软件对蛋白质的二级和三级结构进行预测分析,用Swiss-Pdb Viewer Manual v3.7软件分析点突变对ND5三级结构的影响。
2 结果
2.1胃癌细胞BGC823中ND5基因突变情况用引物ND5(1-2)、ND5(3-4)PCR扩增、测序后拼接可以获得ND5基因全长。以修正剑桥参考序列(rCRS:NC.012920)为对照,rCRS作为正常细胞线粒体ND5基因,分析比较获得BGC823细胞的ND5基因,将该细胞中与rCRS序列有差异的位点见表2。经分析氨基酸改变情况,BGC823细胞中在12835、13105位点处发生了错义突变。

表2 BGC823细胞中ND5基因突变位点
注:G-A 代表rCRS该位点碱基G,但BGC823细胞中为A;G-G/A 代表rCRS该位点碱基G,但BGC823细胞中同时存在G和A
2.2人ND5蛋白的理化性质预测和分析借助ProtParam(http://web.expasy.org/protparam/)蛋白质理化性质预测网站对正常人ND5蛋白进行理化性质预测,并与发生异质性点突变的BGC823细胞中ND5蛋白进行比对。人线粒体ND5基因编码603个氨基酸;相对分子质量为67 026.51;人线粒体ND5蛋白等电点为9.14,说明ND5是碱性蛋白质;哺乳动物ND5蛋白的半衰期达到了30 h,ND5蛋白的不稳定系数33.95,小于40,属于稳定蛋白质。同时,平均疏水性预测结果显示:0.589,表明是疏水蛋白质。以上特点符合已报道的ND5蛋白的特性。对BGC823的ND5蛋白序列进行预测,显示相对分子质量为67 042.51;等电点相同;平均疏水性预测结果为0.584,说明点突变并未改变蛋白疏水性;ND5蛋白的不稳定系数为34.9,虽然也低于40,但比正常ND5蛋白值稍高,说明突变降低蛋白稳定性。进一步通过EASE-MM(http://sparks-lab.org/server/ease)在线预测12835和13105两处位点发生的突变对ND5蛋白稳定性的影响,结果显示两位的氨基酸的改变均很可能降低了该蛋白的稳定性。
2.3预测与分析突变对ND5蛋白亲水性/疏水性和跨膜区的影响使用ProtScale(http://web.expasy.org/protscale/)在线预测的工具,对人ND5蛋白进行亲水性/疏水性分析, 结果如图1所示。ND5蛋白亲水性的最强位点是29位的赖氨酸(Lysine,K),分值为-2.622;疏水性最强的位点是257位的异亮氨酸(iosleucine,I),分值为3.244。BGC823细胞中的ND5蛋白亲水性的最强位点未改变,但疏水性最强的位点变为126位的异亮氨酸(iosleucine,I)、127位的苏氨酸(threonine,T)、257位的异亮氨酸(iosleucine,I),分值均为3.211。最强疏水位点的增多可能改变蛋白表面的结合位点及疏水肽段分布。ProtScale预测结果见图1,提示人ND5蛋白疏水肽链与亲水肽链相间分布在整个氨基酸序列中,结合ProtParam 的预测结果,显示ND5蛋白是疏水蛋白质。

图1 ND5蛋白的亲水性/疏水性分析A:正常ND5蛋白结果;B:BGC823中ND5蛋白结果
利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)软件对人ND5蛋白进行跨膜区分析,结果提示该蛋白为多次跨膜蛋白质,该结果与ProtScale软件预测结果一致。TMHMM预测ND5蛋白螺旋分别在35~57、85~107、120~137、141~160、172~191、211~233、245~267、272~294、301~320、325~347、368~387、407~429、450~472、482~504和583~602氨基酸之间,N 端在胞内、C端在细胞外,见图2。BGC823中ND5蛋白跨膜区分析结果与正常人ND5蛋白分析结果一致,说明该软件分析显示突变可能并未影响跨膜区的肽段分布,进一步在二级结构中使用其他软件进行分析,以相互验证。
2.4人ND5蛋白二级结构的预测和分析通过PredictProtien(https://www.predictprotein.org/)在线预测ND5蛋白的二级结构,结果见图3A。该蛋白含有17个跨膜螺旋区和2个β-折叠区,螺旋区和β-折叠区的氨基酸比率分别为73.47%和2.65%,LOOP区氨基酸比率为23.88%,说明人ND5蛋白近3/4的氨基酸为螺旋结构。结果显示91.71%的氨基酸残基是疏水的,6.3%的氨基酸残基是亲水的,1.99%的氨基酸残基介于两者之间。
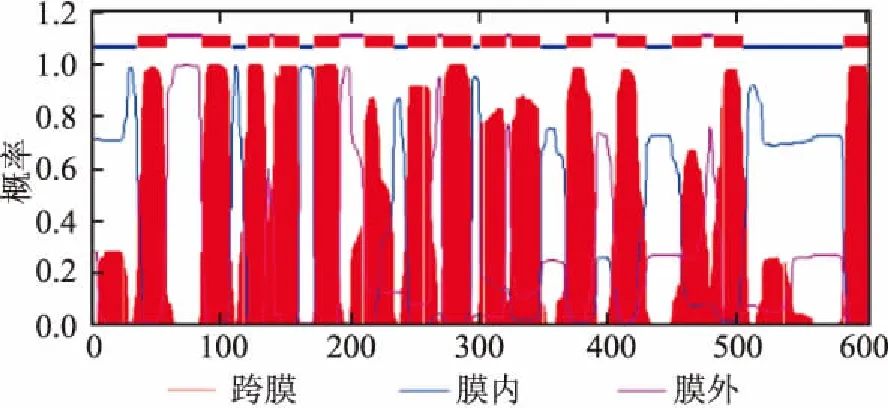
图2 ND5蛋白的跨膜区域预测
BGC823中ND5蛋白的螺旋区与正常ND5蛋白有差别,见图3B,在243~349位点区正常ND5蛋白形成三个螺旋区(243~268、270~319、320~349),BGC823的ND5蛋白形成两个螺旋区(243~319、321~348);在381~389位点区BGC823的ND5蛋白预测结果中多出一个螺旋(385~386);在389~431位点区BGC823的ND5蛋白预测分为两段螺旋(389~402、404~431);在529~580位点区BGC823的ND5蛋白预测分为三段螺旋(529~540、542~561、563~580)。两者在跨膜螺旋区预测结果也有差异,BGC823中ND5蛋白在536~573位点区有两段跨膜螺旋(536~553、557~573),而正常ND5蛋白仅有一段跨膜螺旋(548~563)。同时,预测结果显示,蛋白结合位点两者有差别,BGC823的ND5蛋白比正常ND5蛋白预测结果中在438位点和575位点均多了一个蛋白结合位点,而在535位点少了一个蛋白结合位点。BGC823中ND5的螺旋区、β-折叠区和LOOP区的氨基酸比率没有变化,但疏水氨基酸残基比率降为91.04%,亲水氨基酸残基比率升高为6.47%,介于疏水和亲水性之间的氨基酸残基的比率为2.4%。可见BGC823中两处氨基酸位点的改变影响了疏水肽段和蛋白结合位点的分布,对ND5蛋白二级结构有一定影响。
2.5人ND5蛋白三级结构的预测和分析Swiss-Model(https://www.swissmodel.expasy.org/)可利用同源建模的方法对一段未知的蛋白三级结构作预测。将人ND5蛋白序列输入该在线预测平台后,会自动选择与输入序列同源性最高的已知序列结构为建模主要参照结构,见图4A,其中一个已知结构序列(SMTL ID:5xtc.1)同源性高达99.5%,此序列是由Guo et al[11]完成结构分析,他们研究组对人类电子传递链上的复合物Ⅰ结构进行了分析。人ND5蛋白构建模型的GMQE(全球模型质量评估)分数为0.98,接近1,说明预测可靠性高。进一步分析人ND5蛋白的氨基酸序列与模型蛋白质相似性波形图,见图4B, 预测结构的波形较稳定且绝大部分的氨基酸残基分值不低于0.6, 说明模型较趋近于真实情况。
为了进一步预测BGC823中具有两处氨基酸改变位点的ND5蛋白三级结构是否有改变,使用 Swiss-Pdb Viewer Manual v3.7软件进行分析。BGC823中ND5蛋白167位的丙氨酸(alanine,A)转变为苏氨酸(threonine,T),疏水氨基酸转变为亲水氨基酸,257位的异亮氨酸(Isoleucine,I)转变为缬氨酸(Valine,V),将人ND5蛋白模型的167、257位点进行突变,正常ND5蛋白167位与171、163位分别形成氢键,BGC823中ND5蛋白167位与171、163和164位分别形成氢键,结果显示167位点突变使新的氢键形成,见图5。

图3 人ND5蛋白的二级结构分析A:正常ND5二级结构分析结果;B:BGC823中ND5二级结构分析结果
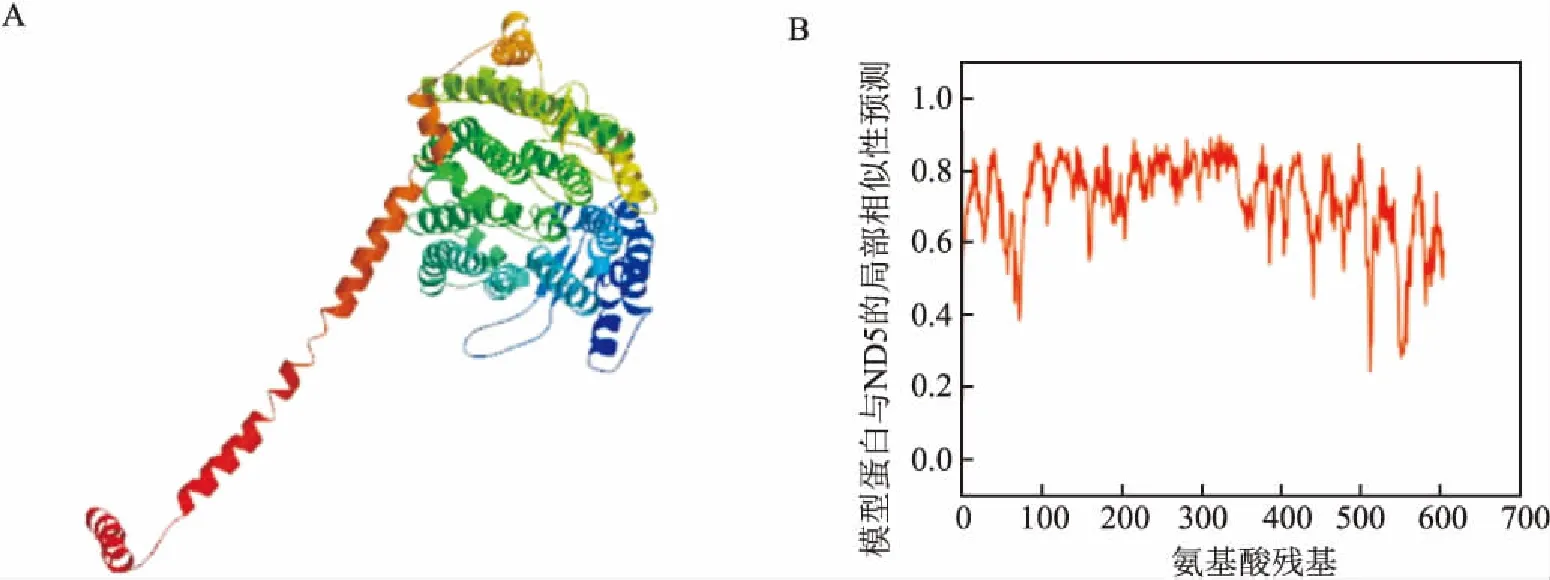
图4 ND5蛋白三级结构及其同源蛋白质相似性波形图A:人ND5蛋白预测的三级结构;B:ND5同源蛋白质相似性波形图
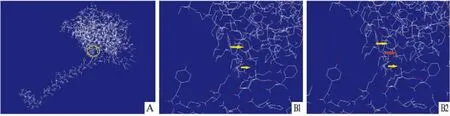
图5 人ND5三级结构及突变前后167位氢键改变
A:ND5蛋白三级结构;B1:正常ND5蛋白167位点处氢键情况;B2:突变ND5蛋白167位点处氢键情况;圆圈为突变位点在ND5三级结构中的位置;黄色箭头指向突变前后一致的化学键;红色箭头指向突变后出现的新化学键
3 讨论
ND5基因位于线粒体染色体上,其编码蛋白是组成复合物Ⅰ的重要亚单位。复合物I由跨膜臂和伸入线粒体基质的亲水臂两部分组成,亲水臂和跨膜臂连接呈L形。ND5位于跨膜臂上,是构成反向运转样质子泵模式的核心亚基。复合物I的跨膜臂与亲水臂连接,另一端与复合物IV结合,主要通过ND5与复合物IV中的COX7C蛋白亚基相互作用[10]。
本研究检测胃癌细胞系中BGC823的ND5基因点突变情况,发现在12835和13105位点的突变会引起其翻译蛋白在167和254位点的错义突变。进一步通过生物信息学分析比较了正常ND5蛋白与BGC823中出现错义突变的ND5蛋白在理化性质、二级结构、三级结构的差异。经ProtParam 和EASE-MM生物信息在线数据库分析发现BGC823中ND5基因的两处突变很可能引起其蛋白稳定性下降。虽然突变前后等电点均为9.14,但经ProtScale软件预测发现突变后的ND5蛋白最强疏水位点在蛋白序列126、127位点增加两处。PredictProtien软件预测结果显示突变后的ND5蛋白二级结构中螺旋区分布与正常蛋白有差别且蛋白结合位点增加,这些改变很可能影响蛋白高级结构形成及蛋白活性。经Swiss-Pdb Viewer Manual v3.7软件预测在蛋白167位点突变后形成了新的氢键。两处突变造成ND5蛋白的物理性状和结构的改变,很可能影响该蛋白正常生物学功能。ND5基因突变与肿瘤发生、发展、预后的相关性已在不断被证实。已有相关研究报道ND5基因突变在多种肿瘤组织中被检测到,与癌症的发生发展有关。Chattopadhyay et al[12]在口腔癌患者中检测ND5基因,找到的5处点突变和7处SNP与肿瘤生长有关。Li et al[13]建议将ND5基因13273位碱基缺失作为患乳腺癌高风险检测的生物标记。Kabekkodu et al[14]发现宫颈癌组织中ND5基因的突变位点数较多,仅次于D-Loop基因。Li et al[15]高通量测序检测乳腺癌患者血液中的线粒体基因突变,其中包括ND5基因在内的一些线粒体基因突变可能被用作乳腺癌诊断的潜在标志物。
根据本研究结果,从发生机制上推测,很可能是由于ND5基因突变引起ND5蛋白结构改变,从而进一步影响复合物Ⅰ的活性,甚至可能影响与其他复合物结合活性,最终引起细胞的能量代谢失衡,而导致肿瘤发生或预后不良等问题。

