铜片-纳米金表面增强拉曼基底的制备及检测应用
何志敏,代叶梅,曾 川,赵文斌,王梦凡,齐 崴,苏荣欣
铜片-纳米金表面增强拉曼基底的制备及检测应用
何志敏1,代叶梅1,曾 川2,赵文斌1,王梦凡1,齐 崴1,苏荣欣1
(1. 天津大学化工学院,天津 300072;2. 珠海出入境检验检疫局技术中心,珠海 519000)
SERS因灵敏度高、制样简便等优势,在食品安全、环境监测等方面应用潜力巨大.SERS技术实现商业化的关键在于如何低价、简便、快速得到重现性良好、可多次循环使用的SERS基底.针对这一难题,开发了一种利用廉价铜片原位还原制备SERS基底的简便新方法.经硝酸处理的铜片原位还原氯金酸,生成的纳米金则覆盖于铜片表面.经检测,所制得的铜片-纳米金基底(CuF-AuNPs)表面粗糙度均一.利用该基底检测不同浓度的罗丹明B(RHb),实验结果显示浓度和SERS峰强度满足关系=1492+12435,2=0.995,检测下限达到1×10-8,mol/L,表明该CuF-AuNPs基底可用于目标物的定性及定量检测.选取1×10-6,mol/L 的RHb样品4次循环检测,结果表明该工艺条件下制备得到的CuF-AuNPs基底具有良好的重现性.
表面增强拉曼散射;原位还原;基底;罗丹明B
拉曼光谱检测相较于其他光谱类型具有操作简便、样品无需复杂的预处理、可在水溶液环境下测定等优势,得到了越来越广泛的应用.然而,拉曼光谱信号强度往往较弱且易受荧光干扰,很大程度上限制了它的应用.随着激光光源的引入,拉曼光谱得到迅速发展,开发出表面增强拉曼光谱、激光共振拉曼光谱、傅里叶拉曼光谱、针尖增强拉曼光谱等技术[1-3],一定程度上克服了传统拉曼检测在信号强度和荧光干扰方面的缺陷,从而适用于不同检测体系.这其中,SERS光谱因在生物医学[4-6]、环境污染[7-8]及食品安全[9-11]检测等领域应用潜力巨大,是当前研究的热点之一.
SERS技术采用纳米级尺度的金属材料(如纳米金或纳米银的颗粒)制备检测基底[12].由拉曼散射原理可知,当入射光照射到纳米尺度的金属颗粒表面时,纳米颗粒尖端部分的电荷密度很高,会形成很强的局域表面电磁场,令纳米金属表面的尖端或间隙处的拉曼信号得到增强[13-17].
近年来,通过调节金属材料的表面形貌、尺寸及排列方式等开发高灵敏度SERS基底的方法备受关注[18-20].Cottat等[21]利用紫外诱导纳米光刻技术制备的纳米金SERS基底,尺寸均一、对卵白素具有良好的检测性能.Dai等[22]在硅基底上沉积一层银纳米颗粒,通过有序组装得到银纳米颗粒包围的三角形纳米银阵列SERS基底.此外,还有通过静电纺丝[23]甚至直接利用自然界生物模板组装法[24-25]来制备SERS基底的方法.然而,这些方法通常需要特殊设备,操作成本较高,不利于SERS基底的推广使用.
基于此,本研究利用市售的廉价铜片(copper foil,CuF)为基底,经过硝酸化处理得到具有均一粗糙表面的铜片,采用原位还原氯金酸制备金纳米粒子的方法,将金纳米颗粒结合在去除表面氧化层的金属铜片表面,从而制备出CuF-AuNPs基底.由于金纳米粒子比银纳米粒子更加稳定,在空气中不易氧化,且金纳米粒子的粒径较银纳米粒子更为可控,容易还原得到粒径分布更均匀的基底,从而表现出更好的增强效果,有利于获得稳定的SERS信号.本文通过优化制备条件,得到了一种简便廉价的CuF-AuNPs基底,最后以食品禁用色素罗丹明B(RHb)为待测物评价该基底的SERS检测性能.
1 实验部分
1.1 试剂与仪器
铜片(CuF),购自国药集团化学试剂有限公司;浓硝酸(HNO3,67%)、氯金酸三水合物(HAuCl4·3H2O,99.9%)、罗丹明B(C28H31ClN2O3,99%),均购自上海晶纯生化科技股份有限公司,其他试剂均为市售分析纯.
多功能拉曼光谱仪(NTEGRA Spectra),俄罗斯NT-MDT公司;紫外-可见分光光度计(TU1810),北京普析通用仪器公司;场发射扫描电子显微镜(SEM),日本日立公司;能量色散X射线光谱仪(EDS),日本日立公司.
1.2 铜片的硝酸预处理
将所购买的铜片剪成长方形,依次浸入纯乙醇和丙酮中,以去除表面的有机物残留,随后浸入双蒸水中超声清洗一段时间,取出用氮气吹干备用.将清洗干净的铜片全部浸入一定浓度的硝酸溶液中,在30℃下静置保温1min,然后用镊子取出,双蒸水清洗2~3次,再次氮气吹干后备用.
1.3 CuF-AuNPs基底的制备
将预处理后的铜片完全浸没入10mL质量分数0.01%的氯金酸溶液中,随后在30℃恒温水浴中静置反应1h.最后用镊子将CuF-AuNPs基底夹出,双蒸水清洗表面,并于50℃的真空干燥箱中烘干备用.
1.4 CuF-AuNPs基底的表征
在预处理后的铜片及CuF-AuNPs基底表面喷涂导电膜,随后利用扫描电子显微镜测定其表面结构,电压设定为3kV,电流10μA.在铜片的原位还原反应过程中,于不同时间取氯金酸溶液,测定其紫外-可见吸收光谱,扫描范围200~800nm.利用EDS对原位还原反应后所得基底进行元素分析,电流10μA,加速电压设定为15kV.
1.5 RHb的CuF-AuNPs基底检测
配置浓度为1×10-3mol/L的RHb溶液,取100mL滴在CuF-AuNPs基底表面,待自然晾干后采用拉曼光谱仪进行测试,在300mW条件下选择633nm的激光光源,10s内积分一次,扫描范围设定为200~1900cm-1,同时以经预处理但未结合AuNPs的铜片作为对照,测定相同浓度RHb的拉曼光谱,每个样品均重复测试3次取平均值.
2 结果与讨论
2.1 CuF-AuNPs基底的制备
图1所示为CuF-AuNPs基底的制备过程.表面粗糙化的基底是令拉曼散射信号增强的必要条件.粗糙化程度不同,会产生不同程度的SERS效应,从而影响检测物的信号效果.本研究中所用的铜片表面覆盖了一层有机保护膜,使得表面十分光滑,不利于金属颗粒的负载,因此首先需要去除保护膜,暴露出粗糙表面.研究中,我们利用硝酸溶液浸泡铜片,由于硝酸对于有机物及金属均具有强腐蚀性和氧化性,在这一过程中,铜片表面有机保护层首先被腐蚀去除,随后硝酸会进一步与表面暴露出的单质铜发生反应,令部分单质铜被氧化为可溶性的铜离子,形成粗糙表面.在这一步中,通过调控腐蚀程度,可以调节基底表面的粗糙程度.

图1 铜片-纳米金表面增强拉曼基底的制备流程
由于Cu2+/Cu的氧化还原电位(+0.34V)低于AuCl4-/Au(+1.002V),因此当表面暴露了单质铜的铜片浸入含有AuCl4-的溶液后,在表面会发生氧化还原反应.单质铜被氧化为可溶性的二价铜离子Cu2+,而溶液中的AuCl4-则在粗糙的铜片表面被原位还原为零价的金纳米颗粒,且附着在铜片表面.该表面由于负载了大量的纳米级金颗粒,因此会产生很强的局域表面电磁场,使吸附在其上的待测物分子的拉曼散射信号得以增强.通过这一方法,便可简便地获得廉价的表面增强拉曼基底CuF-AuNPs.
2.2 硝酸溶液浓度的影响
预处理所用的硝酸溶液浓度会影响所得铜片表面的粗糙程度,进而影响最终CuF-AuNPs基底的信号增强效果,因此是一个需要重点优化的制备条件. 本研究中分别利用不同质量浓度的硝酸溶液预处理铜片,考察其对铜片表面粗糙程度的影响.
图2(a)是经硝酸溶液处理1,min后铜片表面照片,可见原始铜片呈现均匀的金属光泽,这主要是由于表面覆盖着一层保护膜.当利用20%,硝酸处理后,表面出现不均匀的棕色斑纹,继续提高硝酸的浓度,棕色斑纹完全消失,表面不再具有光泽.利用扫描电镜对铜片表面进行观察,图2(b)中20%硝酸处理后铜片表面被部分腐蚀,但仍有较大面积氧化层覆盖. 25%硝酸处理后表面氧化层已基本被去除,形成类似并列排列的短棒状结构,结构单元宽度约500,nm.当用30%,的硝酸处理约10,s时铜片表面产生微小气泡,且气泡量逐渐增多,此浓度下所得铜片表面可形成100~300,nm宽的“山峰”状凸起和“山谷”状凹陷的纳米结构,这样的结构为下一步原位还原反应提供了更多的结合位点,更有利于AuNPs的附着.另外,在“山峰”的尖端处会产生SERS的“避雷针”效应,结合在尖端位置的AuNPs将富集大量电荷,提高检测的灵敏度.而当继续增加硝酸浓度至35%和40%时,铜片表面立即产生大量气泡,反应溶液快速变色,表明铜片本身被强烈地腐蚀,由SEM图可以看出,铜片表面的粗糙程度有所降低,这是因为高浓度的硝酸过度消耗了铜片.因此,本文确定30%的硝酸对铜片处理1,min为最佳的预处理条件.

图2 不同浓度硝酸对铜片的预处理效果
2.3 还原反应时间对CuF-AuNPs基底检测效果的影响
AuNPs在基底表面的分散程度和分布密度对拉曼信号强度有重要影响,为了得到拉曼信号增强效果最明显的基底,需要控制铜片在氯金酸溶液中还原反应时间来调控结合在铜片上AuNPs的密度与分布情况.
反应过程中,我们利用紫外-可见吸收光谱仪测定了溶液中氯金酸含量的变化.如图3(a)所示,287nm处是氯金酸的特征吸收峰.随着反应的进行,该吸收峰强度逐渐下降,说明氯金酸被逐渐消耗,其含量降低,同时可以看到在558nm处出现了一逐渐增强的AuNPs特征吸收峰,这说明AuNPs被铜片表面暴露的单质铜所还原生成,且有部分分散在溶液中.图3(b)表明,从反应开始至35min时,氯金酸的特征吸收峰强度降低较快,而在35min以后则变化趋缓,这说明反应生成的AuNPs已逐渐覆盖了铜片表面,随着铜片上暴露出的能够与溶液中氯金酸发生反应的还原性单质铜越来越少,其还原溶液中氯金酸的能力也逐渐减弱.利用能谱对铜片表面的元素组成进行分析,由图4可以对比看出,原位还原反应后,在3keV左右出现了零价金单质的特征峰,证明了AuNPs在铜片表面的生成和负载.

图3 还原反应过程分析
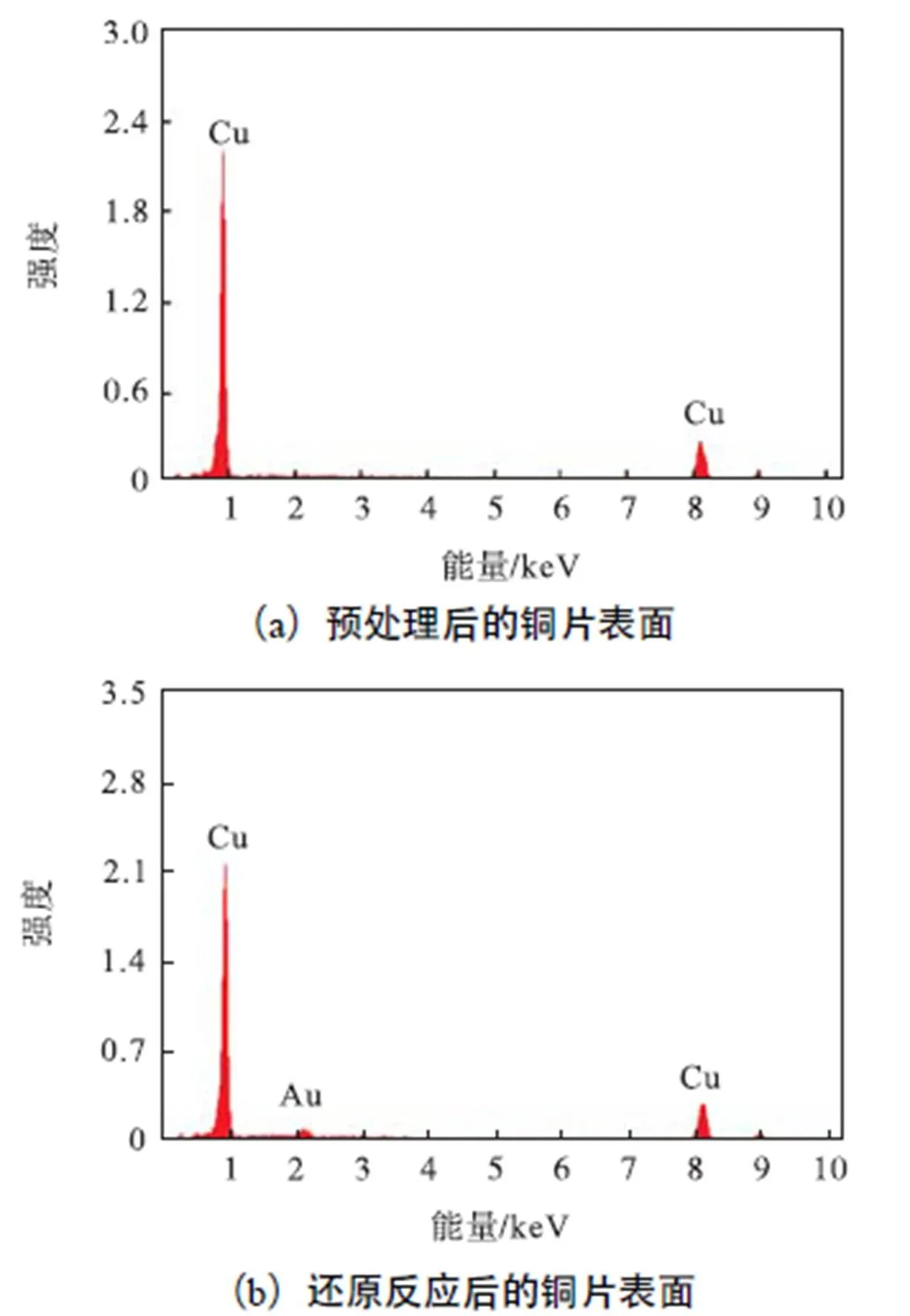
图4 铜片表面的能谱分析
图5所示为原位还原反应不同时间后基底表面的SEM图.可以看出,随着反应时间的延长,AuNPs在铜片表面负载量逐渐增大,AuNPs的表面分布逐渐趋向于均一化.为了考察不同AuNPs负载量对CuF-AuNPs基底SERS检测效果的影响,这里利用图5中所得的6个基底对相同浓度的RHb进行拉曼光谱的测定.图6(a)为相应CuF-AuNPs基底检测RHb的SERS光谱结果,图6(b)是RHb在1,361,cm-1处的特征峰强度随反应时间的变化趋势.可以看出,未结合AuNPs的单纯铜片基底在检测RHb的拉曼光谱时,无有效特征峰出现.根据表面增强拉曼散射的原理:当无金属纳米颗粒时,RHb分子周围微弱的局域电磁场强度不足于形成能被有效捕捉的拉曼散射信号.而当CuF原位还原结合AuNPs后则可以明显检测到629cm-1处的苯环平面弯曲振动峰,1200cm-1处的苯环上C—H弯曲振动峰,1290cm-1处的C—C伸缩振动峰,以及1361、1511、1595和1652cm-1处的苯环上C—C伸缩振动峰.这些尖锐的拉曼特征谱峰都表明CuF-AuNPs基底对RHb分子具有增强的检测效果.

图5 不同还原反应时间下所得基底的表面SEM图
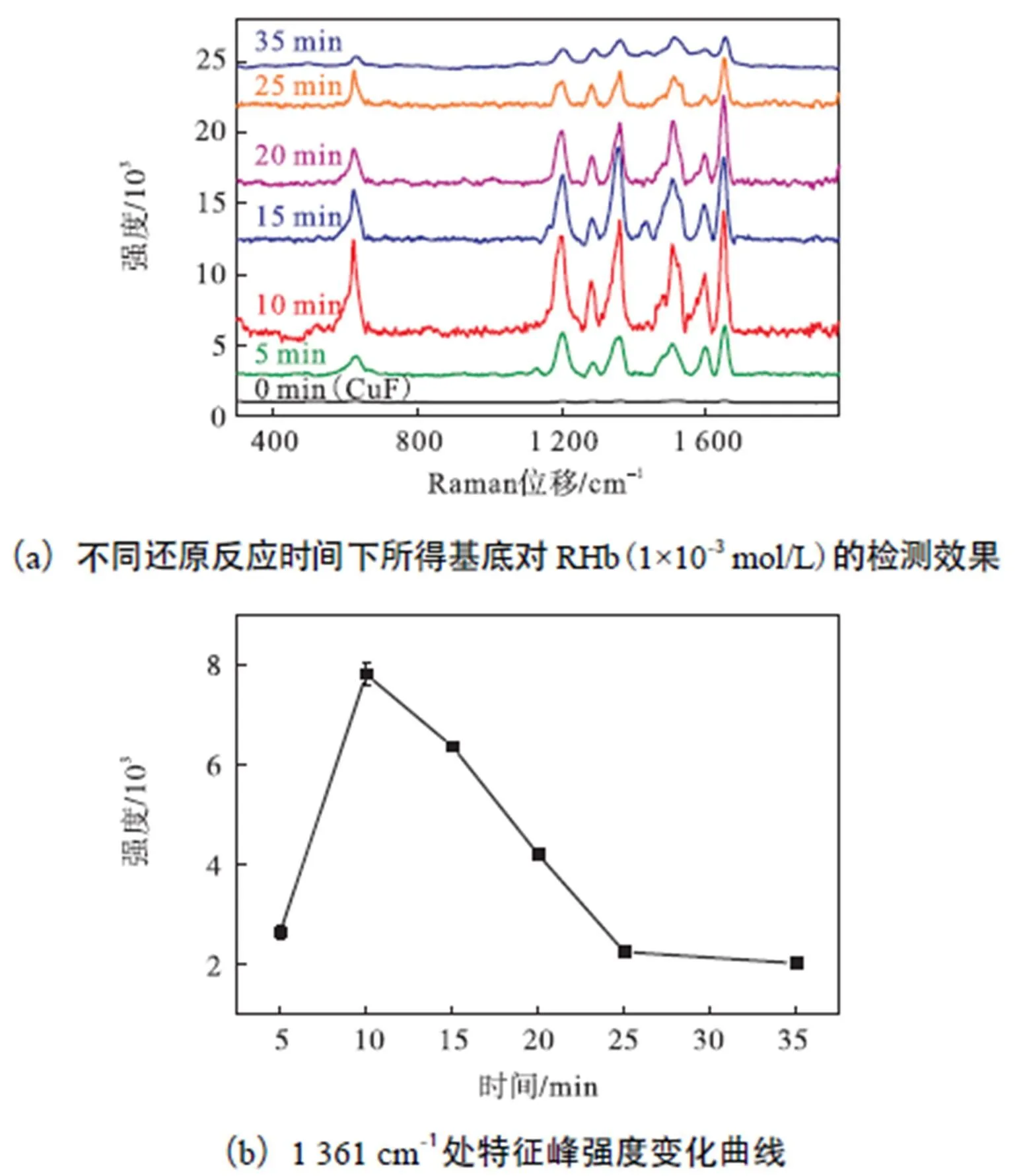
图6 还原反应时间对CuF-AuNPs基底检测效果的影响
结合SEM结果,随着铜片还原氯金酸反应时间的逐渐延长,SERS基底结合的AuNPs由分布稀疏逐渐变为分布均匀,直至最后出现AuNPs的聚集.当反应时间为5,min时,稀疏分布的AuNPs导致RHb周围的局域电场较低而不能形成较强的拉曼特征峰.当反应时间为10,min时,分布均匀的AuNPs因为间隙电荷密度的明显增强,导致RHb周围的局域电场明显增强,从而产生较高强度的拉曼特征峰.当还原反应时间进一步延长(15min到20min),出现部分聚集现象的AuNPs消减了粒子共轭效应,导致拉曼信号减弱. 当反应时间超过25min时,AuNPs聚集程度进一步增大,铜片表面几乎全部被AuNPs覆盖,响应的RHb检测信号大幅减弱.由此可见,CuF-AuNPs基底的检测效果很大程度上决定于铜片表面AuNPs的密度和含量,最终确定制备CuF-AuNPs基底的最佳反应时间为10min.
2.4 CuF-AuNPs基底对RHb的定量检测
表面增强拉曼散射基底的出现大幅提升了拉曼光谱在物质检测中的灵敏度,这使得拉曼光谱有望从传统的定性分析方法发展成为新型的定量检测手段.在本实验中,采用上述研究中得到的最佳条件制备出CuF-AuNPs基底,通过检测浓度为1×10-8~1×10-3,mol/L的RHb溶液,来分析CuF-AuNPs基底的定量检测效果,结果如图7所示.
在图7(a)中,SERS光谱中RHb特征峰强度随溶液中RHb浓度的降低而减弱.在本研究中,能最低限度准确辨别出的RHb分子拉曼特征谱峰所对应的溶液浓度为1×10-8,mol/L,表明在此实验条件下利用CuF-AuNPs基底对RHb的检测限可达到1×10-8mol/L数量级.
针对以上实验结果,这里将横坐标设为RHb溶液浓度的对数值(lgRHb),而纵坐标取RHb在SERS基底上的特征峰强度,通过线性拟合后,发现二者之间具有明显的线性关系(2=0.995),线性方程为=1,492,+12,435.根据以上结果,在测量范围(RHb浓度为1×10-8~1×10-3,mol/L)内,本研究中提出的CuF-AuNPs基底拥有定性及定量检测微量化合物的潜力.

图7 CuF-AuNPs基底对不同浓度RHb的表面增强拉曼检测效果
2.5 CuF-AuNPs基底的均一性与重现性检测
为考察基底的均一性,这里采用最优制备工艺同时处理3块铜片,之后让它们在相同条件下原位还原制备金纳米粒子10,min.对于制备得到的3块CuF-AuNPs基底,其检测RHb的特征峰强度的标准差为11.32%,说明此工艺下得到的SERS基底具有良好的均一性.任意挑选3块铜片中的一块,重复进行其对RHb的光谱测定.完成一次测定后,用乙醇溶剂洗去基底表面残留的检测物RHb,待溶剂完全挥发,重复进行RHb拉曼光谱测定,结果如图8所示.在一块CuF-AuNPs 基底上多次经乙醇清洗并重复测样,并没有对RHb的特征峰强度和位置产生明显影响,该基底具有良好的重现性.
3 结 语
利用市售廉价的铜片,经硝酸溶液进行表面粗糙化预处理,再通过原位还原氯金酸,制备得到了一种新型的CuF-AuNPs基底.优化了基底制备过程中硝酸溶液浓度、预处理时间、氯金酸原位还原反应时间等关键因素,得到了具有较好SERS检测效果的CuF-AuNPs基底.对于罗丹明的SERS检测结果表明,当RHb浓度为1×10-8~1×10-3mol/L时,本研究中制备得到的CuF-AuNPs基底能对其实现定量检测,SERS特征峰强度与RHb浓度的对数值满足如下关系:=1492+12435,2=0.995,表明二者之间线性关系良好,RHb的检测下限可达1×10-8mol/L. 重现性测试表明该工艺条件下制备得到的CuF-AuNPs基底具有良好的表面均一性和循环重现性,有望为SERS基底的商品化制备提供一种简便、廉价的新方法.
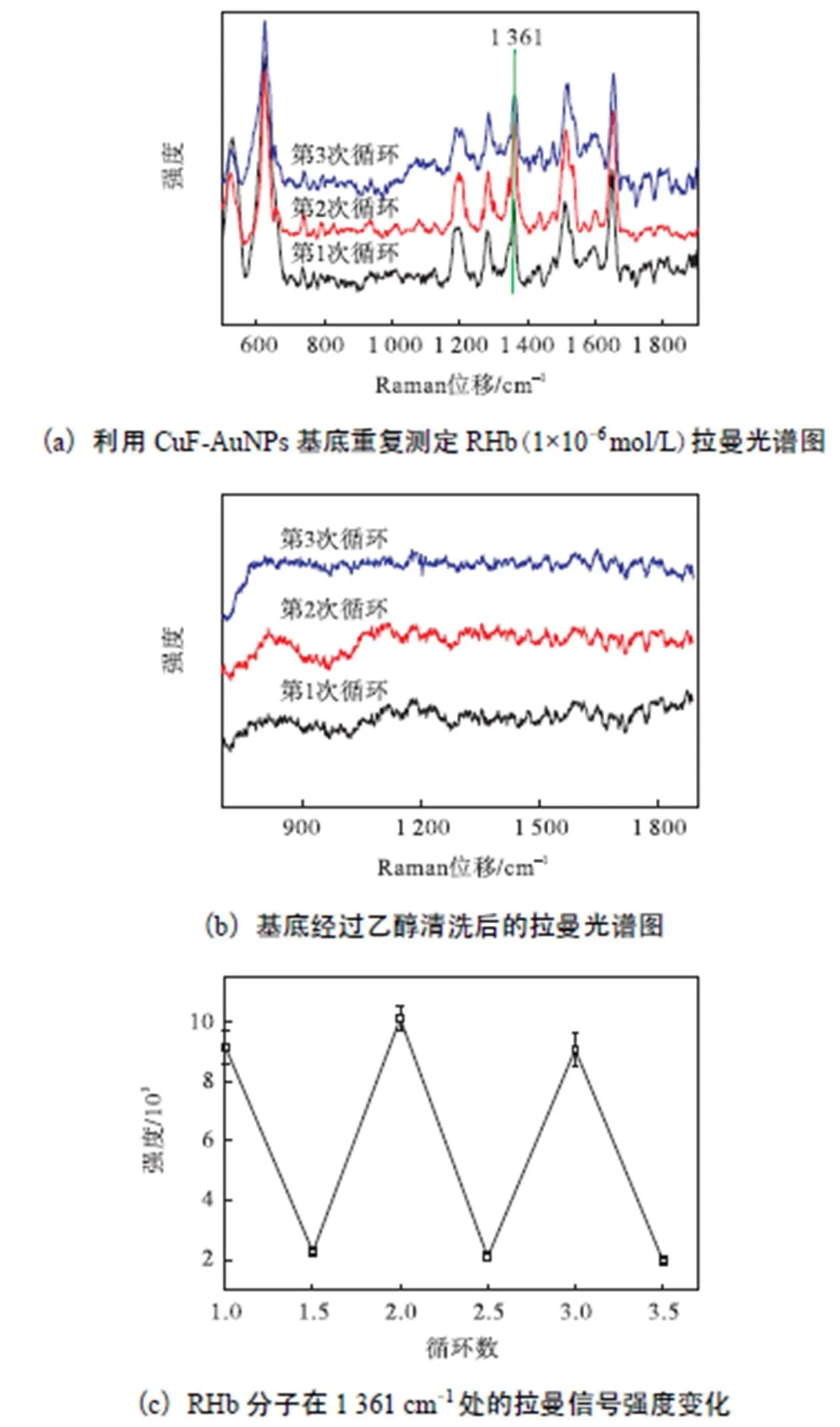
图8 CuF-AuNPs基底的重现性
[1] Stiles P L,Dieringer J A,Shah N C,et al. Surface-enhanced Raman spectroscopy[J]. Annual Review of Analytical Chemistry,2008,1:601-626.
[2] Deckert V. Tip-enhanced raman spectroscopy[J]. Journal of Raman Spectroscopy,2009,40(10):1336-1337.
[3] Hirschfeld T,Chase B. FT-Raman spectroscopy:Development and justification[J]. Applied Spectros-copy,1986,40(2):133-137.
[4] Pisarek M,Roguska A,Kudelski A,et al. The role of Ag particles deposited on TiO2or Al2O3self-organized nanoporous layers in their behavior as SERS-active and biomedical substrates[J]. Materials Chemistry and Physics,2013,139(1):55-65.
[5] Han X X,Chen L,Kuhlmann U,et al. Magnetic titanium dioxide nanocomposites for surface-enhanced resonance Raman spectroscopic determination and degradation of Toxic anilines and phenols[J]. Angewandte Chemie International Edition,2014,53(9):2481-2484.
[6] Qian X,Peng X-H,Ansari D O,et al. In vivo tumor targeting and spectroscopic detection with surface-enhanced Raman nanoparticle tags[J]. Nature Biotechnology,2008,26(1):83-90.
[7] 唐晓萍,张孝芳,齐小花,等. 表面增强拉曼散射光谱快速检测纺织品还原液中联苯胺[J]. 分析化学,2015,43(8):1224-1230.
Tang Xiaoping,Zhang Xiaofang,Qi Xiaohua,et al. Rapid detection of benzidine in reducing solution of textiles by surface-enhanced raman scattering spectroscopy [J]. Chinese Journal of Analytical Chemistry,2015,43(8):1224-1230(in Chinese).
[8] Kubackova J,Fabriciova G,Miskovsky P,et al. Sensitive surface-enhanced Raman spectroscopy(SERS) detection of organochlorine pesticides by alkyl dithiol-functionalized metal nanoparticles-induced plasmonic hot spots[J]. Analytical Chemistry,2015,87(1):663-669.
[9] Cao Q,Liu X,Yuan K,et al. Gold nanoparticles decorated Ag(Cl,Br)micro-necklaces for efficient and stable SERS detection and visible-light photocatalytic degradation of Sudan I[J]. Applied Catalysis B:Environmental,2017,201:607-616.
[10] 黄梅英,李攻科,胡玉玲. 表面增强拉曼光谱法定量检测食品中香豆素[J]. 分析化学,2015,43(8):1218-1223.
Huang Meiying,Li Gongke,Hu Yuling. Quantitative dfetermination of coumarin in food by surface-enhanced raman spectroscopy[J]. Chinese Journal of Analytical Chemistry,2015,43(8):1218-1223(in Chinese).
[11] 赵蕊池,王培龙,石 雷,等. 自组装有序纳米银线表面增强拉曼光谱检测牛奶中三聚氰胺[J]. 分析化学,2017,45(1):75-82.
Zhao Ruichi,Wang Peilong,Shi Lei,et al. Determination of melamine in milk by surface enhanced Raman scattering technique based on self-assemble[J]. Chinese Journal of Analytical Chemistry,2017,45(1):75-82(in Chinese).
[12] Schlucker S. Surface-enhanced Raman spectroscopy:Concepts and chemical applications[J]. Angewandte Chemie International Edition,2014,53(19):4756-4795.
[13] Frens G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J]. Nature,1973,241(105):20-22.
[14] Lee P,Meisel D. Adsorption and surface-enhanced Raman of dyes on silver and gold sols[J]. Journal of Physical Chemistry,1982,86(17):3391-3395.
[15] Huang X,El-Sayed I H,Qian W,et al. Cancer cell imaging and photothermal therapy in the near-infrared region by using gold nanorods[J]. Journal of the American Chemical Society,2006,128(6):2115-2120.
[16] Garcia-Leis A,Garcia-Ramos J V,Sanchez-Cortes S. Silver nanostars with high SERS performance[J]. The Journal of Physical Chemistry C,2013,117(15):7791-7795.
[17] Jena B K,Mishra B,Bohidar S. Synthesis of branched Ag nanoflowers based on a bioinspired technique:Their surface enhanced Raman scattering and antibacterial activity[J]. The Journal of Physical Chemistry C,2009,113(33):14753-14758.
[18] Lu H,Zhu L,Zhang C,et al. Highly uniform SERS-active microchannel on hydrophobic PDMS:A balance
of high reproducibility and sensitivity for detection of proteins[J]. RSC Advances,2017,7(15):8771-8778.
[19] Su J,Wang D,Nörbel L,et al. Multicolor gold-silver nano-mushrooms as ready-to-use SERS probes for ultrasensitive and multiplex DNA/miRNA detection[J]. Analytical Chemistry,2017,89(4):2531-2538.
[20] Ma S,Li Q,Yin Y,et al. Interference-free surface-enhanced Raman scattering tags for single-cell molecular imaging with a high signal-to-background ratio[J]. Small,2017,13(15):1603340.
[21] Cottat M,Lidgi-Guigui N,Tijunelyte I,et al. Soft UV nanoimprint lithography-designed highly sensitive substrates for SERS detection[J]. Nanoscale Research Letters,2014,9(1):623-629.
[22] Dai Z,Mei F,Xiao X,et al. “Rings of saturn-like”nanoarrays with high number density of hot spots for surface-enhanced Raman scattering[J]. Applied Physics Letters,2014,105(3):033515.
[23] Liu Z,Yan Z,Jia L,et al. Gold nanoparticle decorated electrospun nanofibers:A 3D reproducible and sensitive SERS substrate[J]. Applied Surface Science,2017,403:29-34.
[24] Song G,Zhou H,Gu J,et al. Tumor marker detection using surface enhanced Raman spectroscopy on 3D Au butterfly wings[J]. Journal of Materials Chemistry B,2017,5(8):1594-1600.
[25] Tanahashi I,Harada Y. Silver nanoparticles deposited on TiO2-coated cicada and butterfly wings as naturally inspired SERS substrates[J]. Journal of Materials Chemistry C,2015,3(22):5721-5726.
Copper Foil-Gold Nanoparticles Substrate for Surface-Enhanced Raman Scattering:Preparation and Application
He Zhimin1,Dai Yemei1,Zeng Chuan2,Zhao Wenbin1,Wang Mengfan1,Qi Wei1,Su Rongxin1
(1.School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China; 2.Technical Center of Zhuhai Entry-Exit Inspection and Quarantine Bureau,Zhuhai 519000,China)
Based on its high-sensitivity and simple sample preparation,surface-enhanced Raman scattering(SERS) has a wide application in food safety and environmental survey.To commercialize SERS,the key point is to develop a low-cost,simple,and convenient method to obtain a recyclable and high-quality SERS substrate.Therefore,a novel and cheap copper foil-gold nanoparticles(CuF-AuNPs)SERS substrate was fabricated by in-situ reduction of AuNPs on the rough surface of copper foil using nitric acid.The effect of nitric acid concentration on the surface roughness of copper foil and the effect of reduction time on the merits of the CuF-AuNPs substrate were investigated.The Raman scattering signal of Rhodamine B(RHb)under different concentrations was detected on CuF-AuNPs.A good linear(=1,492,+12,435,2=0.995)relationship was obtained between the characteristic peak intensity of RHb and its logarithmic concentration.The detection limit reached 1×10-8,mol/L,indicating that the CuF-AuNPs substrate exhibited remarkable potential and good sensitivity in qualitative and quantitative detection.The results of four-time-cycle detection of RHb under 1×10-6,mol/L exhibited a negligible difference,demonstrating a good reproducibility of CuF-AuNPs for Raman scattering detection.
surface-enhanced Raman scattering(SERS);in-situ reduction;substrate;Rhodamine B(RHb)
10.11784/tdxbz201803061
O657.37
A
0493-2137(2019)05-0501-07
2018-03-19;
2018-05-07.
何志敏(1963— ),男,博士,教授,enzyme@tju.edu.cn.
王梦凡,mwang@tju.edu.cn.
国家自然科学基金资助项目(21676191,21621004);珠海出入境检验检疫局科技计划项目资助(ZH2017-28).
the National Natural Science Foundation of China(No. 21676191,No. 21621004),the Technology Research Program of Zhuhai Entry-Exit Inspection and Quarantine Bureau(No. ZH2017-28).
(责任编辑:田 军)

