抑制JNK通路对Genistein诱导结肠癌SW620细胞周期阻滞的作用
郎慧玲 刘晟男 钱甜甜 曹玓 王钰粟 于佳琪 赵忠新 刘丹
[摘要] 目的 探讨染料木黄酮(Genistein,Gen)阻滞结肠癌细胞S期向G2/M期转换与JNK通路的关系。 方法 以人结肠癌SW620细胞为研究对象,实验分三个系列组,第一系列组为对照组和SP600125组(10 μmol/L、20 μmol/L、30 μmol/L、40 μmol/L),第二系列为对照组、Gen组(20 μmol/L、40 μmol/L、80 μmol/L)和联用组(Gen 40 μmol/L和SP600125 40 μmol/L),第三系列为对照组、Gen组(40 μmol/L)、SP600125组(40 μmol/L)和联用组。蛋白质印迹法筛选SP600125的最适工作浓度及Cyclin B1、P-Cdc2和Cdc2蛋白的表达。MTS法检测细胞增殖。 结果 SP600125的最适工作浓度为40 μmol/L。药物组的Cyclin B1(除Gen 20 μmol/L组)、P-Cdc2和Cdc2蛋白表达均显著下调(P<0.01),Cyclin B1蛋白表达随Gen剂量的增加而降低(P<0.01),联用组Cyclin B1明显低于Gen 40 μmol/L组(P<0.01),联用组P-Cdc2和Cdc2蛋白与Gen 40 μmol/L组的比较虽有降低的趋势,但差异无统计学意义(P>0.05)。抑制JNK通路可增强Gen抗SW620细胞增殖的作用。 结论 抑制JNK通路可通过减少结肠癌SW620细胞Cyclin B1-Cdc2的活化,阻滞细胞由S期进入G2/M期。
[關键词] 染料木黄酮;JNK;结肠癌;细胞周期
[中图分类号] R329 [文献标识码] A [文章编号] 1673-9701(2019)34-0026-05
Effect of inhibition of JNK pathway on Genistein-induced colon cancer SW620 cell cycle arrest
LANG Huiling1 LIU Shengnan1 QIAN Tiantian1 CAO Di1 WANG Yusu2 YU Jiaqi1 ZHAO Zhongxin3 LIU Dan1
1.Qiqihar Medical University, Qiqihar 161006,China;2.Harbin Medical University, Harbin 150081,China;3.Department of General Surgery, the First Affiliated Hospital of Qiqihar Medical University, Qiqihar 161041,China
[Abstract] Objective To investigate the relationship between genistein(Genstein, Gen)-induced colon cancer cell arrest from S phase into G2/M phase and JNK pathway. Methods Human colon cancer SW620 cells were used as the research object. The cells were divided into three series. The first series were the control group and the SP600125 group (10 μmol/L, 20 μmol/L, 30 μmol/L, 40 μmol/L). The second series were the control group, the Gen group (20 μmol/L, 40 μmol/L, 80 μmol/L) and the combination group(Gen 40 μmol/L and SP600125 40 μmol/L). The third series were the control group, the Gen group (40 μmol/L), the SP600125 group (40 μmol/L) and the combination group. Western blotting was used to screen the optimal working concentration of SP600125 and the expression of Cyclin B1, P-Cdc2 and Cdc2 proteins. Cell proliferation was detected by the MTS method. Results The optimum working concentration of SP600125 was determined as 40 μmol/L. The expression of Cyclin B1(except for Gen 20 μmol/L group), P-Cdc2 and Cdc2 protein in the drug group was significantly reduced(P<0.01). The expression of Cyclin B1 protein was decreased with the increase of Gen dose (P<0.01). The Cyclin B1 of the combination group was significantly lower than that of the Gen 40 μmol/L group (P<0.01). A decreasing trend of P-Cdc2 and Cdc2 proteins was found in the combination group compared with the Gen 40 μmol/L group, but the difference was statistical insignificant (P>0.05). The proliferation of Gen anti-SW620 cells was enhanced by the inhibition of JNK pathway. Conclusion Inhibition of JNK pathway can inhibit the activation of Cyclin B1-Cdc2 in colon cancer SW620 cells, block cells in S phase and prevent cells entering into G2/M phase.
[Key words] Genistein; JNK; Colon cancer; Cell cycle
结直肠癌(Colorectal cancer,CRC)是人类最常见的恶性肿瘤之一。在全球恶性肿瘤中,结直肠癌的发病率排名第三,死亡率排名第二[1];在中国恶性肿瘤中,结直肠癌的发病率排名第三,死亡率排名第五[2]。因此,结直肠癌的防治已成为癌症防治研究的热点。目前,肿瘤防治研究的方向聚焦于探索细胞信号通路与肿瘤发生发展的关系。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)是丝裂原活化蛋白激酶(Mitogen activated protein kinase,MAPK)信号通路的一个重要家族成员,在细胞增殖、细胞凋亡和细胞应激等多种生理或病理过程中担任重要角色,在癌症发展中同样起关键的调控作用。SP600125是一种JNK通路的强效抑制剂,可以抑制JNK活化,即抑制JNK磷酸化,发挥抑制JNK信号通路的作用。有研究证实,雌激素治疗可降低结直肠癌发病风险[3-5]。染料木黄酮(Genistein,Gen)是一种具有雌激素活性的天然物质,具有抗肿瘤功效。课题组前期研究[6]结果显示,抑制JNK通路能增强Gen诱导结肠癌SW620细胞S期阻滞作用,且S期细胞的增多主要源于G2/M期细胞的减少,因此本研究着眼于驱动G2/M期的关键因素——Cyclin B1-Cdc2复合物的活性,探讨上述S期细胞向G2/M期的转换受阻与该复合物活性的关系。现报道如下。
1 材料与方法
1.1材料来源
人结肠癌SW620细胞由哈尔滨医科大学遗传学研究室馈赠。Gen(批号:G6649-25 mg)和DMSO(批号:D5879-100 mL)为Sigma公司生产。RPMI 1640培养液(货号:SH30027.01,批号:AYA52774)为Hyclone公司生产。胎牛血清(货号:11011-8611, 批号:2017 0713)为杭州四季青公司生产。胰蛋白酶(批号:0458-25g)为Amresco公司生产。MTS(货号:G3582, 批号:0000044688)为Promega公司生产。SP600125(货号:sc-200635,批号:A2714)为Santa Cruz公司生产。T-JNK(JNK1/2/3)多克隆抗体(货号:YT2439,批号:B3901)、P-JNK(T183/Y185)多克隆抗体(货号:YP0157,批号:B6701)、Cdc2(Y15)多克隆抗体(货号:YT0789,批号:B8901)、P-Cdc2(T161)多克隆抗体(货号:YP0053,批号:B5301)和Cyclin B1多克隆抗体(货号:YT1169,批号:B6901)为Immunoway公司生产。β-actin多克隆抗体(货号:BA2305,批号:12cm81)为武汉博士德生物公司生产。辣根酶标记山羊抗兔IgG(货号:CW0103,批号:00111408)、哺乳动物蛋白抽提试剂盒(货号:CW08895,批号:50201)和BCA蛋白定量试剂盒(货号:CW0014,批号:00021303)为北京康为世纪生物公司生产,蛋白Marker(货号:26616-SM0671)为MBI公司生产,ECL超敏发光液(货号:P1010,批号:171206)为北京普利莱公司生产,NC膜为Pall公司生产。
1.2 实验仪器
CO2培养箱(美国Thermo-311);超净工作台;酶标仪(美国BIO-RAD 680);天能数码凝胶分析仪(Tanon-5200);电泳仪(北京六一仪器厂,DYY-10C);垂直平板电泳槽(上海天能仪器厂,VE-180A);转印槽(上海天能仪器厂,VE-186)。
1.3 实验方法
1.3.1 细胞培养 SW620细胞用含10% FBS的RPMI 1640培养液置于37℃、5% CO2培养箱中培养,待细胞贴壁至80%左右时,用胰蛋白酶消化,分瓶传代。实验分三个系列组,第一系列为SP600125(JNK抑制剂)有效剂量筛选组,分对照组、SP600125 10 μmol/L组、SP600125 20 μmol/L组、SP600125 30 μmol/L组和SP600125 40 μmol/L组;第二系列分对照组、联用组(Gen 40 μmol/L和SP600125 40 μmol/L)、Gen组(20 μmol/L)、Gen组(40 μmol/L)和Gen组(80 μmol/L);第三系列为对照组、Gen组(40 μmol/L)、SP600125组(40 μmol/L)和联用组。取状态良好的对数生长期细胞用于后续实验。
1.3.2 蛋白质印记法筛选JNK抑制剂的最适工作浓度 细胞以5×105个/孔接种于6孔板,培养24 h后,加入第一系列不同处理因素的培养液2 mL,处理6 h后,消化细胞,预冷PBS洗涤细胞2次,于冰上加入400 μL的蛋白抽提试剂,用枪头轻轻吹打细胞,将抽提液转移至EP管中,冰上裂解30 min,4℃ 14 000 g 离心10 min,小心转移上清液,并记录转移体积,此为抽提的细胞总蛋白。随后采用BCA 蛋白定量微孔检测法,将BSA标准品和待測蛋白样品各25 μL分别加入96孔板,每组设3个复孔,加入200 μL BCA工作液,混匀后,37℃孵育30 min,冷却至室温后,于自动酶标仪检测570 nm的吸光度值,绘制标准曲线,根据曲线计算待测样品的蛋白浓度,用5×上样缓冲液和细胞裂解液稀释,将待测样品蛋白浓度调整为2 μg/μL。然后100℃加热5 min,冷却后混匀,变性后的蛋白样品于-20℃保存。取各组样品蛋白30 μg上样,经SDS-PAGE电泳分离后,转移至NC膜上,封闭液封闭2 h,TBS洗涤3次,一抗P-JNK(1∶1 000)、T-JNK(1∶1 000)和β-actin(1∶400)4℃孵育过夜,TBST洗涤3次,HRP标记二抗室温摇床2 h,TBS洗涤2次,TBST洗涤1次,ECL发光,显影,定影,用Photoshop13.0软件分析目的蛋白的相对灰度值的差异。
1.3.3 蛋白质印记法检测G2/M期相关蛋白的表达 细胞以5×105个/孔接种于6孔板,培养24 h后,加入第二系列不同处理因素的培养液2 mL,处理24 h后,收集细胞,抽提细胞蛋白,然后用BCA蛋白定量微孔检测法进行蛋白定量,调整样品蛋白浓度为2 μg/μL,样品蛋白煮沸变性(过程同1.3.2)。取各组样品蛋白30 μg上样,经SDS-PAGE电泳分离后,转移至NC膜上,封闭液封闭2 h,TBS洗涤3次,一抗Cyclin B1(1∶1 000)、P-Cdc2(1∶1 000)、Cdc2(1∶1 000)和β-actin(1∶400)4℃孵育过夜,TBST洗涤3次,HRP标记二抗室温摇床2 h,TBS洗涤2次,TBST洗涤1次,ECL发光,于天能数码凝胶分析仪显影拍摄,并分析目的蛋白的相对灰度值的差异。
1.3.4 MTS法检测细胞增殖 细胞以8×103个/孔接种于96孔板,培养24 h后,加入第三系列不同处理因素的培养液150 μL,处理24 h后,加入MTS,每孔7.5 μL,继续孵育1~2 h,于酶标仪490 nm波长处检测每孔的吸光度值。
1.4 统计学方法
所有数据采用SPSS 22.0统计学软件进行统计分析,计量资料以均数±标准差(x±s)表示,组间均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
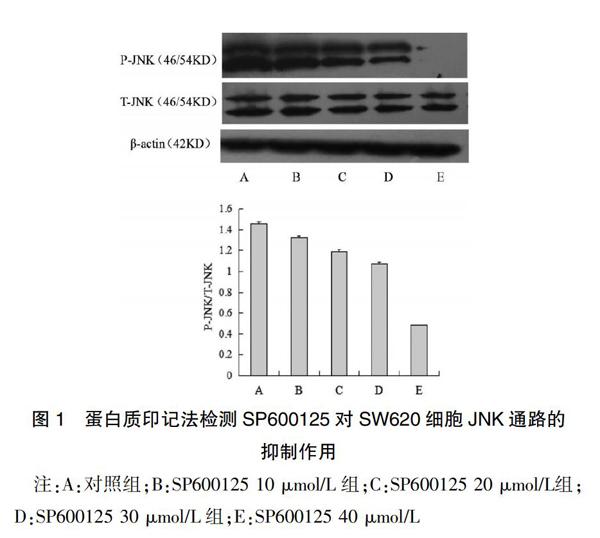
2.1 蛋白质印记法检测SP600125对SW620细胞JNK通路的抑制作用
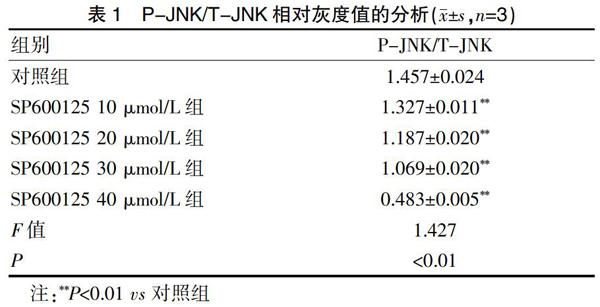
SP600125是一种强效的JNK通路抑制剂(图1)。与对照组相比,SP600125能明显阻断绝大部分P-JNK蛋白表达(P<0.01)的最适工作浓度为40 μmol/L。见表1。
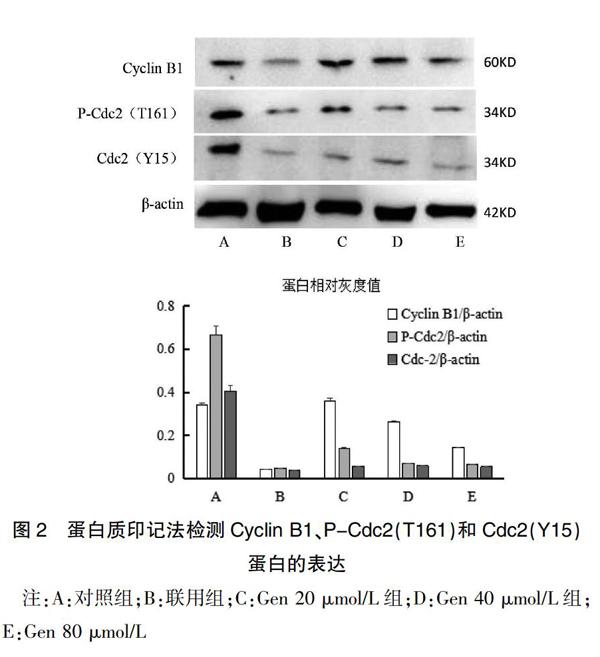
2.2 蛋白质印记法检测Cyclin B1、P-Cdc2(T161)和Cdc2(Y15)蛋白的表达
如图2所示,与对照组相比,除Gen 20 μmol/L组中的Cyclin B1外,其余药物组的Cyclin B1、所有药物组的P-Cdc2和Cdc2蛋白表达均显著下调(P<0.01),Cyclin B1呈现Gen剂量依赖(P<0.01),且联用组Cyclin B1明显低于Gen 40 μmol/L组(P<0.01)。P-Cdc2和Cdc2蛋白虽无明显Gen剂量依赖(P>0.05),但P-Cdc2蛋白在Gen 20 μmol/L和40 μmol/L之间有显著差异(P<0.01),联用组P-Cdc2和Cdc2蛋白与Gen 40 μmol/L组比较有降低的趋势,但差异无统计学意义(P>0.05)。见表2。
2.3 MTS法检测不同药物组对SW620细胞增殖的抑制作用
如图3所示,与对照组比较,所有药物组均有明显抑制SW620细胞增殖的作用(P<0.01),且联用组的抗增殖效果比Gen组和抑制剂组强(P<0.01,P<0.05)。见表3。
3 讨论
细胞周期分为G1期、S期、G2期和M期(有丝分裂期),只有连续、精准的细胞周期进程才能实现细胞增殖,因此细胞增殖改变的实质是细胞周期发生变化。在细胞周期中,细胞周期蛋白(Cyclin)和细胞周期蛋白依赖性激酶(CDK)是调控系统的核心[7]。Cyclin B属于G2/M期的关键细胞周期蛋白,调节G2期细胞向M期转换,其合成于S期晚期,M期达高峰,并随着M期的结束而降解,但其必须与CDK1(Cdc2)结合为成熟促进因子(MPF)的复合物,并当Cdc2第161位的苏氨酸残基(T161)磷酸化和第15位的酪氨酸残基(Y15)去磷酸化时,Cyclin B-Cdc2才被激活[8-10],发挥对细胞周期的正向调控作用。与正常细胞和组织相比,Cyclin B1在多种癌症中过表达,结直肠癌也不例外,有研究证实,88%结直肠癌组织存在Cyclin B1蛋白高表达,并与癌细胞高增殖率一致[11]。Cyclin B1还可以促进结直肠癌的发生和随后的淋巴结转移[12]。Cyclin的合成,与CDK的结合同时受到JNK通路的影响,JNK抑制剂预处理可阻断Cyclin B1的积累,即JNK失活阻断了细胞有丝分裂进程,抑制细胞增殖[13]。丙型肝炎病毒(HCV)蛋白通过JNK途径增加Cyclin B1-Cdc2复合物的活性。二烯丙基三硫醚(DATS)通过激活JNK通路诱导胃癌BGC-823细胞G2/M期阻滞,这与Cyclin A2和Cyclin B1的合成增加有关[14]。
Gen作为一种潜在的抗癌药物已被应用多年。Gen能通过诱导多种肿瘤细胞发生G0/G1期、S期和G2/M期阻滞[15-19],从而抑制癌细胞的增殖。本研究结果显示,抑制JNK通路能增强Gen下调SW620细胞Cyclin B1、P-Cdc2(T161)和Cdc2(Y15)蛋白表达的作用,其中Cyclin B1的变化最为显著,且Cyclin B1呈现Gen剂量依赖效应,与课题组前期研究Gen诱导SW620细胞S期阻滞主要源于S期进入G2/M期的细胞减少,且S期阻滞作用随Gen剂量的增加而增强[6]的结果相符,且抑制JNK通路能增强Gen抑制SW620细胞增殖的作用,这也与S期细胞阻滞作用增强和上调Cyclin B1-Cdc2蛋白的结果一致。但是,P-Cdc2(T161)和Cdc2(Y15)的下調作用并没有与Cyclin B1一样有较大幅度的降低,一般来说,Cyclin B1的合成增加可以刺激Cdc2在相应位点发生磷酸化和去磷酸化,它们并未同步的原因可能与细胞周期的其他调节机制有关。值得关注的是,负向调控细胞周期的关键因子被称为细胞周期蛋白依赖性激酶的抑制因子(CDKI)[7],该家族蛋白可以抑制Cyclin-CDK复合物的活性,使细胞周期受阻,p53和p21就是最常见的CDKI。另外,细胞周期检测点可监测细胞周期[20],使之有序进行,当检测点出现异常时,细胞周期因无法通过检测点而被停止,如DNA复制不完全、蛋白质合成和积累的不够充足等。当然,细胞周期还会受到细胞内外环境多种因素的刺激而发生变化,因此,细胞周期的调控是一个复杂的综合系统,细胞在此系统的调控下如何生存或是死亡,尚待进一步的研究。
[参考文献]
[1] Bray F,Ferlay J,Soerjomataram I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2018,68(6):394-424.
[2] 孙可欣,郑荣寿,张思维,等. 2015年中国分地区恶性肿瘤发病和死亡分析[J].中国肿瘤,2019,28(1):1-11.
[3] Park SY,Wilkens LR,Kolonel LN,et al. Inverse associations of dietary fifiber and menopausal hormone therapy with colorectal cancer risk in the Multiethnic Cohort Study[J]. Int J Cancer,2016,139(6):1241-1250.
[4] Rossi M,Negri E,Talamini R,et al. Flavonoids and colorectal cancer in Italy[J]. Cancer Epidemiol Biomarkers Prev,2006,15(8):1555-1558.
[5] Cotterchio M,Boucher BA,Manno M,et al. Dietary phytoestrogen intake is associated with reduced colorectal cancer risk[J]. J Nutr,2006,136(12):3046-3053.
[6] 赵忠新,郎慧玲,刘晟男,等. 抑制JNK通路对Genistein诱导人结肠癌细胞S期阻滞的影响[J]. 中国继续医学教育,2017,9(13):194-196.
[7] Malumbres M,Barbacid M. Cell cycle,CDKs and cancer:A changing paradigm[J]. Nat Rev Cancer,2009,9(3):153-166.
[8] 陈誉华. 医学细胞生物学[M]. 第5版. 北京:人民卫生出版社,2013:311-315.
[9] Coulonval K,Kooken H,Roger PP. Coupling of T161 and T14 phosphorylations protects cyclin B-CDK1 from premature activation[J]. Mol Biol Cell,2011,22(21):3971-3985.
[10] Cho NH,Kang S,Hong S,et al. Elevation of cyclin B1,active cdc2,and HuR in cervical neoplasia with human papillomavirus type 18 infection[J]. Cancer Lett,2006, 232(2):170-178.
[11] Wang A,Yoshimi N,Ino N,et al. Overexpression of cyclin B1 in human colorectal cancers[J]. J Cancer Res Clin Oncol,1997,123(2):124-127.
[12] Li JQ,Kubo A,Wu F,et al. Cyclin B1,unlike cyclin G1,increases significantly during colorectal carcinogenesis and during later metastasis to lymph nodes[J]. Int J Oncol,2003,22(5):1101-1110.
[13] Hsu CT,Huang YF,Hsieh CP,et al. JNK inactivation induces polyploidy and drug-resistance in coronarin D-treated osteosarcoma cells[J]. Molecules,2018,23(9):E2121.
[14] Jiang XY,Zhu XS,Xu HY,et al. Diallyl trisulfide suppresses tumor growth through the attenuation of Nrf2/Akt and activation of p38/JNK and potentiates cisplatin efficacy in gastric cancer treatment[J]. Acta Pharmacol Sin,2017,38(7):1048-1058.
[15] Zhang Z,Wang CZ,Du GJ,et al. Genistein induces G2/M cell cycle arrest and apoptosis via ATM/p53-dependent pathway in human colon cancer cells[J]. Int J Oncol,2013,43(1):289-296.
[16] Wang H,Li Q,Chen H. Genistein affects histone modifications on dickkopf-related protein 1(DKK1) gene in SW480 human colon cancer cell line[J]. PLoS One,2012, 7(7):e40955.
[17] Tang Q,Ma J,Sun J,et al. Genistein and AG1024 synergistically increase the radiosensitivity of prostate cancer cells[J]. Oncol Rep,2018,40(2):579-588.
[18] Tsuboy MS,Marcarini JC,de Souza AO,et al. Genistein at maximal physiologic serum levels induces G0/G1 arrest in MCF-7 and HB4a cells,but not apoptosis[J]. J Med Food,2014,17(2):218-225.
[19] 劉丹,赵忠新,迟大鹏,等. ERK1/2通路对Genistein与5-FU诱导的人肝癌细胞周期阻滞的影响[J].世界华人消化杂志,2014,22(15):2134-2139.
[20] Kastan MB,Bartek J. Cell-cycle checkpoints and cancer[J].Nature,2004,432(7015):316-323.
(收稿日期:2019-09-17)

