肝细胞生长因子对高糖诱导的腹膜纤维化的影响
修亦斌
[摘要] 目的 探讨外源性肝细胞生长因子(Hepatocyte Growth Factor,HGF)对腹膜纤维化的影响。 方法 将HPMCs通过胰蛋白酶消化法从大网膜组织中分离并实施原代培养。后取第三代HPMCs,并在不同葡萄糖浓度(5.5、30、60 mmol/L D-葡萄糖)环境下持续培养48 h后对FN蛋白、TGF-β1水平进行检测、比较,并在60 mmol/L葡萄糖溶液中加入不同浓度的rhHGF(25、50、100 ng/mL)检测FN蛋白、TGF-β1水平,检测方式以ELISA方式开展。 结果 (1)HPMCs在高糖环境下TGF-β1、FN蛋白水平均较N组明显增加(P<0.05),呈现剂量依赖关系(P<0.05);(2)外源性HGF可对HPMCs在TGF-β1、FN的表达产生抑制效果(P<0.05),呈现剂量依赖关系(P<0.05)。 结论 高糖环境有利于促进HPMCs的TGF-β1表达,同时促进HPMCs合成ECM;高糖诱导ECM过程可在外源性HGF影响下发生抑制,提示在腹膜纤维化过程中HGF具有抑制作用,为PD相关腹膜纤维化的预防及治疗提供理论依据。
[关键词] 高糖环境;人腹膜间皮细胞;肝细胞生长因子;纤维化
[中图分类号] R587.2;R572 [文献标识码] A [文章编号] 1673-9701(2019)34-0018-03
Effect of hepatocyte growth factor on peritoneal fibrosis induced by high glucose
XIU Yibin
Emergency Department, Zhongshan Hospital of Xiamen University, Xiamen 361004, China
[Abstract] Objective To explore the effect of exogenous hepatocyte growth factor(HGF) on peritoneal fibrosis. Methods HPMCs were isolated from the greater omentum issue by tryps in digestion, and primary culture was carried out. After that, the third-generation HPMCs were and cultured continuously for 48 hours at different glucose concentrations(5.5, 30, 60 mmol/L D-glucose) and FN protein and TGF-β1 levels were detected, in the 60 mmol/L glucose environment added with rhHGF of different concentrations(25, 50, 100 ng/mL) and FN protein and TGF-β1 levels were detected and compared by ELISA. Results (1)TGF-β1 and FN protein levels of HPMCs in the high glucose environment were significantly increased compared with those in the N group(P<0.05) and a dose-effect relationship was observed(P<0.05). (2)The expression of TGF-β1 and FN in HPMCs was inhibited by exogenous HGF (P<0.05), and a dose-effect relationship was observed(P<0.05). Conclusion High glucose environment promotes the expression of TGF-β1 and the synthesis of ECM in HPMCs. The process of high glucose inducing ECM can be inhibited under the influence of exogenous HGF, suggesting that HGF has an inhibitory effect in the process of peritoneal fibrosis, which provides theoretical basis for the prevention and treatment of PD related peritoneal fibrosis.
[Key words] High glucose environment; Human peritoneal mesothelial cells; Hepatocyte growth factor; Fibrosis
腹膜透析(Peritoneal dialysis,PD)為有效的终末性肾病肾脏替代治疗方法,与常规血液透析治疗相比,能使患者得到更高的生活质量[1]。但在腹膜透析长期治疗过程中可出现纤维化病变,对超滤治疗产生负性影响,增加超滤失败发生风险,因此发生溶质清除障碍,为PD治疗难以保持长期疗效的原因之一[2]。传统腹膜透析液(Peritoneal dialysis fluid,PDF)中含有葡萄糖降解产物(GDP)、低pH、乳酸盐缓冲液、高糖等不相容生物成分,为腹膜损伤、腹膜纤维化的重要原因[3]。
目前在腹膜纤维化发生原因研究中,已经明确证实PMCs的EMT为诱发腹膜纤维化关键过程,且由TGF-β介导EMT触发并维持[4]。而HGF可在TGF-β1所致的纤维化作用中,具有特异性对抗作用,因此在慢性纤维化发生机制中HGF和TGF-β1之间的平衡起到决定性作用[5]。但目前在腹膜纤维化的HGF相关因素研究较少。本次在探讨高糖环境下rhHGF对原代培养的HPMCs是否存在TGF-β1表达影响,以及是否可抑制HPMCs的EMT、ECM产生,以为防治PD相关腹膜纤维化提供新思路。
1 资料与方法
1.1 一般资料
1.1.1 试剂 人FN ELISA试剂盒;人TGF-β1 ELISA试剂盒;重组人HGF;即用型兔抗人波形蛋白多克隆抗体,即用型兔抗人细胞角蛋白多克隆抗体,即用型鼠抗人白细胞CD45抗体;双抗(青霉素-链霉素)。
1.1.2 仪器 DU650紫外分光光度计;ELXSOO型酶标仪;UVIPRO凝胶成像系统;Olympus1×50倒置显微镜;凝胶电泳仪;HERA cell CO2培养箱。
1.2 方法
1.2.1 细胞原代培养 选择期腹部手术治疗患者无菌大网膜为细胞培养对象,面积约15 cm2,排除尿毒症、恶性肿瘤患者;将网膜组织消化、离心、重悬细胞,并接种于培养瓶中静置培养。之后进行HPMCs传代培养,培养至第二代时,以EliVision TM二步法(非生物素即用型)进行免疫组织化学染色鉴定,显色选DAB,免疫组化染色对象为抗人波形蛋白、抗人CD45、抗第Ⅷ因子、抗人角蛋白等;持续细胞原代培养,至第三代后,进行试验研究。
1.2.2 细胞分组 不同葡萄糖浓度组:培养液GLU终浓度为5.5 mmol/L作为正常对照组(N组)。GLU终浓度为30 mmol/L、60 mmol/L的培养液为G30、G60组。
HGF干预组 G60组:选浓度为60 mmol/L的葡萄糖新鲜培养液作为干预对照组。分别另加入rhHGF终浓度为25 ng/mL、50 ng/mL、100 ng/mL为H25、H50、H100组,持续培养48 h后,收集上清至冷冻管中,并放置在-80℃冰箱中保存、待检。
1.2.3 FN和TGF-β1的蛋白质含量测定 收集的细胞培养上清液,细胞消化后计数,采用ELISA法检测蛋白质含量,先使用标准品建立标准曲线,经稀释、温育、洗板、显色、终止等步骤,450 nm波长依序测定各孔吸光度,根据样品吸光度在标准曲线上得出相应浓度,用细胞数校正,计算每105个细胞分泌的蛋白量。
1.3 统计学方法
数据计算统计选用SSPS17.0进行处理;计量资料(指标水平等)均以均数±标准差(x±s)表示,若多组间均数比较则以单因素方差分析(one-factor ANOVA)进行;组间显著性分析采用LSD-t法行两两比较;若方差不齐,以Kruskal-Wallis H检验多组间均数比较,方差齐性检验以Levene法进行;以Mann-Whitney U检验行组间两两比较;α=0.05,P<0.05提示组间比较存在统计学差异。
2 结果
2.1 细胞培养、鉴定
2.1.1 细胞生长情况 原代消化下细胞初始生长形态为梭形成纤维细胞(封三图1);后逐渐融合为单层,倒置相差显微镜下呈现“铺路石样”典型细胞外观(封三图2)。以上细胞生长特点与文献报道中腹膜间皮细胞特点相符合。
2.1.2 免疫组织化学染色及鉴定 免疫组化显示,第二代HPMCs中表达为阴性的为白细胞CD45抗原、第Ⅷ因子相关抗原,表达为阳性的为波形蛋白抗原、角蛋白。
2.2清液中FN、TGF-β1的含量
绘制标准曲线,曲线横坐标线标注浓度(对数坐标),纵坐标为检测出OD值,依据曲线方程计算出样品浓度后进行统计分析。
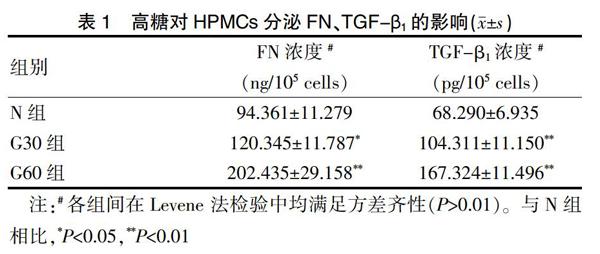
2.2.1 高糖对人腹膜间皮细胞分泌FN、TGF-β1的影响 FN、TGF-β1分泌浓度在不同葡萄糖培养环境下存在统计学差异,见表1。
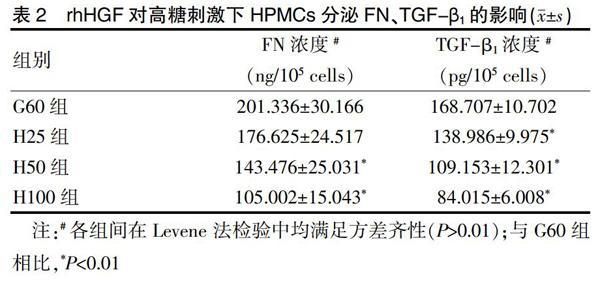
2.2.2 高糖环境下人腹膜间皮细胞在HGF影响下对FN、TGF-β1分泌的影响 FN、TGF-β1的分泌浓度在不同浓度rhHGF影响下存在显著差异,呈现剂量依赖关系,见表2。
3讨论
腹膜由具有上皮细胞特性的单层PMCs所覆盖,PMCs对于腹膜结构与功能的稳定和维持具有重要作用[6]。体外培养中,PMCs与腹膜间皮干细胞免疫组化标记相同,因此在进行细胞活力、细胞增殖能力、细胞蛋白合成等细胞功能研究中,采用体外培养的PMCs可作为细胞模型实施不同因子及刺激细胞功能影响研究。本次研究细胞均为人健康大网膜细胞,通过胰蛋白酶消化法获取。显微镜下显示,获取的健康大网膜细胞初始形态为梭形纤维样,后逐渐生长、融合,形成单层、大小结构相似的多边形细胞结构,倒置显微镜下,获取试验细胞出现椭圆铺路石样典型细胞结构,其形态特征与相关文献报道中腹膜间皮细胞相符[7],并在免疫組织化学染色后证实细胞纯度高。
PD已被证明是ESRD患者有效的肾替代治疗方法,维持长期腹膜透析的基础为保持腹膜功能与结构稳定性[8],而经长期PD治疗的患者极易发生纤维化,对超滤效果具有显著负性影响,增加治疗失败发生风险,最终需退出腹膜透析治疗。目前认为腹膜长期暴露于生物相容性较差的腹膜透析液中,为引发腹膜纤维化的主要原因,可因此发生血管病变、腹膜纤维化、腹膜损伤、新生血管生成等[3]。我国目前普遍选用渗透剂为葡萄糖的商用PDF治疗,而目前认为高浓度葡萄糖是腹膜纤维化及增厚重要始动因子[9]。
目前腹膜纤维化发生机制仍未完全明确,但相关研究显示,腹膜纤维化发生发展过程中,PMCs的EMT起到关键作用[10]。成纤维细胞大量增殖代表了组织纤维化的发生,目前认为它们主要来源于经过EMT的PMCs[11]。目前仍不清楚EMT分子机制,但有证据证实诱导EMT关键介质为TGF-β1[12]。TGF-β1家族是一种多功能的细胞因子,在不同器官组织纤维化中均积极参与,同时被认为其是腹膜高糖环境下发生纤维化的关键诱导因子[13]。有研究[14]用TGF-β1刺激体外培养的HPMCs后发生EMT。本实验结果显示,体外培养的HPMCs在高糖的刺激下,TGF-β1、FN蛋白水平的表达量明显增加,并且与葡萄糖的浓度呈正相关,FN是ECM的主要结构成份,说明HPMCs在高糖的刺激下发生了EMT, ECM的合成能力增强,促进腹膜纤维化的发生,提示HPMCs可能在TGF-β1的诱导下发生了EMT及ECM表达增加。
随着对腹膜纤维化分子机制认知的增加,腹膜纤维化新的预防治疗策略为针对确切分子通路干预,包括阻断TGF-β1信号传导通路、抑制TGF-β1表达[15]、抑制阻断及其诱导的EMT[16-17]、改进PDF的生物不相容性(以其他渗透剂替代葡萄糖)以改善PD相关腹膜纤维化。相关研究表示,抗纤维化主要内在因子为HGF,能够对抗TGF-β1导致的纤维化进程,延缓或阻止器官组织纤维化形成[18],包括肾间质纤维化[19]。
目前在腹膜纤维化发生发展中关于HGF影响报道较少,但我们发现,部分腹膜透析治疗患者在非生理性腹膜透析液长期暴露下仍可保持相对稳定,说明机体自身存在能够对抗致纤维化因子刺激的保护系统,其中HGF为机体保护系统中重要组成成分。HGF由HPMCs合成,但在高糖环境下HPMCs合成能力下降,使HGF产物含量下降,说明机体存在抗腹膜纤维化系统,但受高糖环境刺激下抑制能力减弱,为腹膜纤维化主要成因之一[20]。
本次研究中,在加入不同浓度的外源性rhHGF后,在高糖环境培养下HPMCs的FN、TGF-β1水平均明显抑制(P<0.05),说明外源性rhHGF能够抑制HPMCs的EMT及ECM合成上调,从而起到抗腹膜纤维化的作用。
综上所述,含有高葡萄糖浓度PDF可诱导HPMCs TGF-β1表达上调,使HPMCs发生EMT,进而使ECM合成能力增强,为PD发生腹膜纤维化主要机制之一。HGF为存在于体内的抗纤维化因子,外源补充后可抑制腹膜纤维化发生发展过程,达到预防、延缓腹膜纤维化形成效果。但因腹膜纤维化发生、发展过程较为复杂,存在众多细胞因子及炎性因子相互影响、相互作用,出现不同信号通路间相互抑制、相互调节;HGF生物学活性广泛,可在不同类型细胞及分子机制细胞中以不同抑制机制降低纤维化发生率。但在抑制腹膜纤维化形成过程中HGF作用机制及PD动物模型及患者中腹膜纤维化影响效果仍需进一步研究。
[参考文献]
[1] 中国腹膜透析相关感染防治专家组. 腹膜透析相关感染的防治指南[J]. 中华肾脏病杂志,2018,34(2):139-148.
[2] 郭淑婷,唐阁,李维.腹膜透析致腹膜纤维化的发生机制及其防治的研究进展[J].辽宁中医杂志,2018,45(3):651-653.
[3] 师红红,王利华. 腹膜透析相关性腹膜纤维化防治的研究进展[J]. 国际移植与血液净化杂志,2017,15(6):13-18.
[4] Strippoli RM-VR,Battistelli C,Cicchini C,et al. Molecular mechanisms underlying peritoneal EMT and fibrosis[J].Stem Cells Int,2016,2016:3543678.
[5] 陈建泉,张建成,陈林,等. 肝细胞生长因子和转化生长因子-β1对人心房成纤维细胞基质金属蛋白酶-2及组织抑制剂-2表达的影响[J]. 中华心律失常学杂志,2017,21(6):489-495.
[6] 陈续红. 腹膜透析腹膜失功能的防治[J]. 中国血液净化,2015,14(9):512-514.
[7] 李相友,伍军,罗丹,等. 高糖腹膜透析液对人腹膜间皮细胞NLRP3-IL-1β的影响[J]. 北京大学学报:医学版,2017(49):960.
[8] 中国腹膜透析置管专家组. 中国腹膜透析置管指南[J]. 中华肾脏病杂志, 2016, 32(11):867-871.
[9] 聂振禹,洪梦琪,包蓓艳,等.高糖腹膜透析液对HPMECs中GLUT1、SGLT1、TGF-β1、VEGF-A、CTGF表达的影响研究[J].浙江医学,2017,39(8):606-609,613.
[10] Xiang S,Li M,Xie X,et al. Rapamycin inhibits epithelial to-mesenchymal transition of peritoneal mesothelium cells through regulation of Rho GTPases[J]. Febs J,2016, 283:2309-2325.
[11] 赵俊丽,邵霞,闵丹燕,等. 姜黄素对高糖腹膜透析液作用下人腹膜间皮细胞转分化的影响[J]. 中国中西医结合肾病杂志,2018,19(12):10-14.
[12] 白寿军,王亚琨,高聪普,等. Par6对TGF-β1诱导的肾小管上皮-间充质转分化的影响[J]. 中华肾脏病杂志,2016,32(8):626-627.
[13] 刘晶,朱微,蒋春明,等. 低密度脂蛋白受体表达失调在高糖腹膜透析液诱导腹膜纤维化中的作用[J]. 中华肾脏病杂志,2018,34(6):432-438.
[14] Wang S,DeNichilo M,Brubaker C,et al. Connective tissue growth factor in tubulointerstitial injury of diabetic nephropathy[J]. Kidney Int,2001,60:96-105.
[15] 史伟文,熊燕移,李敏芝,等.褪黑素通过调节TGF-β1/Smad通路抗腹膜透析相关性腹膜纤维化[J].中国临床研究,2017,30(5):626-630.
[16] 李歸雁,张莉. 腹膜透析相关性腹膜纤维化的机制[J]. 现代医学,2017(8):129-134.
[17] 潘晶,章科娜,柴可夫,等.基于SIRT1/TGF-β1/Smad通路研究三七皂苷对高糖诱导的大鼠肾小管上皮细胞EMT的影响[J].浙江中医药大学学报,2018,42(4):259-265,282.
[18] Xu J,Yu TT,Zhang K.HGF alleviates renal interstitial fibrosis via inhibiting the TGF-beta 1/SMAD pathway[J].European Review For Medical And Pharmacological Sciences,2018,22:7621-7627.
[19] 王子杰. 肾微血管内皮细胞转分化在移植肾间质纤维化形成中的作用及肝细胞生长因子的干预研究[D].南京医科大学,2018.
[20] Isabelle Matte,Perrine Garde-Granger. Ascites from ovarian cancer patients stimulates MUC16 mucin expression and secretion in human peritoneal mesothelial cells through an Akt-dependent pathway[J].BMC Cancer,2019, 19(1):406-410.
(收稿日期:2019-09-24)

