fullPIERS预测模型在398例子痫前期人群中的外部确认
彭兰,吴晓,康燕,姚仪倩,洪湘兰
妊娠期高血压疾病是常见的妊娠并发症,是一种妊娠期特有复杂的多器官功能损害的疾病,是孕产妇死亡的第二大原因[1]。其发病率在我国为9.4%,外国为5%~8%,孕产妇死亡率达7.7/10万[2]。子痫前期(pre-eclampsia,PE)作为妊娠期高血压疾病中一种较严重的类型,与许多不良妊娠结局相关,如抽搐、肝破裂,甚至孕产妇和围生儿死亡,减少由PE导致的不良妊娠结局符合联合国千年发展计划要求[3-7]。PE唯一的治愈方法是终止妊娠,尤其在早发型重度PE中,期待治疗常用于改善围生儿结局,然而期待治疗过程中孕产妇及围生儿的风险是未知的[8]。
目前尚无全球公认的关于PE孕妇发生不良妊娠结局的风险评估工具,常用的是根据以专家观点为基础的指南来指导临床工作,但现有指南并没有针对预测不良妊娠结局的相关指导。2011年von Dadelszen等[9]研究探讨fullPIERS模型预测PE孕妇入院48 h内发生不良妊娠结局的可能性,该模型由国际多中心的回顾性研究构建并内部确认(构建模型的机构内进行的模型确认),通过最终评估有6个预测因子纳入模型:孕周、胸痛/呼吸困难、血氧饱和度(SPO2)、血小板计数、谷草转氨酶和肌酐。尽管fullPIERS模型已完成了研究者内部确认,但仍存在一定的缺陷[10],且临床适用性亦未得到证实。有待进一步研究对fullPIERS模型进行外部确认(在其他中心根据该模型进行确认),以概括性评估该模型[11]。
1 资料与方法
1.1 一般资料回顾性研究2014年1月—2015年12月苏州市立医院收治的具有完整病史资料的PE孕妇共398例。纳入标准:①PE,血压≥140/90 mmHg(1 mmHg=0.133 kPa)、24 h尿蛋白≥0.3 g或孕妇终末器官受损;②HELLP综合征,溶血、肝酶升高、血小板减少、有/无高血压和蛋白尿;③妊娠期高血压(血压≥140/90 mmHg、尿蛋白阴性)相关的胎儿生长受限(估计胎儿体质量低于第十百分位数);④慢性高血压合并PE,慢性高血压的孕妇妊娠期血压进一步增高,蛋白尿出现或加重)。排除标准:①胎儿窘迫或母体并发症入院后需要立即终止妊娠者;②已知的致死性胎儿畸形;③孕妇存在基础疾病,如糖尿病、血液病、肝肾疾病和心肺疾病等。
1.2 研究方法根据fullPIERS模型的6个预测因子,搜集所有纳入研究的398例PE孕妇病史资料中该6项数据,采用入院48 h内的最差值作为最终数据代入模型方程(https://pre-empt.bcchr.ca/monitoring/fullpiers)logit(pi)=2.68+(-5.41×10-2;分娩孕龄)+1.23(胸痛或呼吸困难)+(-2.71×10-2;肌酐)+(2.07×10-1;血小板)+(4.00×10-5,血小板2)+(1.01×10-2;谷草转氨酶)+(-3.05×10-6;谷草转氨酶2)+(2.50×10-4;肌酐×血小板)+(-6.99×10-5;血小板×谷草转氨酶)+(-2.56×10-3;血小板×SPO2),计算不良妊娠结局的预测概率,以百分比表示。最常见的缺失数据为SPO2,这与最初建模研究时相似,鉴于临床未测定SPO2提示临床状况稳定,正常SPO2范围95%~100%,故缺失时均采用97%代入计算。
不良妊娠结局的限定与构建fullPIERS模型的原始研究制定的复合不良妊娠结局基本一致,但本研究将死胎和疗病性人工流产也纳入了不良妊娠结局。HELLP综合征所导致的并发症也作为不良妊娠结局,而并非HELLP综合征本身。
1.3 统计学方法采用SPSS 21.0软件进行数据分析。定量资料采用Kolmogorov-Smirov检验对其进行正态性检验,符合正态分布的数据采用均数±标准差(±s)表示,组间比较采用两独立样本均数的t检验;非正态分布的数据采用中位数和四分位数[M(P25,P75)]表示,组间比较采用 Mann-Whitney U 检验。定性资料用率表示,组间比较采用卡方检验。P<0.05为差异有统计学意义。分别以入院48 h内和2~7 d内fullPIERS模型预测不良妊娠结局情况绘制受试者工作特征曲线(receiver operating characteristic curve,ROC 曲线),并计算ROC曲线下面积(area under curve,AUC),以此评估预测模型的准确性和区分度(discrimination);采用H-L拟合优度检验评价模型的校准度(calibration,反映模型预测风险与实际发生风险的一致程度),并绘制散点图显示预测模型与实际情况的一致性;采用分层表格体现模型对研究人群的分层能力。
2 结果
2.1 发生不良结局和未发生不良结局PE孕妇各项指标比较在纳入研究的398例PE孕妇中,67例(16.8%)孕妇发生了不良妊娠结局,其中41例(10.3%)发生于入院48 h内,21例(5.3%)发生于入院2~7 d,5例(1.3%)发生于入院7 d后。发生不良妊娠结局孕妇的年龄、孕次、收缩压、谷草转氨酶水平、肌酐水平和产后出血量均高于未发生不良妊娠结局孕妇,入院时孕龄、分娩时孕龄、血小板及新生儿出生体质量均低于未发生不良妊娠结局孕妇,差异有统计学意义(均P<0.05)。舒张压和入院至分娩间隔差异无统计学意义(P>0.05)。见表1。
在不良妊娠结局中,最常见的是血制品输注(主要为血浆,34例),其余依次为死胎和疗病性人工流产(11例)、胎盘早剥(7例)、产科出血(7例)、肺水肿(3例)、肾功能衰竭(3例)以及3种药物及以上联合降压(2例)。以下在原始fullPIERS建模研究中所定义的并发症在本次研究中未发现:Glaszgow昏迷评分<13分,抽搐,皮质盲,升压药物维持血压,心肌缺血/梗死,气管插管,肝破裂,子宫切除。
2.2 fullPIERS模型对PE孕妇入院48 h内和2~7 d内发生不良妊娠结局的预测价值fullPIERS模型预测PE孕妇入院48 h内发生不良妊娠结局的AUC为 0.855(95%CI:0.782~0.928,P<0.001),最佳截断值2.25%时,敏感度、特异度、阳性预测值(PPV)和阴性预测值(NPV)分别为 78.0%(32/41)、80.1%(286/357)、31.1%(32/103)和 96.9%(286/295)。fullPIERS模型预测PE孕妇入院2~7 d内发生不良妊娠结局的 AUC 为 0.826(95%CI:0.727~0.925,P<0.001),最佳截断值2.65%时,敏感度、特异度、PPV和NPV分别 为 81.0%(17/21)、82.8%(312/377)、20.7%(17/82)、98.7%(312/316)。见图 1。
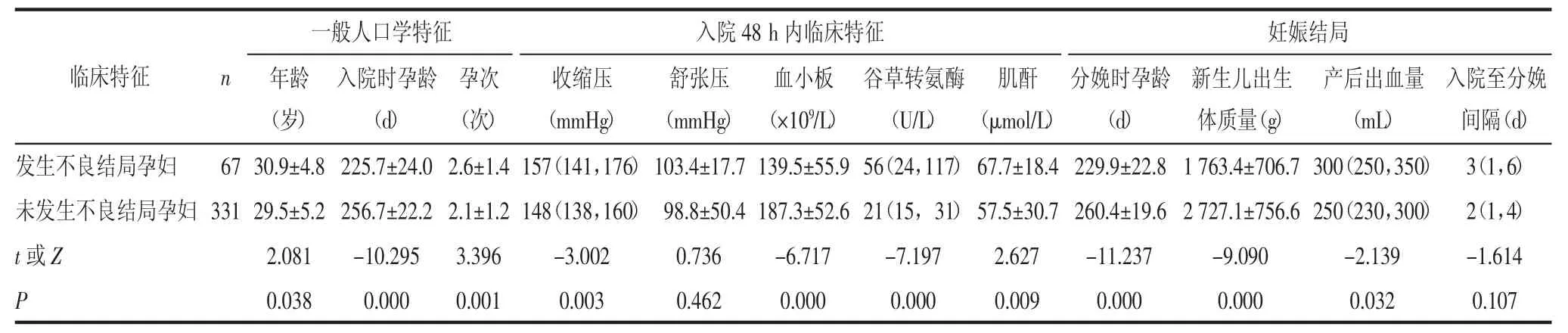
表1 发生不良结局和未发生不良结局PE孕妇各项指标比较

图1 fullPIERS模型预测48 h内和2~7 d内PE孕妇发生不良妊娠结局的ROC曲线
2.3 fullPIERS模型对PE孕妇的分层能力建模时根据预测概率分层划分,将PE孕妇分为低危组(预测概率<2.5%,n=306)和高危组(预测概率≥10%,n=16)。低危组中11例在入院48 h内发生不良妊娠结局,阴性预测值为96.4%;4例在入院2~7 d内发生不良妊娠结局,阴性预测值为98.7%。高危组中14例在入院48 h内发生不良妊娠结局,阳性预测值为87.5%;2例在入院2~7 d内发生不良妊娠结局,阳性预测值为12.5%。见表2。
2.4 fullPIERS预测模型的校准度fullPIERS模型预测PE孕妇入院48 h内发生不良妊娠结局时校准度较好(χ2=6.431,P=0.599);预测入院 2~7 d 内发生不良妊娠结局时校准度较差(χ2=36.778,P=0.000)。
分别根据入院48 h内和2~7 d内实际观测值和模型预测值绘制散点图,并拟合线性趋势线,标准曲线表示模型预测值和实际观测值相同。结果表明,fullPIERS模型预测PE孕妇入院48 h内发生不良妊娠结局的校准曲线和标准曲线接近,提示模型对其具有较好的校准能力。见图2。
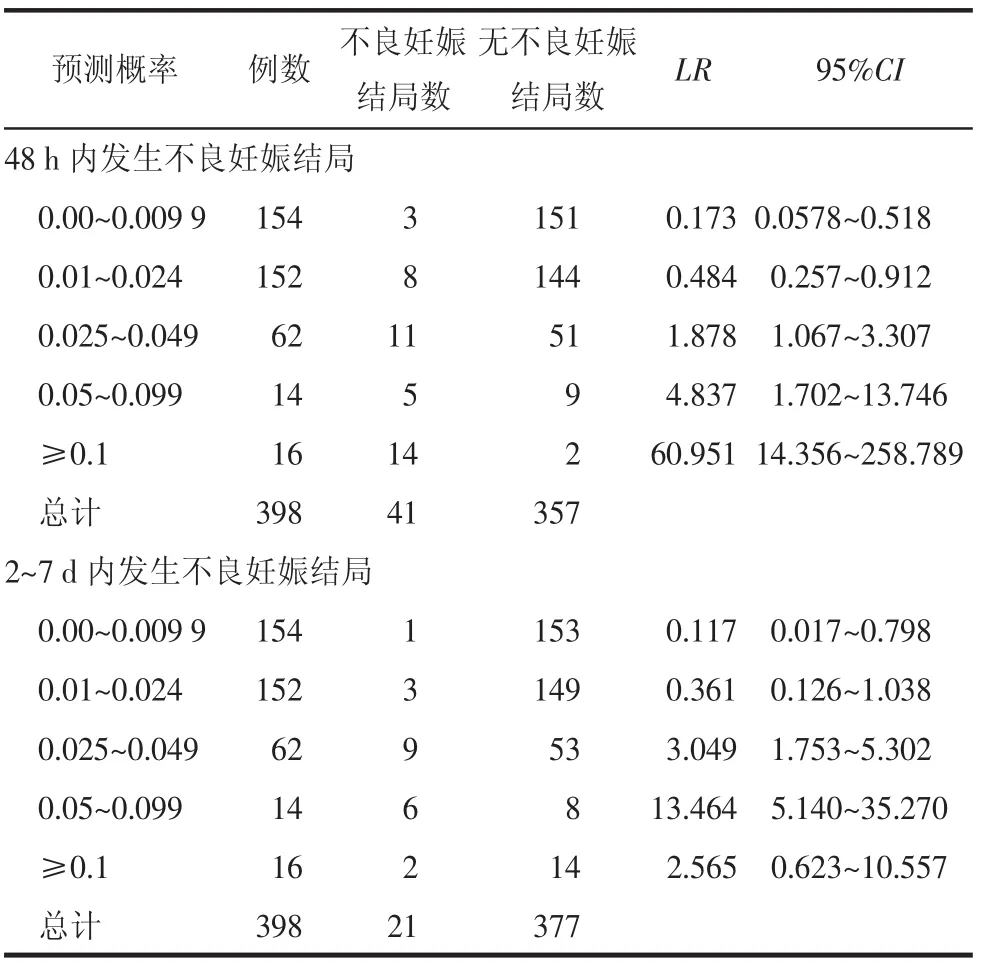
表2 fullPIERS模型预测48 h和2~7 d内发生不良妊娠结局的分层能力
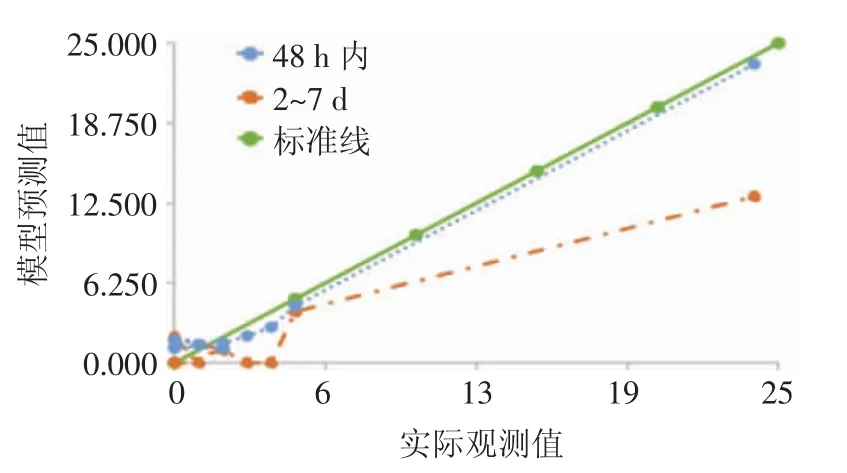
图2 fullPIERS模型预测48 h内和2~7 d内PE孕妇发生不良妊娠结局的模型散点图
3 讨论
本研究在单中心PE人群中对fullPIERS模型进行了外部确认。首先,在纳入研究的398例PE孕妇中,fullPIERS模型显示出优异的预测能力,尤其是预测入院48 h内发生不良妊娠结局的能力(AUC=0.855,95%CI:0.782~0.928) 与原始建模研究时的预测能力(AUC=0.88,95%CI:0.84~0.92)相似;预测入院2~7 d内发生不良妊娠结局的能力(AUC=0.826,95%CI:0.77~0.92)优于原始建模研究(AUC=0.77,95%CI:0.45~1.00)。其次,在本研究中fullPIERS模型显示了良好的分层能力,可以同时作为“纳入标准”(高危组具有高PPV)和“排除标准”(低危组具有高NPV)。最后,fullPIERS模型在本研究PE人群的外部确认中,预测入院48 h内的不良妊娠结局时校准度良好,但预测入院2~7 d内发生不良妊娠结局校准度较差,提示模型在原始研究数据中存在过适现象。除了本研究,国外亦有对fullPIERS模型外部确认的研究证实该模型对PE相关不良妊娠结局具有优秀的预测能力,结论与本研究一致[12-14]。
本研究一个显著的特点在于fullPIERS模型预测PE人群发生不良妊娠结局具有较高的NPV。这可以帮助临床医生筛选入院48 h内发生不良妊娠结局风险低的重度PE孕妇,尤其是早发型重度PE,继续期待治疗促进胎肺成熟或宫内转运,改善围生儿结局[8]。
本研究不良妊娠结局的发生率为16.8%,比fullPIERS原始建模研究的发生率(13%)略高。由于本研究定义的不良妊娠结局除原始研究中限定的母体不良结局以外,还包含了围生儿不良结局。既往研究显示,不良妊娠结局中死胎较常见[15-16]。另一项研究显示,fullPIERS模型具有预测围生儿不良结局的能力[17]。因此,本研究将围生儿死亡和疗病性人工流产作为不良妊娠结局。
本研究的局限性首先为样本量较小,复合不良妊娠结局的发生率相对较低,导致PPV较低。这与建模研究结果相似,在预测某些罕见并发症如子痫、皮质盲时敏感性较差。其次,本研究中研究对象的纳入标准与建模研究具有一定的同质性。作为一个预测模型的外部确认,第一步是选取与建模人群纳入标准相同的外部人群进行评估以纠正原始研究中的过适现象,第二步则要在同一诊断下选择不同纳入标准和患者特征的人群进行准确度和校准度的评估。因此今后的研究应进一步在不同特征人群中开展fullPIERS模型的外部确认。再次,本研究将所有的并发症合并作为单一的研究终点,目前尚无法通过预测模型预测某一特定并发症的发生风险。将来是否可以借鉴fullPIERS模型,创建基于本地高血压人群的不良妊娠结局预测模型,甚至开发能够细化到每个常见并发症发生风险的预测模型;最后,本研究并未进一步深入探讨将fullPIERS模型应用于临床后对妊娠结局的影响,今后将继续开展该方面的随机队列研究以实现该模型的临床价值。
总之,fullPIERS模型对本地单中心PE人群入院48 h内发生不良妊娠结局的预测能力较好,同时具有良好的分层能力和校准度。因此,fullPIERS模型可以作为PE患者的入院常规评估手段,协助临床医生制定个体化的治疗策略。

