早发型子痫前期胎盘细胞侵袭相关信号通路表达及其交互作用的研究
杜曲晓,刘贝贝
子痫前期是较为常见的妊娠期疾病之一,发生于孕34周前称为早发型子痫前期,严重时可威胁母胎生命[1]。目前对于子痫前期的发病机制尚无统一结论,但大部分研究认为其与血管内皮细胞损伤、滋养细胞浸润异常等有关[2-3]。Notch和Wnt信号通路是参与细胞增殖、生长、凋亡、迁移及侵袭的常见信号通路,据报道相关基因的异常表达与多种肿瘤相关[4-5]。由于滋养层细胞通过侵入子宫肌层建立胎盘血管网的过程与肿瘤细胞侵袭特性较为相似,因此推测子痫前期患者胎盘中存在Notch或Wnt信号通路关键分子的异常表达。目前关于早发型子痫前期与Notch和Wnt信号通路相关性的研究尚不多见,关于两个信号通路的交互作用尚无明确结论。因此,本研究拟通过检测早发型子痫前期患者胎盘Notch信号通路相关因子(Notch1、Jagged1)和Wnt信号通路相关因子[Wnt1、β 连环蛋白(β-catenin)]的表达情况,探讨Notch及Wnt信号通路在其进展中的作用以及可能的交互关系,为子痫前期进一步的分子学诊疗研究提供一定基础。
1 对象与方法
1.1 研究对象收集2016年6月—2017年12月于郑州人民医院妇产科就诊的早发型子痫前期患者176例为病例组,其中轻度子痫前期(轻度组)102例、重度子痫前期(重度组)74例。纳入标准应符合《妊娠高血压疾病诊治指南(2015)》[6]中子痫前期的诊断标准:孕20~34周时出现舒张压≥90 mmHg(1 mmHg=0.133 kPa)和(或)收缩压≥140 mmHg,伴 24 h蛋白尿≥0.3 g为轻度子痫前期;舒张压≥110 mmHg和(或)收缩压≥160 mmHg,伴24 h蛋白尿≥2.0 g为重度子痫前期。排除标准:多胎妊娠、死胎者;合并其他妊娠疾病、原发性高血压、心脏病或肝肾疾病史者。所有患者均接受硫酸镁治疗(剂量15~20 g/d,静脉滴注)及降压治疗。随机收集同期正常产检并在我院分娩的健康孕妇60例作为对照组。所有研究对象对本研究知情同意,且本研究经我院伦理审查委员会批准同意。
1.2 研究方法孕妇分娩出胎盘后,取母面中央小块组织,一部分液氮封存用于蛋白检测,另一部分漂洗后置入10%甲醛固定24~48 h,而后常规石蜡包埋、切片用于HE染色和免疫组织化学(免疫组化)实验。取一部分切片进行HE染色:脱蜡入水分别加入苏木精和伊红,冲洗后脱水封片,在显微镜下观察组织形态。另一部分切片采用免疫组化检测组织中Notch1及Wnt1表达强度:切片脱蜡后洗涤,加入封闭剂后滴加一抗(小鼠抗人Notch1及小鼠抗人Wnt1),室温反应10 min,加入二抗(辣根过氧化物酶标记的山羊抗小鼠),37℃反应20 min,而后洗涤,DAB显色苏木精复染,脱水封片后显微镜下观察阳性细胞数量,每视野内阳性细胞数少于5%为阴性表达(-),5%~25%为弱阳性(+),26%~50%为中阳性(++),超过 50%为强阳性(+++)。
取液氮封存的胎盘组织样本解冻,通过Western blotting检测蛋白Notch1、Jagged1、wnt1及β-catenin的表达。研磨组织至匀浆并加入细胞裂解液,4℃下12 000×g离心30 min,取上清液,加入提取缓冲液提取总蛋白,测定蛋白浓度,而后设置好胶槽,加电泳缓冲液,上样、电泳、转膜封闭,分别加一抗、二抗杂交孵育,在暗室中显影、定影和曝光。胶片图片用Bandscan5.0进行灰度分析,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参计算相对表达量。
1.3 统计学方法所有数据采用SPSS 19.0统计软件进行分析。定量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验;等级资料多组间比较采用Kruskal-Walls检验;定性资料用百分比表示,组间比较采用卡方检验。P<0.05为差异有统计学意义。各组间蛋白表达进行比较后,对各因子表达水平之间进行Pearson双变量相关性分析。
2 结果
2.1 3组一般资料比较3组年龄、孕次差异无统计学意义(P>0.05),收缩压、舒张压、分娩时孕周和分娩方式差异有统计学意义(均P<0.05)。对照组收缩压和舒张压低于轻度组和重度组,分娩孕周、阴道分娩率高于轻度组和重度组,差异均有统计学意义(P<0.05);轻度组收缩压和舒张压低于重度组,分娩孕周、阴道分娩率高于重度组,差异均有统计学意义(P<0.05)。见表 1。
2.2 3组胎盘组织形态观察对照组胎盘滋养层细胞排列分布均匀,多核,形态多为自然卵圆形。而子痫前期胎盘组织呈不同程度弥漫性增生状态,胞核大而少,形状多不规则。见图1。
2.3 3组胎盘组织Notch1及Wnt1表达定位及强度比较免疫组化结果显示,Notch1主要表达于胎盘滋养层细胞和血管内皮细胞,Wnt1主要表达于胎盘滋养层细胞和绒毛外滋养细胞,见图2。3组Notch1及Wnt1表达强度和阳性表达率差异均有统计学意义(P<0.05)。对照组Notch1及Wnt1阳性表达率高于轻度组和重度组,轻度组Notch1及Wnt1阳性表达率高于重度组,差异均有统计学意义(P<0.05),见表 2。

表1 3组一般资料比较
2.4 Notch及Wnt信号通路相关因子表达水平检测3组Notch1、Jagged1、Wnt1及 β-catenin表达水平差异均有统计学意义(P<0.05)。对照组Notch1、Jagged1及Wnt1表达水平均高于轻度组和重度组,β-catenin表达水平高于重度组,轻度组Notch1、Jagged1、Wnt1及β-catenin表达水平均高于重度组,差异均有统计学意义(P<0.05)。见图3、表3。
2.5 各因子表达水平相关性分析Pearson相关分析结果显示,在Notch及Wnt信号通路中,Notch1与Jagged1表达水平呈正相关(r=0.826,P=0.000),与Wnt1呈负相关(r=-0.167,P=0.010);Wnt1与 Jagged1表达水平呈负相关(r=-0.136,P=0.037),与 β-catenin 呈正相关(r=0.531,P=0.000);而Notch1与β-catenin无线性相关性(r=-0.111,P=0.090)。
3 讨论
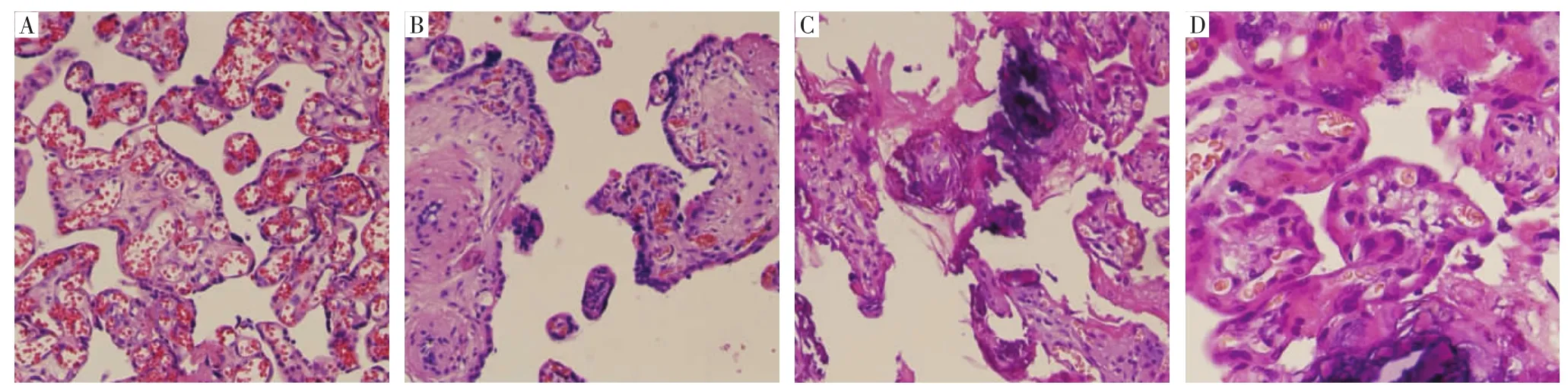
图1 各组胎盘组织形态

图2 Notch1和Wnt1在胎盘组织中的表达情况(免疫组化染色×400)

表2 3组Notch1及Wnt1表达强度比较 (例)
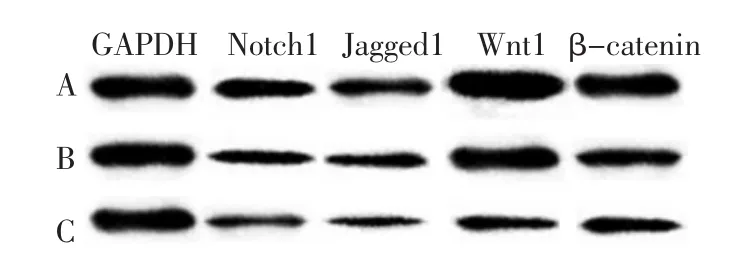
图3 Western blotting检测结果

表3 3组Notch1及Wnt1信号通路相关分子蛋白表达水平比较
滋养层细胞侵袭母体血管建立胎盘血管网异常是子痫前期主要的发病机制。临床研究表明,早发型子痫前期较晚发型子痫前期在母体健康和胎儿生命上均有更高的风险[7],其主要原因在于早发型子痫前期还有较长的孕期可导致病情进一步加重,且胎儿尚未完全发育成熟以至于不具备终止分娩的条件。绒毛滋养层细胞自受精卵进入宫腔后即开始侵袭母体血管,取代母体血管内皮细胞,建立用于母胎循环的胎盘血管床[8]。现有研究表明,子痫前期普遍存在胎盘浅着床现象,滋养层细胞受阻于母体血管黏膜段而不能建立完全畅通的母胎血液交换通道,从而导致母体血压升高以及胎儿血流供应不足引起的生长受限甚至死亡[9-10]。因此,了解滋养层细胞侵袭母体血管异常的机制是研究子痫前期发生、发展的关键。滋养层细胞侵袭子宫内膜血管内皮组织与肿瘤细胞的浸润转移机制十分相似,而Notch及Wnt信号通路均是肿瘤细胞迁移机制中的重要信号通路,但Notch1及Wnt1基因在子痫前期发病中的机制尚不完全明确,两信号之间的交互作用也暂无明确结论。
Notch信号通路广泛参与细胞增殖、生长等行为的调控,其中可与配体Jagged1结合参与新生血管的形成,因此与肿瘤的迁移和浸润机制密切相关[11]。研究表明,受精卵着床后,人绒毛膜促性腺激素(hCG)的持续升高可以促进Notch1高表达[12],从而促进子宫内膜增生增厚并抑制其脱落,同时还促进滋养细胞分化为绒毛外滋养细胞植入子宫内膜层,从而建立母胎循环[13]。此外,Notch1信号通路对于胎盘新生血管的生成具有双重作用,其配体之一DLL4可以通过抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)过表达从而抑制血管过度生长[14],而Jagged1则可以抵抗DLL4的抑制作用从而促进血管生成[15],因此一般在胎盘血管生成过程中,Jagged1会持续高表达。Wnt1是作用最广泛的Wnt信号通路之一,β-catenin是该信号通路的开关因子,共同抑制细胞凋亡,已被报道在肺癌等多种肿瘤中表达[16-18]。已有研究表明,Wnt信号通路也参与胚胎外组织的发育和生长,β-catenin在滋养细胞的增殖、生长和侵袭过程中发挥重要作用,当Wnt1及β-catenin过表达时,可导致葡萄胎中滋养细胞恶性增殖[19];当其低表达时,又可导致细胞凋亡率升高和浸润能力不足[20]。本研究结果显示,Notch1主要表达于胎盘滋养层细胞和血管内皮细胞,Wnt1主要表达于胎盘滋养层细胞和绒毛外滋养细胞;轻度及重度组胎盘组织Notch1、Jagged1及Wnt1表达水平均低于对照组,且重度组患者表达水平低于轻度组(均P<0.05),提示Notch1及Wnt1基因的低表达可能与子痫前期的发生、发展相关。因此推测,Notch1及其配体Jagged1可能通过低表达时滋养细胞侵袭能力降低、新生血管形成能力不足,导致母胎血管网异常,最终引发子痫前期;而Wnt1及β-catenin的低表达进一步降低了滋养细胞的抑制凋亡能力,导致细胞浸润能力不足,进一步促进了疾病进展。
此外,本研究结果还表明,Notch1与Wnt1表达水平呈负相关。现有关于Notch与Wnt信号通路交互作用的研究尚不多见,但均认为两者在促进细胞增殖和抑制凋亡方面具有协同作用。张颖[21]研究显示,在体外培养的乳腺癌干细胞中,沉默Notch1的表达后,Wnt1表达水平升高。但也有研究显示,在胃癌细胞系中,活化的Notch1信号通路对Wnt/βcatenin表达无影响,但激活Wnt/β-catenin通路后,Notch1表达下调,提示两个信号通路间可能有相互作用,Wnt对Notch1可能有一定的拮抗作用[22]。此外,Li等[23]研究表明,Notch与Wnt信号通路存在共同的下游因子c-Myc、Cyclin E等,均是参与细胞周期调控和增殖的关键因子。因此综合本研究结果可以推测,Notch1/Jagged1与Wnt1/β-catenin均参与胎盘滋养细胞的增殖、分化和侵袭,当其中一条通路出现异常低表达时,可能会促进另一条通路的高度活化以抵抗细胞增殖和侵袭能力的降低,反之亦然。但值得注意的是,这种交互作用是由其共同的下游因子引起还是来自机体的自我协调补充作用尚不得而知。
综上,本研究初步研究结果表明,Notch1、Wnt1及其信号通路相关因子的低表达与早发型子痫前期的发生、发展密切相关,且Notch1与Wnt1信号通路之间可能存在一定的交互作用,这对于子痫前期的机制研究及进一步分子学层面的诊疗研究具有一定提示意义,但两信号通路之间上下游分子具体的介导关系以及调控疾病发生、发展的详细机制尚需后续研究验证。

