UPLCMS/MS测定葡萄中的生长调节剂及其中7种外源生长调节剂的残留消解动态
张 文,闫 君,彭 涛,陈 婷,潘建忠,张琪玮
(兰州市食品药品检验所,甘肃省产品质量监督检验研究院,甘肃兰州 730000)
植物生长调节剂(Plant growth regulators,PGR)是一类可调节植物生长和代谢的源于植物体内或人工合成的化合物,源于植物体内的为内源性植物激素,而人工合成的植物生长调节剂又称外源性植物激素或生长调节剂,在我国被广泛应用于蔬菜、水果及中药材等农作物上,是现代化农业中的主要化控技术[1-5]。葡萄种植过程中,根据葡萄品种可以使用不同种类的生长调节剂,以提高座果率,调节果实生长发育[6-7],然而随着植物生长调节剂种类和范围的扩大,由于生长调节剂使用不当等原因引起的农产品质量安全问题时有发生[1-2]。了解植物生长调节剂在作物上的降解规律及掌握合理用量范围对农作物的种植有很重要的意义。
目前,对于不同施药剂量的生长调节剂在农作物中的消解动态研究已有报道[8-10],但由于生长调节剂检测方法不完善[11-12],此方面的研究不够系统,且使用外源性生长调节剂对内源性激素的影响未见报道,仅有对内源性激素本身变化的研究[13-16]。
液相色谱-串联质谱法具有测定快速简单、灵敏度高、假阳性少等优势,前期试验已建立了液相色谱-串联质谱法测定浆果等水果中生长调节剂的方法[17]。为评估植物生长调节剂在葡萄生长过程中的残留动态,本试验以“红地球”葡萄为受试对象,在田间试验的基础上,使用超高效液相色谱-串联质谱(UPLC-MS/MS)并加以改进,对“红地球”葡萄中的外源生长调节剂:缩节胺、矮壮素、6-苄基腺嘌呤(6-BA)、胺鲜酯、噻苯隆、氯吡脲、赤霉素的残留、消解动态及内源生长调节剂吲哚乙酸、脱落酸进行研究,以建立更适于测定较低含量生长调节剂的方法。本试验旨在为生长调节剂在葡萄种植中的安全性提供依据,也为今后生长调节剂在葡萄上的登记使用和最大残留限量的确定提供基础数据。
1 材料与方法
1.1 材料与仪器
供试材料为“红地球”葡萄 试验于甘肃省兰州市红古区葡萄试验基地(102°52′E,36°20′N)进行,“红地球”葡萄于2013年定植,架型为“Y”型架,东西行向,株行距1.0 m×1.8 m,采用相同的土肥水及病虫害等田间管理技术;供试药剂:a.复配型:以缩节胺为主、b.矮壮素、c.复配型:以6-BA为主、d.胺鲜酯、e.噻苯隆、f.氯吡脲、g.赤霉素 为市购农药,本试验为了消除厂家的指向性及明确农药成分,通过仪器检测确定了每种农药的有效成分,仅标注有效成分;吲哚乙酸、6-苄基腺嘌呤(6-BA)、氯吡脲、矮壮素、噻苯隆、缩节胺、赤霉素 来源为Dr.Ehrenstorfer.Gmbh;脱落酸 上海安谱科技有限公司;胺鲜酯 北京曼哈格;以上对照品纯度均大于96%;甲醇、乙腈、甲酸、乙酸 均为色谱纯,德国Merck公司;乙酸铵 HPLC级,美国Sigma公司;封端十八烷基(C18)粉末、N-丙基乙二胺(PSA)粉末、石墨化炭黑(GCB)粉末、增强基质去除(EMR)粉末 美国Agilent公司;无水硫酸镁、氯化钠、柠檬酸氢二钠、柠檬酸钠 国药集团化学试剂有限公司;超纯水 屈臣氏集团有限公司。
6460三重四极杆液质联用仪,配有1290UPLC 美国Agilent公司;5810R高速冷冻离心机 德国Eppendorf公司;B-400均质仪 美国BUCHI公司;EVA50A氮吹仪 普立泰科公司;MS3 涡旋混匀器 美国IKA公司;十万分之一、万分之一电子天平 德国Sartorius公司;KS 501振荡器 美国IKA公司。
1.2 实验方法
1.2.1 试验设计 选取生长健壮、长势一致的“红地球”葡萄植株,将其分成22个小区,每个小区6株,用塑料板隔开,以防农药喷施过程中交叉污染,最后一个小区为空白试验区。
6月5日见花时统一整理果穗,掐除花序岐肩和副穗,其余花穗分枝长度整理为1.0~1.5 cm;将花序整理成圆柱形,使果穗大小基本保持一致。按照表1,每种药剂设置低、中、高3组浓度,每组浓度喷施一个小区,即每6株树为1组喷施浓度,均匀喷施2次,浓度如表1。第2、3、4、6组在盛花期以一定浓度的药剂水溶液喷施果穗,第1、5、7组在膨果初期对整株同样进行喷施处理。空白试验区喷施清水,期间对供试植株进行相同的常规管理。
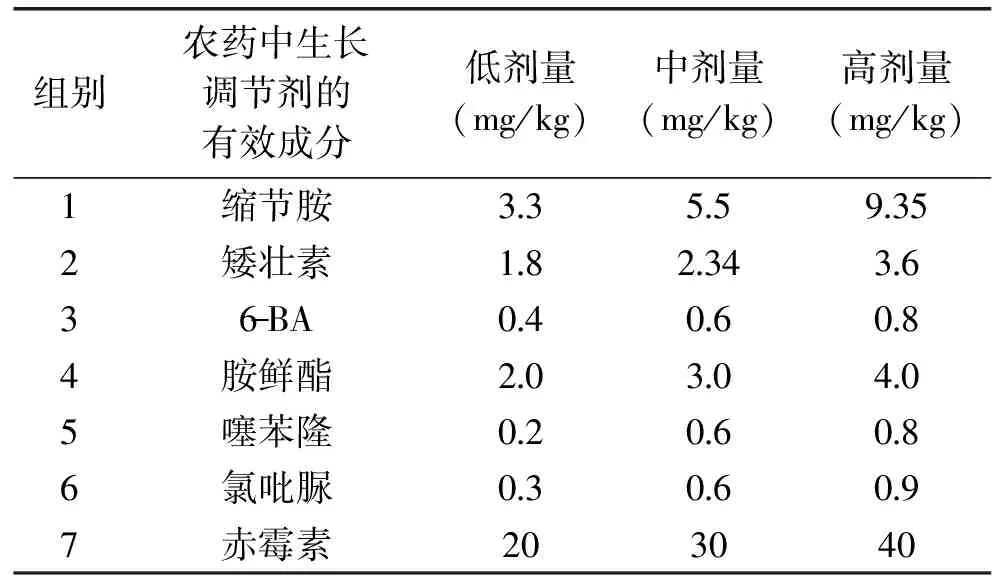
表1 喷施的生长调节剂种类及浓度Table 1 The variety and concentration of growth regulator sprayed
第2、3、4、6组施药处理后在葡萄膨果初期开始取样进行检测(因本试验主要监测葡萄中生长调节剂的降解,因此以葡萄果实形成初期开始采样),之后每隔一定时间取样进行测定。第1、5、7组施药处理后每间隔一定时间进行取样,取样时间固定在上午7:00~9:00,每组随机选取5穗,冷藏条件下运回实验室以供检测,分别将果实、穗轴(穗梗和穗轴)摘下,分别混匀后低温条件下充分粉碎,制得的样品保存在-20 ℃条件下于2 d内完成检测。
1.2.2 生长调节剂残留量测定 准确称取粉碎均匀的样品(果实10.0 g,穗轴5.0 g左右)参照文献[17]方法进行样品前处理,本试验中,净化后的待测液浓缩1倍上机测定。样品重复测定2次,结果取平均值,仪器使用超高效液相-三重四极杆质谱(UPLC-MS/MS)进行测定,超高效液相色谱-串联质谱条件参照文献[17]方法。仅液相色谱方法改变了梯度条件,液相色谱条件:色谱柱为Waters Acquity HSS T3(2.1 mm×100 mm,1.8 μm)。流动相A:0.1%甲酸水,流动相B:乙腈;梯度洗脱程序如下表2。流速:0.2 mL/min;柱温:35 ℃;进样量:5 μL。

表2 流动相梯度洗脱程序Table 2 Gradient elution process for liquid phase
1.2.3 液相色谱-串联质谱条件 ESI源,多反应监测模式(MRM),喷嘴电压:30 psi,干燥气温度:350 ℃,干燥气流速:13 L/min,毛细管电压:4000 V。各生长调节剂的定量和定性离子、碰撞能量和碎裂电压参数见表3。

表3 生长调节剂的质谱条件Table 3 Mass spectrometric parameters of the growth regulators
1.3 数据处理
数据采用 Microsoft Excel 2010进行整理及绘制相关图形。
2 结果与分析
2.1 UPLC-MS/MS测定生长调节剂残留量的方法确定
采用UPLC-MS/MS测定多种生长调节剂,正、负离子模式分开监测,提高了各化合物的灵敏度,矮壮素、缩节胺、6-BA、噻苯隆、胺鲜酯、氯吡脲、吲哚乙酸、脱落酸采用正离子化模式(ESI+),赤霉素采用负离子化模式(ESI-),正离子模式下总离子流图见图1,负离子模式下总离子流图见图2。

图1 正离子模式下MRM色谱图Fig.1 Multipic reaction monitoring chromatograms in the positive ion mode注:1:缩节胺;2:矮壮素;3:6-BA;4:胺鲜酯;5:吲哚乙酸;6:脱落酸;7:噻苯隆;8:氯吡脲。

图2 负离子模式下MRM色谱图Fig.2 Multipic reaction monitoring chromatograms in the negative ion mode注:9:赤霉素。
各生长调节剂标准曲线及相关系数依次为:缩节胺y=23341.75x+692259.92(r=0.9992)、矮壮素y=12246.48x+591940.77(r=0.9934)、6-BA y=53175.67x+686644.49(r=0.9992)、胺鲜酯y=135300.07x+1613763.42(r=0.9985)、噻苯隆y=2283.70x+24682.99(r=0.9991)、氯吡脲y=92476.43x+1248028.73(r=0.9990)、赤霉素y=217.32x+1203.02(r=0.9989)、吲哚乙酸y=11813.62x+136318.40(r=0.9992)、脱落酸y=2455.74x+34081.60(r=0.9988)。该方法的检出限受到前处理中称样量、待测液浓缩倍数及仪器灵敏度的影响,本次田间试验中所检出项的检出限为:缩节胺0.01 μg/kg、矮壮素0.01 μg/kg、6-BA 0.002 μg/kg、胺鲜酯0.02 μg/kg、噻苯隆0.005 μg/kg、赤霉素0.20 μg/kg、吲哚乙酸0.01 μg/kg、脱落酸0.50 μg/kg、氯吡脲0.01 μg/kg。
2.2 缩节胺在葡萄果实和穗轴中的残留量动态
通过田间试验,外源生长调节剂缩节胺在葡萄穗轴和果实中的含量随时间逐渐降低,如图3、图4。由图3、图4可知,葡萄果实和穗轴中缩节胺的含量相差较大,缩节胺在穗轴中的含量约为同时期果实中的10倍,可见穗轴更易吸附缩节胺,而果实对缩节胺的吸附相对较少。缩节胺可通过植株叶片和根茎部被吸收,传导至全株,由试验可得缩节胺传导入果实的量较少。由图3可见,穗轴中的缩节胺在施药后第40~47 d(果实转色期)消解较快,果实中缩节胺在施药后32 d内快速降解,降解率达到20%~50%。低剂量组的缩节胺残留量在整个生长阶段均是最低的;对于果实,中剂量组在施药后7~32 d与高剂量组的残留量基本一致,说明高剂量组的植株缩节胺的降解率高。缩节胺在GB 2763-2016中对水果类还未制定残留限量。通过田间试验可得到,在果实成熟时(施药73 d后)残留量降至检出限以下(<0.01 μg/kg)。

图3 穗轴中缩节胺残留量的动态图Fig.3 Dynamic diagram of mepiquat chloride residues in cob
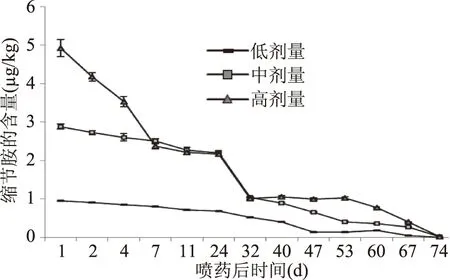
图4 果实中缩节胺残留量的动态图Fig.4 Dynamic diagram of mepiquat chloride residues in fruit
2.3 矮壮素在葡萄果实和穗轴中的残留量动态
由图5、图6可知,施药14 d后矮壮素在果实中的残留量最高为0.23 μg/kg,在穗轴中的最高残留量仅为0.1 μg/kg,对比GB 2763-2016[18]中矮壮素的限量(GB 2763-2016中仅对谷物和油料油脂制定了限量标准,最低的限量为0.1 mg/kg),此检出量为非常低的量值。

图5 穗轴中矮壮素残留量的动态图Fig.5 Dynamic diagram of cycocel residues in cob

图6 果实中矮壮素残留量的动态图Fig.6 Dynamic diagram of cycocel residues in fruit
矮壮素在穗轴和果实中的残留量随时间呈降低趋势,穗轴中的残留量低于果实中的,在果实转色初期(施药后69 d)矮壮素的残留量降至检出限以下,低至0.01 μg/kg;穗轴中矮壮素残留量在施药后69 d降至0.01 μg/kg左右。三种施药剂量组对比,穗轴和果实中的矮壮素均在施药后14~29 d降解较快。三组施药剂量均在推荐剂量范围内,即使高剂量组的残留量也远低于国家标准规定值,在采收时果实中已检测不出矮壮素。
2.4 6-BA在红提果实和穗轴中的残留量动态
由图7、图8可知,6-BA在施药14 d后,果实中的残留量为0.02~0.04 μg/kg,穗轴中的残留量为0.03~0.06 μg/kg,残留量较低;穗轴中的残留量较同时期果实中的残留量高;在施药后33 d,果实中残留量已检测不出,这与张平等[19]研究的果穗浸蘸30 d后,果实各部位均已测不到6-BA结论相近;穗轴中6-BA的残留量在施药后54 d降至检出限以下。6-BA与本试验中其它外源生长调节剂相比,在“红地球”葡萄中更易降解,不易残留。三组不同剂量的喷施量降解趋势相同,中剂量组与高剂量组在果实中的残留量相近,降解率均高于低剂量组。6-BA在GB 2763-2016中未规定限量,仅对豆芽做了限制使用的规定,而按照本试验的施用剂量,在转色期前(即施药后33 d)已检测不出6-BA。

图7 穗轴中6-BA残留量的动态图Fig.7 Dynamic diagram of 6-BA in cob

图8 果实中6-BA残留量的动态图Fig.8 Dynamic diagram of 6-BA in fruit
2.5 胺鲜酯在葡萄果实和穗轴中的残留量动态
由图9、图10可知,果实中胺鲜酯残留量为穗轴中的1/2,随时间呈降低趋势,在膨果初期(施药后14~22 d)胺鲜酯的下降速度最快,降解率高。在施药后14 d,穗轴、果实中的胺鲜酯残留量均低于GB 2763-2016中[18]胺鲜酯最低的限量0.05 mg/kg(普通白菜,国家标准未对水果类的胺鲜酯进行限量规定)。在施药后82 d,果实中的胺鲜酯残留量降至检出限以下(<0.02 μg/kg),低、中剂量组的穗轴中已检测不出胺鲜酯,高浓度组穗轴中的残留量为0.27 μg/kg,说明三种剂量的作用下,在采收时葡萄穗轴及果实中的胺鲜酯已降解完全。

图9 穗轴中胺鲜酯残留量的动态图Fig.9 Dynamic diagram of 2-diethylaminoethyl hexanoate in cob

图10 果实中胺鲜酯残留量的动态图Fig.10 Dynamic diagram of2-diethylaminoethyl hexanoate in fruit
2.6 噻苯隆在葡萄果穗和果实中的消解动态
噻苯隆为膨果初期施用,其残留动态如图11、图12,在施药7 d内降解速度较快,果实中的降解率为11%~30%,穗轴中的降解率为21%~47%。果实中的噻苯隆在施药后第47 d降至0.01 μg/kg,浓度越高降解速度越快,喷药后11 d,低、中、高剂量组在果实中的残留量相近,即噻苯隆的喷施浓度高,残留量在喷施后11 d也会降至较低量(0.1 μg/kg),在施药后53 d,果实中噻苯隆含量降至检出限以下(<0.005 μg/kg)。噻苯隆在GB 2763-2016中[18]限量为0.05 mg/kg,本试验中高剂量组的残留量在喷施后第1 d已低于此限量,故按照推荐量喷施植株,噻苯隆的残留量不会超出限量。

图11 穗轴中噻苯隆残留量的动态图Fig.11 Dynamic diagram of thidiazuron in cob

图12 果实中噻苯隆残留量的动态图Fig.12 Dynamic diagram of thidiazuron in fruit
2.7 氯吡脲在葡萄果穗和果实中的消解动态
由图13、图14可知,氯吡脲在果实、穗轴中的残留量均随时间呈下降趋势,在施药后29 d内氯吡脲在果实、穗轴中的残留量下降较快,但仅有低剂量组果实中的残留量降至0.5 μg/kg以下,高浓度组果实中的残留量在1 μg/kg以上,穗轴中的残留量均在0.5 μg/kg以上,与本试验中其它生长调节剂相比,残留量相对较高。在施药后第69 d,高剂量组在果实中的残留量降至0.1 μg/kg,施药后82 d,残留量降至检出限,低剂量组在施药后第62 d果实中的残留量降至检出限。氯吡脲在GB 2763-2016中[18]限量为0.05 mg/kg,本试验中高剂量组的残留量在喷施后第14 d低于此限量,故按照推荐量喷施植株,其残留量远低于限量值。

图13 穗轴中氯吡脲残留量的动态图Fig.13 Dynamic diagram of forchlorfenuron in cob

图14 果实中氯吡脲残留量的动态图Fig.14 Dynamic diagram of forchlorfenuron in fruit
2.8 赤霉素在葡萄穗轴和果实中的消解动态
赤霉素为内源性植物调节剂,在葡萄果实和穗轴的空白样品中均未检出,因此所测赤霉素含量主要为外源植物调节剂引入。穗轴中赤霉素的含量高于果实中的,从图15、图16中可知,施药后11 d内赤霉素的降解速度较快,穗轴中的降解率为12.5%~28.2%,果实中的降解率为23.0%~30.6%。赤霉素在GB2763-2016中没有规定限量,在喷药后53 d果实中赤霉素降至检出限(0.20 μg/kg),喷药后60 d穗轴中赤霉素降至检出限。三种剂量下,在喷施后40 d穗轴中的赤霉素残留量基本一致,即基本降解完全。不同剂量施药条件下,低、中、高剂量组的施药比例为2∶3∶4,在果实中的残留量也呈现为接近此比例的关系。

图15 穗轴中赤霉素残留量的动态图Fig.15 Dynamic diagram of gibberellin in cob
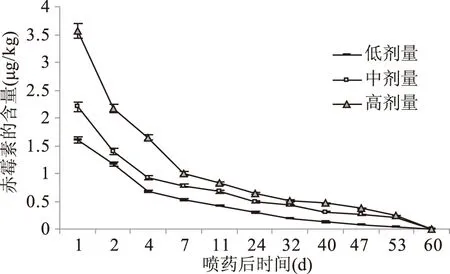
图16 果实中赤霉素残留量的动态图Fig.16 Dynamic diagram of gibberellin in fruit
2.9 内源激素在葡萄果穗和果实中的变化
在穗轴和果实中检测到的内源激素有:吲哚乙酸、脱落酸。吲哚乙酸在穗轴和果实中的含量相差不大,受到外源激素的影响不明显,不同浓度的外源激素组与空白样品的含量差别不大,说明吲哚乙酸含量未受到外源激素的影响;脱落酸在穗轴中的平均含量高于果实中,外源激素的施用对脱落酸的影响不明显,脱落酸在葡萄上色之后至成熟时期检测不出,低至0.1 μg/kg,但葡萄穗轴中始终能够检测出脱落酸,说明脱落酸在葡萄穗轴中的量高于果实中。
3 结论与讨论
本试验在高效液相色谱-串联质谱测定方法上进行改进,使用超高效液相色谱-三重四极杆法快速测定了葡萄中生长调节剂的残留量,定性定量准确,进一步提高了各化合物的灵敏度和分辨率,能够适用于检测葡萄中外源及内源性生长调节剂的含量。本试验采用建立的方法,结合田间试验,对不同剂量施药条件下7种外源生长调节剂在葡萄果实及穗轴上的消解动态进行了研究。结果表明,在高、中、低三种不同施药剂量条件下,7种外源生长调节剂都能在果实成熟时期降解至未检出,即检出限以下(除赤霉素<0.2 μg/kg,其它均<0.02 μg/kg),远低于现有的国际、国内规定的限量。7种外源生长调节剂在葡萄果实和穗轴中的残留量不同,除矮壮素外其它生长调节剂在穗轴中的残留量均高于果实,这与生长调节剂在葡萄生长过程中的吸收、输送有关[20-21]。不同剂量的施药条件下,7种生长调节剂的降解趋势一致,均随着时间延长含量降低,高浓度剂量组的降解速度最快;不同浓度的生长调节剂在施药后30 d内,降解速度较快,后期降解速度趋于缓慢。按照本试验的三种施药剂量,在采摘时,葡萄果实中的生长调节剂残留量均低于检出限。
影响生长调节剂残留量的因素较多,如施药方式、施药时及施药后天气状况、样品品种、施药浓度、土壤中的残留等,为保障葡萄等水果的食用安全,今后的研究需对生长调节剂的降解产物、毒理性等进行研究探讨。本试验中,各生长调节剂的检出限较低,最低达到了ng/kg的级别,建立的检验方法可以检测出微量的生长调节剂含量,为生长调节剂的研究工作奠定了基础。

