液相质谱法同时检测猪肉中氯霉素和地塞米松
舒顺顺,米倩,杨彩霞,刘芹,牛军
(正大食品(襄阳)有限公司,湖北襄阳441000)
在我国,养殖业抗生素滥用问题一直比较严重。在养猪业不仅用抗生素治疗疾病,还用来防治疾病[1]。滥用抗生素,将导致猪体内抗生素残留,不仅会给猪肉食品安全带来潜在隐患,更会对人类的健康及生存环境造成危害[2]。氯霉素和地塞米松是抗生素残留中的重要成员。
氯霉素(chloramphenicol,CAP)是由委内瑞拉链丝菌产生的,可作用于细菌核糖核蛋白体的50S亚基,抑制菌体蛋白合成,对革兰式阴性菌和革兰氏阳性菌均有抑制作用,属抑菌性广谱抗生素[3]。由于价格低廉且效果显著,常被作为畜禽的疾病治疗和预防[4]。地塞米松(dexamethasone,DXMS)于 1957 年首次合成,是一种人工合成的皮质类固醇。其药理作用主要是抗炎、抗毒、抗过敏、抗风湿等[5]。经过长时间的临床应用实践,人们对氯霉素和地塞米松的毒副作用有了充分的认识。氯霉素的毒副作用主要有:抑制骨髓造血功能,引起新生儿致命性灰色综合症,以及引起精神抑郁厌食等,低浓度药物残留还会诱发致病菌的耐药性[6]。地塞米松的毒副作用主要有:可能导致全身性过敏反应、骨质疏松及骨折、肠胃道刺激(恶心、呕吐)、儿童生长受到抑制、诱发青光眼白内障、可能出现精神症状、停药综合症等危害[7]。
液相色谱-串联质谱法是对抗生素定量时常用的方法[8],此法的定量方法分为外标法和内标法[9-10]。外标法是用待测组分的纯品作对照物质,以对照物质和样品中待测组分的响应信号相比较进行定量的方法;此方法简便,无需校正因子,不论样品中其他组分是否出峰,均可对待测组分定量,适用范围较广。内标法是选择样品中不含有的纯物质作为对照物质加入待测样品溶液中,以待测组分和对照物质的响应信号对比,测定待测组分含量的方法;此测定的结果较为准确,由于是通过测量内标物及被测组分的峰面积的相对值来进行计算的,因而在一定程度上消除了操作条件等的变化所引起的误差,适用于对精密度和准确度要求较高的物质的检测。由于氯霉素对精密度(GB/T 22338-2008《动物源性食品中氯霉素类药物残留量测定》要求:添加浓度为 0.1 μg/kg~5 μg/kg,回收率范围为80.5%~107.0%)要求比较高,而地塞米松对精密度(农业部1031号公告-2-2008要求:添加浓度为0.5 μg/kg~1.5μg/kg,回收率范围为 50%~120%)要求宽泛,所以本研究中用液相色谱-串联质谱法测定猪肉中氯霉素时采用内标法,测定地塞米松时采用外标法。
1 材料与方法
1.1 材料与试剂
氯霉素(CAP,≥99.3%)、氯霉素氘代内标(氯霉素-D5,100 mg/mL)、地塞米松(DXMS,≥98.9%):德国Dr.Ehrenstorfer GmbH公司;乙酸乙酯(色谱纯)、正己烷(色谱纯):上海安谱实验科技有限公司;甲醇(色谱纯)、乙腈(色谱纯):德国默克股份两合公司;试验用水均为超纯水。
猪肉:正大食品(襄阳)有限公司。
1.2 仪器与设备
TURBOVA LV全自动水浴氮吹仪:美国BIOTAGE公司;LC-MS/MS 8040高效液相色谱-串联质谱仪:日本岛津公司;VORTEX3迷你振荡器:德国IKA公司;GL-21高速冷冻离心机:湖南湘仪离心机仪器有限公司;一次性注射器(1 mL):湖南康利来医疗器械有限公司;500 mg/6mL Silica固相萃取柱、疏水性PTFE针式滤器(0.22 μm):上海安谱实验科技股份有限公司。
1.3 方法
1.3.1 标准溶液的配置
1)标准储备溶液的配置
氯霉素标准储备溶液:准确称取氯霉素标准品10 mg(精确到 0.1 mg),用甲醇定容到 100 mL,配成100 μg/mL的标准储备溶液。
氯霉素氘代内标(氯霉素-D5)储备溶液:100μg/mL的标准储备溶液(4℃避光保存可使用12个月)。
地塞米松标准储备溶液:准确称取地塞米松标准品10 mg(精确到0.1 mg),用甲醇定容到10 mL,配成1 000 μg/mL的标准储备溶液(-20℃保存可使用12个月)。
2)中间储备溶液的配置
用移液器分别移取1 mL氯霉素、氯霉素-D5、地塞米松储备液,用甲醇定容至10 mL,再按照10倍稀释度逐步分别配成浓度为1 μg/mL的中间储备液。
3)工作液配置
分别移取氯霉素中间储备液、氯霉素-D5中间储备液、地塞米松中间储备液各1mL到3个5mL容量瓶中,用甲醇分别定容到5 mL,配制成200 ng/mL的工作液。
试验中用甲醇配置混合标准溶液,氯霉素和地塞米松标准品终浓度均为 0.2、0.5、2、5、10、20、40 ng/mL;氯霉素-D5终浓度为10 ng/mL。
1.3.2 色谱、质谱条件
1)液相色谱条件
岛津Shim-packGISTC18色谱柱(150mm×2.1mm,5 μm),柱温箱温度:40℃,流速:0.3 mL/min,进样体积:20 μL,流动相:水(A)-甲醇(B)。梯度洗脱程序如下:0~0.5 min,25%B;0.5 min~2 min,25%B~100%B;2 min~4 min,100%B;4 min~5 min,100%B~25%B;5 min~8 min,25%B。
2)质谱条件
检测方式:多反应监测(multiple reaction monitor ing,MRM),加热模块温度:400℃,干燥器气流(drying gas flow):15.0 L/min,雾化器气流(nebulizing gas flow):3.0 L/min,碰撞气:氩气,压力(CID Gas):230 kPa,离子源:电喷雾离子源(electrospray ion source,ESI+),扫描方式:负离子扫描。
1.3.3 样品前处理
1.3.3.1 提取
取新鲜或冷冻猪肉,去除表观脂肪,搅碎,准确称量样品2.00 g于50 mL离心管中,各样品管中加入氯霉素-D5内标标准工作溶液50 μL,加标回收管再加入相应体积的外标标准工作溶液。各管加乙酸乙酯15 mL,涡旋混合 5 min,4 000 r/min 离心 15 min,将乙酸乙酯层转移到另一个50 mL离心管中;残渣用15 mL乙酸乙酯重复提取1次,合并2次样品提取液,40℃氮气吹干,加1 mL乙酸乙酯和5 mL正己烷,溶解残渣,待净化。
1.3.3.2 净化
用6 mL正己烷活化固相萃取柱,提取液过柱。用6 mL正己烷淋洗萃取柱,抽干,用6 mL正己烷-丙酮(6∶4,体积比)洗脱,用10 mL离心管收集洗脱液。洗脱液45℃氮气吹干,加25%甲醇水溶液1 mL,溶解残渣,10 000 r/min离心20 min,用1 mL注射器取上清液,过0.22 μm有机滤膜,供高效液相色谱-串联质谱法测定。
1.3.4 试验方法
氯霉素采用内标法,以氯霉素-D5为内标物测定氯霉素含量;地塞米松采用外标法。
2 结果与分析
2.1 质谱条件的优化
选用负离子全扫描方式,采用Q3 Scan模式进行一级质谱分析,得到各个被测物分子离子峰,扫描图谱如图1。
根据分子离子峰,确认氯霉素、氯霉素-D5和地塞米松的m/z值分别为321.10、326.10和437.15。以3种化合物确认的m/z值为母离子,进行二级质谱分析及自动优化,得到质谱参数见表1。
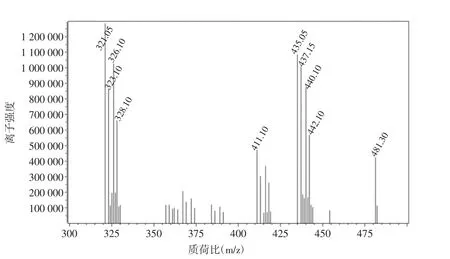
图1 3种化合物全扫描图谱Fig.1 The full scan map of the three compounds
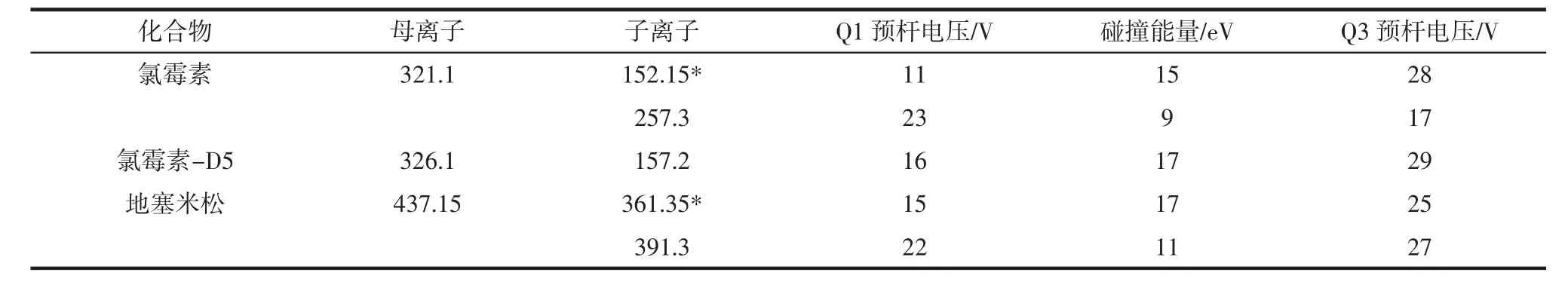
表1 氯霉素和地塞米松的质谱条件参数Table 1 Mass spectrometry parameters of chloramphenicol and dexamethasone
2.2 色谱条件的优化
2.2.1 流动相选择
氯霉素易溶于甲醇、乙醇、丙醇及乙酸乙酯,在干燥时稳定,在弱酸性和中性溶液中较安定,遇碱类易失效[7];地塞米松在丙酮、甲醇、乙醇或二氧六环中略溶,在三氯甲烷中微溶,在乙醚中极微溶解,在水中几乎不溶[7]。因此选用不同的流动相对氯霉素和地塞米松的溶解性差别较大,这将直接影响检测的信号强度。本研究采用4组流动相进行检测,分别为纯水-甲醇、0.1%甲酸水-0.1%甲酸甲醇、纯水-乙腈、0.1%甲酸水-0.1%甲酸乙腈,对同一混合标准品稀释液进行检测,以纯水-甲醇为流动相时3种化合物峰面积为1,对比结果如图2。
试验表明,氯霉素和氯霉素-D5在以纯水-甲醇为流动相时响应最高,在以0.1%甲酸水-0.1%甲酸乙腈为流动相时响应最低,仅为最高响应值的0.27倍和0.26倍;地塞米松在以0.1%甲酸水-0.1%甲酸甲醇为流动相时响应最高,为纯水-甲醇作为流动相时的1.34倍。综合考虑,本研究采用纯水-甲醇作为流动相。
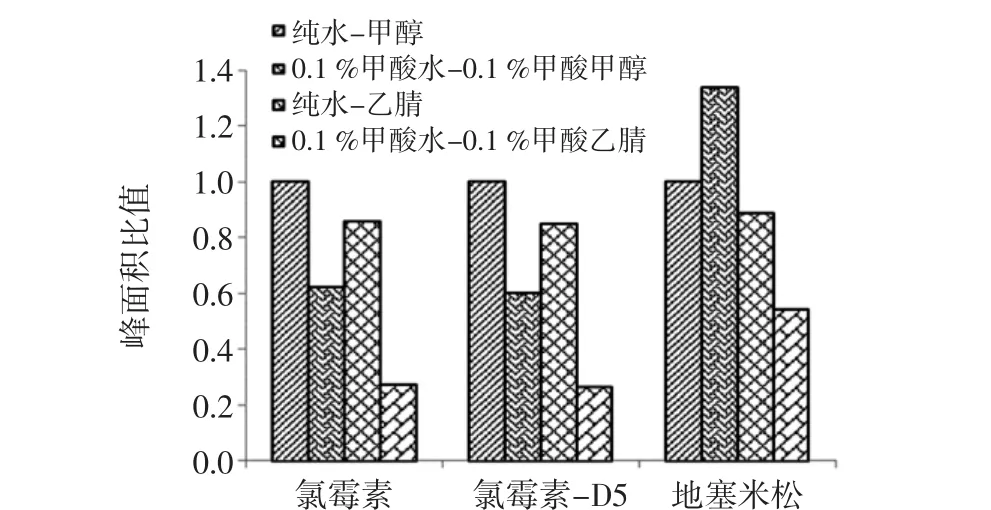
图2 流动相对离子化效率的影响Fig.2 Effect of mobile phase on ionization efficiency
2.2.2 梯度洗脱程序优化
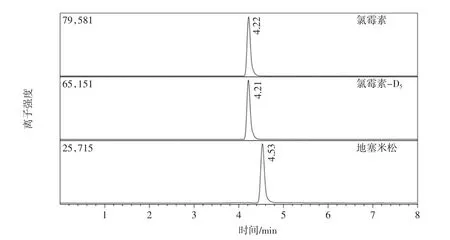
图3 氯霉素和地塞米松标准溶液离子色谱图Fig.3 Ion chromatograms of chloramphenicol and dexamethasone in standard solution
选用纯水-甲醇为流动相优化梯度洗脱程序,在上述液相色谱条件和质谱条件下,氯霉素(0.2 ng/mL)出峰时间为4.20 min,地塞米松(0.2 ng/mL)出峰时间为4.52 min,氯霉素和地塞米松能够良好分离,如图3。
2.2.3 提取条件的选择
本研究对猪肉样品分别采用乙腈和乙酸乙酯进行提取,结果见表2。
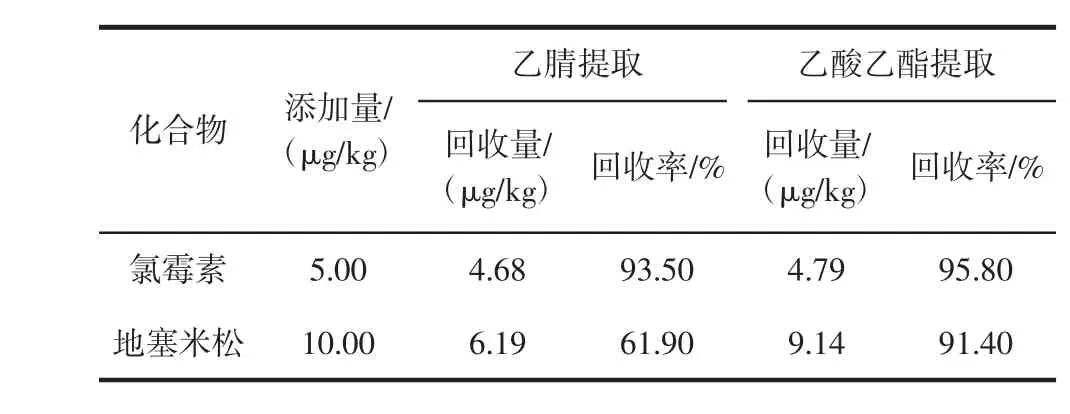
表2 乙腈和乙酸乙酯提取时氯霉素和地塞米松的回收率Table 2 Recoveries of chloramphenicol and dexamethasone using acetonitrile and ethyl acetate
乙腈和乙酸乙酯提取对氯霉素回收率没有显著差别(P>0.05),地塞米松用乙酸乙酯提取时回收率显著(P<0.05)高于用乙腈提取。因此本研究采用乙酸乙酯作为提取剂。
2.3 线性范围和定量限
选用优化的色谱条件、质谱条件和前处理条件,对系列混合标准溶液进行测定,得到氯霉素和地塞米松标准曲线,其中氯霉素标准曲线横坐标为系列浓度,纵坐标为氯霉素峰面积与氯霉素-D5峰面积的比值,地塞米松标准曲线横坐标为系列浓度,纵坐标为峰面积。以10倍信噪比确定两种化合物的定量限,相关参数如表3。

表3 氯霉素、地塞米松的回归方程、相关系数和定量限Table 3 Linear equations,correlation coefficients and limits of quantitation of chloramphenicol and dexamethasone
2.4 回收率和精密度
选取阴性猪肉样品,称取15份随机分成3组,第一组氯霉素添加量为1μg/kg,地塞米松添加量为0.5μg/kg;第二组和第三组氯霉素和地塞米松的添加量相同,两组添加量分别为2.5 μg/kg和5 μg/kg。批间精密度是在5 μg/kg的添加水平上进行5个样品分析,连续测定3 d,结果见表4。
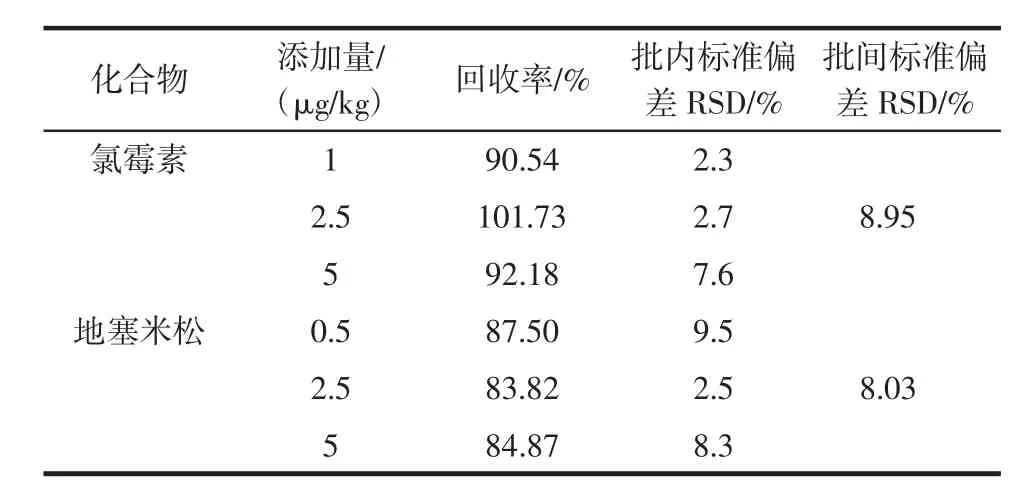
表4 阴性猪肉中添加氯霉素和地塞米松的加标回收率和精密度Table 4 Spiked recoveries and RSDs of chloramphenicol and dexamethasone in pork samples
结果表明,猪肉中氯霉素3个添加水平的平均回收率在90.54%~101.73%之间,批内标准偏差RSD值在2.3%~7.6%之间,批间标准偏差RSD值为8.95%;猪肉中地塞米松3个添加水平的平均回收率在83.82%~87.50%之间,批内标准偏差RSD值在2.5%~9.5%之间,批间标准偏差RSD值为8.03%。
2.5 实际样品的检测
应用本方法对50个猪肉样品同时进行氯霉素和地塞米松的检测,未发现阳性样品。
3 结论
本研究建立了液相色谱-串联质谱法同时检测猪肉中氯霉素和地塞米松残留的方法。根据精密度要求不同,氯霉素采用内标法定量而地塞米松采用外标法定量。通过优化质谱条件、色谱条件,使氯霉素和地塞米松在响应强度增强的同时能够很好的分离;通过优化提取溶剂,使地塞米松的回收率显著提高;两种药物残留一同检测,使分析时间成倍缩短,节约时间和成本。该方法回收率高、重复性好,氯霉素添加量在1 μg/kg~5 μg/kg时,回收率在 90.54%~101.73%之间;地塞米松添加量在 0.5 μg/kg~5 μg/kg 时,回收率在83.82~87.5%之间;批内标准偏差和批间标准偏差RSD%值均小于10。因此,该方法是一种快速、准确、灵敏、实用的方法,完全满足国内外对猪肉中氯霉素和地塞米松药物残留的检测要求。