桑葚酵素饮料的发酵工艺研究及其质量评价
郭伟峰,王红梅,邹晓桐,罗秀秀,王萍,曾霞,尹爱国,周英彪,*
(1.广东石油化工学院广东省岭南特色果蔬加工及应用工程技术研究中心,广东普通高校食品科学创新团队,广东茂名525000;2.广东石油化工学院生物与食品工程学院,广东茂名525000)
桑葚(Fru ctus mori)又叫桑果、桑椹、桑椹子、桑葚子,是桑树所结的果实,味甘性寒,归心、肝、肾经,具有滋阴补血、生津止渴、补肝益肾等功效[1]。桑葚果汁色泽艳丽,且富含维生素、胡萝卜素、黄酮醇、花青素、酚酸等多种生物活性物质,具有良好的保健功能[2]。目前对桑葚的加工形式有干果[3]、果汁[4]、复合饮料[5]、果酒[6-8]及果醋[9-11]等。
酵素按用途可分为食用酵素、环保酵素、日化酵素及饲用酵素。其中,食用酵素是指以动物、植物及菌类为原料,经微生物发酵而制得具有特定生物活性成分可食用的产品[12]。其中生物活性成分对生物现象有影响的微量或少量物质,包括多糖类、寡糖类、蛋白质、酶及多肽类、氨基酸类、维生素类、及醇、酯、酸、酚类等[13]。进行桑葚酵素的研究开发,可以丰富桑葚的深加工形成,满足市场需求。
超氧化物歧化酶(superoxide dismutase,SOD)是重要的生物活性因子,在保护细胞免受氧自由基的毒害中发挥着重要作用,在医药、食品工业及农业上均有广泛的应用前景[14-16]。SOD酶活力是优化酵素发酵工艺的常用指标之一,此类的研究报道较多。如利用SOD酶活力作为指标,刘鑫等优化了蓝莓酵素发酵工艺[17],冯彦君等优化了蓝莓酵素发酵工艺[18],韦仕静等优化了西兰花酵素发酵工艺[19]。
近年来,对桑葚酵素的研究开发也有报道。如Kwaw E等[20]以总酚为指标,优化了利用乳酸杆菌发酵桑葚果汁制备桑葚酵素饮料的工艺;韦仕静等[21]以桑葚干果粉混合苹果汁为原料,乳酸杆菌为发酵菌株,总酸与总糖为指标,优化了桑葚酵素的发酵工艺。本研究以桑葚果汁为原料,SOD酶活力为指标,先从酿酒酵母、醋酸杆菌及植物乳酸杆3种种属中优选出合适菌种组合,然后单因素及正交试验优化了桑葚酵素饮料的发酵工艺,并对优化发酵工艺下制得的桑葚酵素饮料做了质量评价。
1 材料与方法
1.1 材料
1.1.1 原料、菌株与培养基
1.1.1.1 原料
桑葚(Fructusmori),产自广东省化州市。
1.1.1.2 菌株
酿酒酵母(Saccharomycescerevisiae,CGMCC2.3853):中国普通微生物菌种保藏管理中心,醋酸杆菌(Acetobacter pasteurianus,CICC 20064) 及植物乳酸杆菌(Lactobacillus plantarum,CICC 21790):中国工业微生物菌种保藏管理中心。
1.1.1.3 培养基
LB 培养基:蛋白胨 10 g,酵母粉 5 g,NaCl 10 g,蒸馏水1 000 mL,pH 7.0。YPD培养基:蛋白胨20 g,酵母粉 10 g,葡萄糖 20 g,蒸馏水 1 000 mL,pH 7.0。
1.2 主要试剂与仪器设备
1.2.1 主要试剂
邻苯三酚:国药集团;其他试剂分析纯。
1.2.2 主要仪器
WJS1222F型榨汁机:广东美的电器股份有限公司;HH-2型数显恒温水浴锅:常州国华电器有限公司;DHZ-DA型卧式恒温摇床:苏州培英实验设备有限公司;YP10002型电子天平:上海佑科上海佑科仪器仪表有限公司;Gene 1580R型台式高速冷冻离心机(Gene Company Limited),及L5S型紫外可见分光光度计:上海仪电科学仪器有限公司。
1.3 方法
1.3.1 桑葚酵素饮料的工艺流程
桑葚酵素饮料的工艺流程如图1所示。
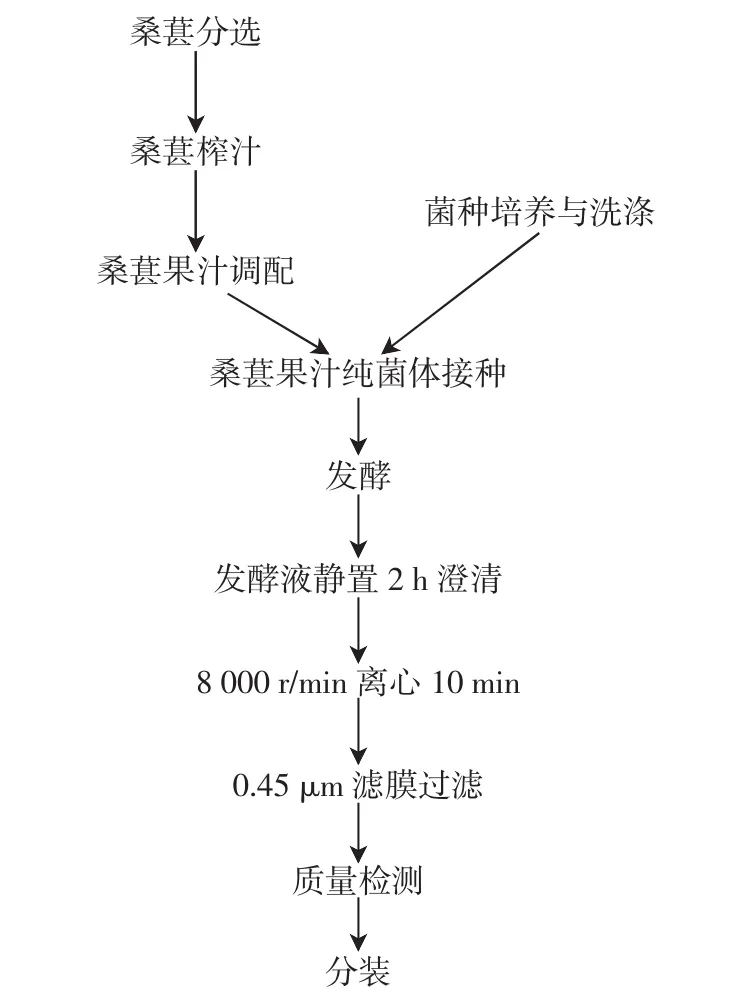
图1 桑葚酵素饮料的工艺流程Fig.1 The process of the mulberry ferment beverage
包括桑葚分选、桑葚榨汁、桑葚果汁调配、菌种培养与洗涤、桑葚果汁纯菌体接种、发酵、发酵液静置2 h澄清、8 000 r/min 离心 10 min、0.45 μm 滤膜过滤、质量检测、分装等工序。
1.3.2 原料的预处理
将-20℃冰箱保藏的桑葚转移到4℃冰箱中24 h,使结冰完全融化,于榨汁机中榨汁,纯桑葚榨汁不加水,榨汁后加入终浓度0.2 g/L偏重亚硫酸钾防氧化。桑葚果汁装瓶封口,-20℃冰箱保存,试验前在4℃冰箱中解冻24 h。
1.3.3 菌株培养与洗涤
酿酒酵母(YPD培养基,30℃、180 r/min振荡培养)、醋酸杆菌(LB培养基,30℃、180 r/min振荡培养)与植物乳酸杆菌(LB培养基,37℃、180 r/min振荡培养)培养至对数生长中后期,分别按接种量取培养液,离心去除培养基,无菌水洗涤菌体2次后,菌体接入桑葚果汁进行发酵。
1.3.4 SOD酶活力测定
采用邻苯三酚自氧化法测定桑葚果汁及桑葚酵素样品的SOD酶活力[22-23]。
邻苯三酚的自氧化速率测定:在试管中加入4.00mL蒸馏水、4.50 mL PBS(phosphate buffer saline)缓冲液(pH 8.3、50 mmol/L)、1.00 mL EDTA(ethylene diamine tetraacetic acid)溶液(10 mmol/L),混匀,25 ℃平衡20 min;然后加入0.50 mL邻苯三酚溶液(3 mmol/L、25℃预热),迅速摇匀,立即倾入比色杯中,在325 nm波长处测定光吸收值,每隔30 s读数一次,测定4 min内每分钟光吸收值的变化速率。空白对照为4.00 mL蒸馏水、4.50 mL PBS缓冲液(pH 8.3、50 mmol/L)、1.00 mL EDTA溶液(10 mmol/L)混合0.50 mL HCl(10 mmol/L)。
样品光密度值变化速率测定:桑葚果汁及桑葚酵素样品8 000 r/min、离心10 min,取上清液稀释10倍。在试管中加入0.20 mL稀释后的样品、3.80 mL蒸馏水、4.50 mL PBS 缓冲液(pH 8.3、50 mmol/L)、1.00 mL EDTA 溶液(10 mmol/L),混匀,25℃平衡 20 min;然后加入0.50 mL邻苯三酚溶液(3 mmol/L、25℃预热),迅速摇匀,立即倾入比色杯中,在325 nm波长处测定光吸收值,每隔30 s读数一次,测定4 min内每分钟光吸收值的变化速率。空白对照同前。

式中:V1为反应液总体积,mL;V2为测定样品体积,mL;n为样品稀释液倍数;ODA为邻苯三酚的自氧化速率;ODB为样品光密度值变化速率。
1.3.5 确定最佳发酵菌种
设置7个菌种组合:植物乳酸杆菌、醋酸杆菌、酿酒酵母、植物乳酸杆菌+酿酒酵母、植物乳酸杆菌+醋酸杆菌、醋酸杆菌+酿酒酵母、植物乳酸杆菌+醋酸杆菌+酿酒酵母;菌株组合体积比例为1∶1和1∶1∶1。桑葚果汁量为120 mL,调初始糖度为6 Brix,接种量为5%(菌种活化培养与洗涤后接入菌体),发酵温度设置为30℃,180 r/min振荡培养,发酵时间设置为48 h。取样测定各个菌株组合发酵液的单位SOD酶活力(每组测3个平行样),比较其显著性,选单位SOD酶活力最高的菌种组合进行进一步探究。
1.3.6 单因素试验
选取确定最佳发酵菌种试验中发酵液单位SOD酶活力最高的菌种组合作为桑葚酵素的发酵菌种,进行发酵温度、接种量、初始糖度及发酵时间等单因素试验,以单位SOD酶活力为指标,研究各因素对桑葚酵素发酵的影响。
1.3.6.1 发酵温度
发酵温度设置为 26、28、30、32、34、36 ℃共 6 个水平。桑葚果汁量为120 mL,初始糖度为6 Brix,接种量为10%(菌种活化培养与洗涤后接入菌体),180 r/min振荡培养,发酵时间设置为24 h。取样测定各个水平发酵液的单位SOD酶活力(每水平测3个平行样),t-检验比较其显著性。
1.3.6.2 接种量
接种量设置5%、10%、15%、20%、25%、30%共6个水平(菌种活化培养与洗涤后接入菌体)。桑葚果汁量为120 mL,初始糖度为6 Brix,发酵温度选取发酵温度因素试验中的最优发酵温度,180 r/min振荡培养,发酵时间设置为24 h。取样测定各个水平发酵液的单位SOD酶活力(每水平测3个平行样),比较其显著性。
1.3.6.3 初始糖度
用白砂糖调节桑葚果汁初始糖度为6、10、14、18、22、26 Brix共6个水平。桑葚果汁量为120 mL,接种量设置为接种量因素试验中的最优接种量(菌种活化培养与洗涤后接入菌体),发酵温度选取发酵温度因素试验中的最优发酵温度,180 r/min振荡培养,发酵时间设置为24 h。取样测定各个水平发酵液的单位SOD酶活力(每水平测3个平行样),t-检验比较其显著性。
1.3.6.4 发酵时间
发酵时间设置为 8、16、24、32、40、48 h 共 6 个水平。桑葚果汁量为120 mL,初始糖度为初始糖度因素试验中的最优初始糖度,接种量设置为接种量因素试验中的最优接种量(菌种活化培养与洗涤后接入菌体),发酵温度选取发酵温度因素试验中的最优发酵温度,180 r/min振荡培养,发酵时间设置为24 h。取样测定各个水平发酵液的单位SOD酶活力(每水平测3个平行样),t-检验比较其显著性。
1.3.7 正交试验
依据单因素试验结果,选取发酵温度、接种量、初始糖度及发酵时间4个因素各3个显著水平,进行四因素三水平L9(34)正交试验,以桑葚酵素中单位SOD酶活力为指标,确定最优桑葚酵素发酵工艺。
1.3.8 质量评价
采用优化所得的发酵条件,按桑葚酵素饮料的工艺流程制备葚酵素饮料,参照GB/T 10789-2015《饮料通则》[24]、GB/T 31121-2014《果蔬汁类及其饮料》[25]、及GB/T 30884-2014《苹果醋饮料》[26]等相关标准,对桑葚酵素饮料的感官、理化及微生物指标进行评价。
1.3.9 数据处理
试验数据用统计软件SPSS 20.0进行处理与分析,组间差异比较采用t-检验方法。
2 结果与分析
2.1 确定最佳发酵菌种
7个菌种组合发酵所得桑葚酵素,均没有异味,风味上均可以接受。菌种对桑葚酵素发酵的影响见图2。
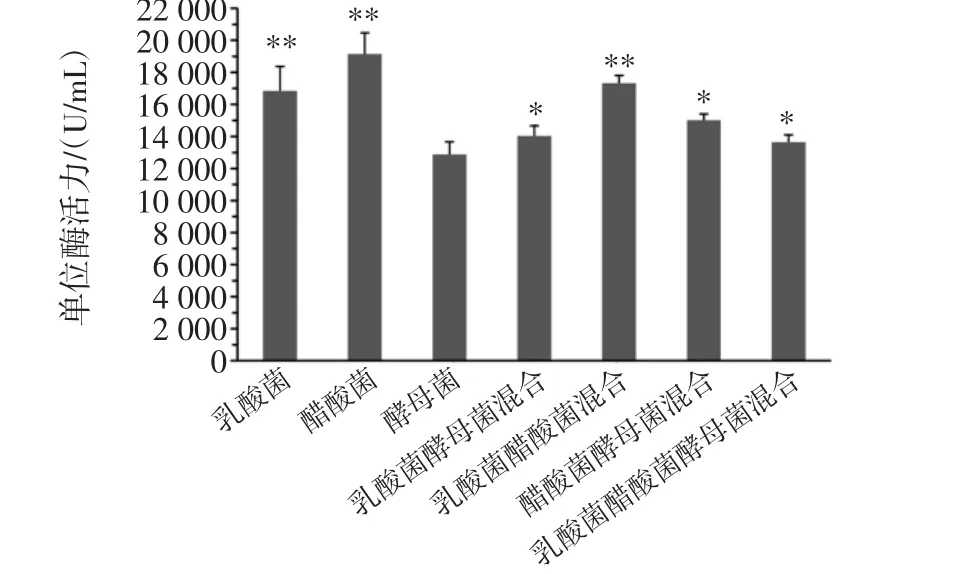
图2 菌种对桑葚酵素发酵的影响Fig.2 Effect on mulberry ferment with fermentation strain
由图2可知,与单位SOD酶活力最低的(酿酒酵母)比较,植物乳酸杆菌、醋酸杆菌、植物乳酸杆+菌醋酸杆菌为发酵菌种的差异极为显著(p<0.01),植物乳酸杆菌+酿酒酵母、醋酸杆菌+酿酒酵母、植物乳酸杆菌+酿酒酵母+醋酸杆菌为发酵菌种的差异显著(p<0.05),说明发酵菌种对桑葚酵素的发酵有明显影响。其中,以醋酸杆菌为发酵菌种的桑葚酵素单位SOD酶活力(19 146.2 U/mL)最高,因此选取醋酸杆菌为发酵菌种,进行后续研究。
2.2 单因素试验
2.2.1 发酵温度
酵温度对桑葚酵素发酵的影响见图3。
由图3可知,在初始糖度为6 Brix、发酵菌种为醋酸杆菌、接种量为10%、发酵时间24 h情况下,发酵温度对桑葚酵素的单位SOD酶活力有明显影响;随着发酵温度的升高桑葚酵素的单位酶活力逐渐升高,当温度达到30℃时单位酶活力达到最高,当温度超过30℃时,单位酶活力明显下降。因此选取28、30、32℃此3个发酵温度水平进行正交试验。
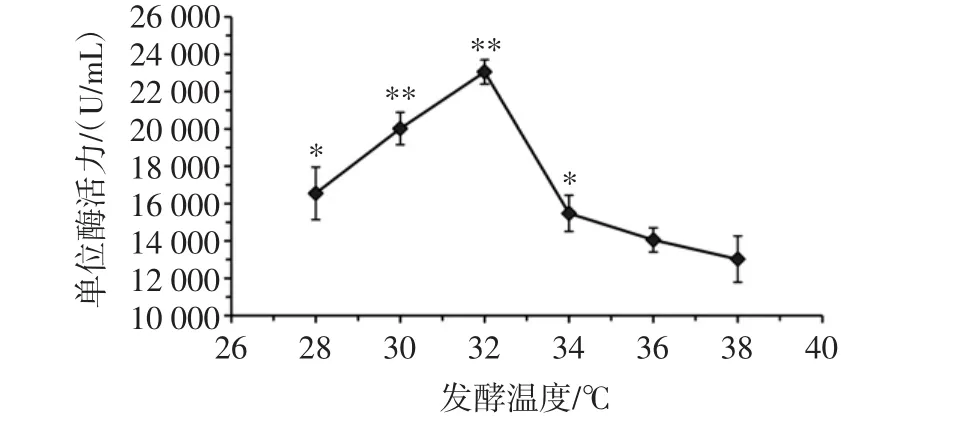
图3 发酵温度对桑葚酵素发酵的影响Fig.3 Effect on mulberry ferment with ermentation temperature
2.2.2 接种量
接种量对桑葚酵素发酵的影响见图4。
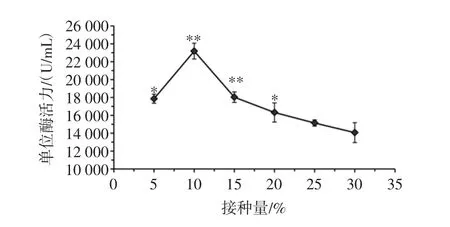
图4 接种量对桑葚酵素发酵的影响Fig.4 Effect on mulberry ferment with inoculum
由图4可知,在初始糖度为6 Brix、发酵菌种为醋酸杆菌、发酵温度为30℃、发酵时间24 h情况下,接种量对桑葚酵素的单位SOD酶活力有明显影响;接种量为5%时桑葚酵素的单位酶活力较低,随着菌种接种量的提高单位酶活力逐渐升高,当接种量达到10%时单位酶活力达到最高,接种量超过10%单位酶活力开始明显下降。因此选取5%、10%、15%此3个接种量水平进行正交试验。
2.2.3 初始糖度
初始糖度对桑葚酵素发酵的影响见图5。
由图5可知,在发酵菌种为醋酸杆菌、接种量为10%、发酵温度为30℃、发酵时间24 h情况下,初始糖度对桑葚酵素的单位SOD酶活力有明显影响;初始糖度为6Brix时,桑葚酵素的单位酶活力较低,随着初始糖度的提高单位酶活力逐渐升高,初始糖度达到14 Brix时桑葚酵素的单位酶活力达到最高,超过14 Brix后,单位酶活力开始逐渐下降。因此选取10 Brix、14 Brix、18 Brix此3个初始糖度水平进行正交试验。

图5 初始糖度对桑葚酵素发酵的影响Fig.5 Effect on mulberry ferment with initial sugar content
2.2.4 发酵时间
发酵时间对桑葚酵素发酵的影响见图6。

图6 发酵时间对桑葚酵素发酵的影响Fig.6 Effect on mulberry ferment with fermentation time
由图6可知,在发酵菌种为醋酸杆菌、初始糖度为6 Brix、接种量为10%、发酵温度为30℃情况下,初始糖度对桑葚酵素的单位SOD酶活力有明显影响;桑葚酵素的单位SOD酶活力随发酵时间的延长,呈先升高后降低的趋势,发酵时间为24 h时,桑葚酵素的单位SOD酶活力达最高。因此选取16、24、32 h此3个发酵时间水平进行正交试验。
2.3 正交试验
依单因素试验结果,选取A发酵温度(28、30、32℃)、B 发酵时间(16、24、32 h)、C 初始糖度(10、14、18 Brix)及D接种量(5%、10%、15%)进行L9(34)正交试验。结果如表1所示。
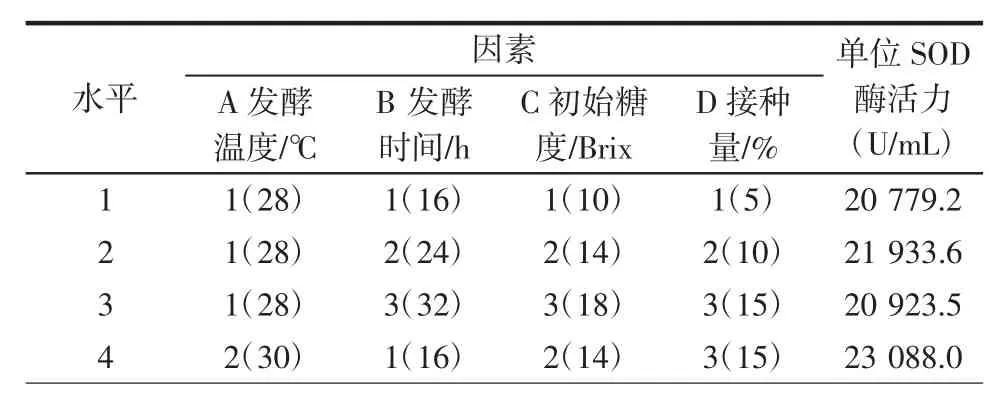
表1 桑葚酵素发酵L9(34)正交试验结果Table 1 Orthogonal experiment results of fermentation for mulberry ferment L9(34)

续表1 桑葚酵素发酵L9(34)正交试验结果Continue table 1 Orthogonal experiment results of fermentation for mulberry ferment L9(34)
桑葚酵素发酵的A发酵温度、B发酵时间、C初始糖度及D醋酸菌接种量4个因素的极差(R)表现为:RA(1587.3)>RC(673.4)>RD(423.9)>RB(336.7),因此影响桑葚酵素发酵的主次影响因素依次为发酵温度、初始糖度、醋酸菌接种量、发酵时间。
k1、k2、k3分别为各因素各水平所对应的单位SOD酶活力的平均值,由表2可知,在 A 因素中,k2>k3>k1;在 B 因素中,k2>k1>k3;在 C 因素中,k2>k3>k1;在 D 因素中,k2>k3>k1。因此,各因素水平对结果影响的强弱顺序是:A2>A3>A1,B2>B1>B3,C2>C3>C1,D2>D3>D1;由此可得出荔枝酵素发酵工艺的最优方案为A2B2C2D2。
综合分析,最终确定桑葚酵素发酵工艺为:发酵温度为30℃、初始糖度14 Brix、醋酸菌接种量为10%、发酵时间为24 h。在此工艺条件下,3次重复验证试验结果为,桑葚酵素的SOD酶活力为24 122.2 U/mL,大于正交试验中的最大值23 088 U/mL。
2.4 桑葚酵素饮料的质量评价
2.4.1 桑葚酵素饮料的感官指标
桑葚酵素饮料感官指标的评价结果见表2。

表2 桑葚酵素饮料的感官评价表Table 2 Sensory evaluation of the mulberry ferment beverage
结果表明,以桑葚为原料采用最佳发酵工艺酿制的桑葚酵素饮料色泽紫红鲜艳,酸味柔和,口感上佳,体态透明清澈无沉淀,具有桑葚果香和醋香。该桑葚酵素饮料感官指标符合及GB/T 30884-2014《苹果醋饮料》[26]等相关标准。
2.4.2 桑葚果汁与桑葚酵素饮料理化成分指标比较
对桑葚酵素饮料中SOD酶活、总酸、总糖、还原糖进行测定,得到桑葚酵素饮料的理化指标,结果见表3。

表3 桑葚果汁与桑葚酵素饮料的理化指标Table 3 Physicochemical indexes of the mulberry juice and the mulberry ferment beverage
桑葚酵素饮料的SOD酶活力为24 122.2 U/mL,比较于桑葚果汁的SOD酶活力(10 818.7 U/mL)提高了123%;总酸为(3.82±0.08)g/L,总糖为(5.37±0.08)%,还原糖为(2.154±0.016)%,符合 GB/T 30884-2014《苹果醋饮料》[26]等相关标准。
2.4.3 桑葚酵素饮料的微生物指标
桑葚酵素饮料微生物指标的评价结果见表4。
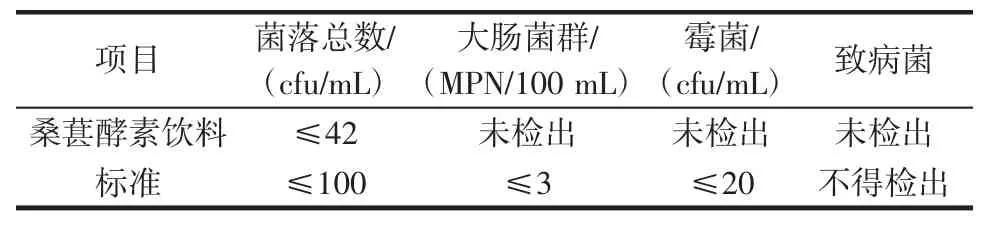
表4 桑葚酵素饮料的微生物指标Table 4 Microbial indicators of the mulberry ferment beverage
表4表明桑葚酵素饮料微生物指标符合GB/T 31121-2014《果蔬汁类及其饮料》[25]及GB/T 30884-2014《苹果醋饮料》[26]等相关标准。
3 结论
本研究以桑葚果汁为原料,SOD酶活力为指标,先从酿酒酵母、醋酸杆菌及植物乳酸杆3种种属中优选出合适菌种组合,然后单因素及正交试验优化了桑葚酵素饮料的发酵工艺。
优化后的桑葚酵素饮料的发酵工艺为:发酵菌种为醋酸菌,初始糖度14 Brix,接种量10%,发酵温度30℃、发酵时间24 h;此工艺条件下制备的桑葚酵素饮料的SOD酶活力达24 122.2 U/mL,比桑葚果汁的SOD酶活力(10 818.7 U/mL)提高了123%;桑葚酵素饮料色泽紫红鲜艳,酸味柔和,口感上佳,体态透明清澈无沉淀,具有桑葚果香和醋香,其感官指标、理化指标及微生物指标符合相关国家标准。