牦牛肉品质相关的去饱和脂肪酶1基因表达差异分析
谢凤莲,孙万成,罗毅皓
(青海大学农牧学院,青海西宁810016)
牦牛是生长在青藏高原地区的一种特有牛种,这 里海拔高,气候寒冷,因此造就了牦牛不同于普通牛种的独特体质,并含有大量的营养成分和丰富的微量元素,特别是含有人体必需的脂肪酸,对人体的健康非常重要,但是牦牛肉比一般牛肉更粗糙且不好吃[1-2]。许多学者认为牦牛肉蛋白质含量高(22.13%),脂肪含量低(3.36%),其营养成分高于黄牛肉、猪肉、羊肉,属“高蛋白、低脂肪”的优质肉[3-4]。去饱和脂肪酶1(stearoyl-CoA desaturase 1,SCD1)是合成单不饱和脂肪酸(monounsaturated fatty acid,MUFA)棕榈油酸和油酸的关键酶,参与泌乳反刍动物肝脏中的脂肪酸生物合成,且SCD1基因在肝脏中高表达[5-6]。大量研究表明,SCD1基因过表达可以增加细胞内MUFA含量和脂质积累,而沉默SCD1基因导致油酸浓度和甘油三酯(triglyceride,TAG)积累的显着降低[7]。牦牛SCD1基因全长序列为1 300 bp,编码359个氨基酸[8],且缺乏SCD1基因的小鼠不能使饱和脂肪酸去饱和,并且避免饮食诱导的肥胖[9]。研究表明,牛乳中超过70%的共轭亚油酸(conjugated linoleic acid,CLA)都是经SCD1催化产生的,SCD1可能影响牛奶中SFAs/MUFAs比率、肌间脂肪沉积和成分,是改善牛奶和牛肉质量的主要候选基因,牛肉肌间脂肪中不饱和脂肪酸含量的提高对于改善牛肉品质和风味也有着重要影响[10]。也有相关研究表明,小鼠的SCD1基因敲除会导致小鼠体内的胆固醇丁酯和甘油三酯的缺乏,棕榈酸、油酸的含量也存在着相应的下降趋势,而棕榈酸酯和硬脂酸的含量却呈上升趋势[11]。敲除小鼠SCD1基因,发现小鼠的耗能会增加,小鼠体内的脂肪沉积减少,并能够加大脂肪酸氧化速度,减少极低密度脂蛋白的分泌,增加从而间接参与脂肪代谢和其生物合成[12]。因此,研究牦牛SCD1基因表达差异,可以探究SCD1基因的调控脂肪酸含量比例的能力,并对牦牛肉品质进行评估,为进一步改善牦牛肉品质提供可借鉴的理论依据。
1 材料与方法
1.1 材料与试剂
1月份、4月份、9月份在青海省西宁市城南马家肴屠宰场,采集现杀的3头公牦牛的肝脏、肾脏、结肠、背最长肌组织(采集样品所用的手术刀、镊子等严格灭菌),迅速装于冷冻管中,保存在液氮罐中,带回实验室后,将样品从液氮罐中取出,保存于-80℃冰箱中,备用。
移液枪和微量吸头、核酸染料(4s red plus nucleic acid stain):上海生物工程技术股份有限公司;RNA提取试剂盒、TaKaRa反转录试剂盒、琼脂糖、荧光定量染料(SYBR Green II):兰州宝生物工程有限公司;牛硬脂酰辅酶A去饱和酶1(SCD1)酶联免疫分析(enzyme linked immunosorbent assay,ELISA)试剂盒:南京翼飞雪生物科技有限公司。
1.2 仪器与设备
电热鼓风干燥箱(DHG-9070A):上海一恒科学仪器有限公司;冷冻离心机(2-16KL):德国SiGMA公司;PCR 仪(Gene AMP PCR System 9700):美国 ABI公司;NanoDrop One/Onec超微量分光光度计(AZY1603147):基因有限公司;电泳仪(JY600):北京君意东方电泳设备有限公司;凝胶成像分析仪(WD-9413A):北京市六一仪器厂;荧光定量仪(CFX96):美国BIO-RAD公司;酶标仪(352型):芬兰 Labsystems Multiskan MS;洗板机(AC8):芬兰 Thermo Labsystems;隔水式恒温培养箱(GNP-9080型):上海精宏实验设备有限公司。
1.3 方法
1.3.1 引物设计
在NCBI数据库中搜索SCD1基因mRNA序列(GenBank登录号为AY241933),通过核心序列设计5'和3'端特异性引物,利用Primer Premier 5.0软件设计引物,引物由生工生物工程(上海)股份有限公司合成。引物信息见表1。

表1 引物信息Table 1 Primer information
1.3.2 样品总RNA的提取和cDNA的合成
组织样品的RNA提取参照试剂盒说明书进行操作。使用Nanodrop One/Onec超微量分光光度计测定RNA样品的OD值(260 nm吸光度值与280 nm吸光度值之比,反映核酸的纯度)和浓度(ng/μL),并在电泳凝胶成像仪上拍照检测RNA的完整性。将提取到的牦牛组织样品的总RNA进行反转录,主要参考TaKaRa反转录试剂盒进行,采用20 μL反转录体系,进行PCR扩增得到cDNA。反转录反应条件如下:37℃,15 min(反转录反应);85℃,5 s(反转录酶的失活反应)。
1.3.3 SCD1基因实时荧光定量聚合酶链式反应
以合成的牦牛组织样品cDNA为模板,按TaKaRa试剂盒推荐方法在冰盒上进行操作。加入引物SCD1F1-SCD1R1进行实时荧光定量聚合酶链式反应(real-time fluorescent quantitative polymerase chain reaction,RT-PCR),同时选择内参 β-actin F1-β-actin R1进行RT-PCR作为对照。两步法PCR扩增标准程序。
1.3.4 酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)反应
ELISA反应按照ELISA试剂盒,应用双抗体夹心法测定标本中牛硬脂酰辅酶A去饱和酶1(SCD1)水平。用纯化的牛硬脂酰辅酶A去饱和酶1(SCD1)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入硬脂酰辅酶A去饱和酶1(SCD1),再与辣根过氧化物酶(horseradish peroxidase,HRP)标记的 SCD1抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物 3,3',5,5'-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)显色。TMB在 HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的硬脂酰辅A去饱和酶1(SCD1)呈正相关。用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中牛硬脂酰辅酶A去饱和酶1(SCD1)浓度。
1.3.5 数据处理与统计学分析
利用SPSS 24.0软件分析试验数据,计量数据用“平均值±标准差”表示,采用ANOVA对试验结果进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 提取的样品总RNA检测
提取出的牦牛肝脏、肾脏、结肠、背最长肌样品的总RNA在质量分数1.2%琼脂糖凝胶上的电泳结果见图1。
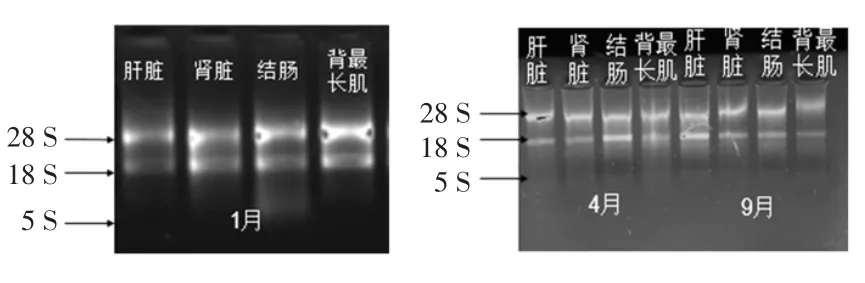
图1样品总RNAFig.1 Sample RNA
由图1可以看到28 S、18 S、5 S三条亮带,且28 S条带亮度大概是18 S条带亮度的2倍。
2.2 SCD1基因cDNA的合成
图2由提取的总RNA反转录后合成cDNA,再通过PCR扩增成DNA得到的电泳图。

图2 SCD1基因cDNA的合成Fig.2 SCD1 genes cDNA synthesis
本试验应用DL2 000的Marker可以看出目的基因在100 bp~250 bp之间。
2.3 牦牛SCD1基因荧光定量分析
不同月份牦牛不同组织间SCD1基因荧光定量见表2。
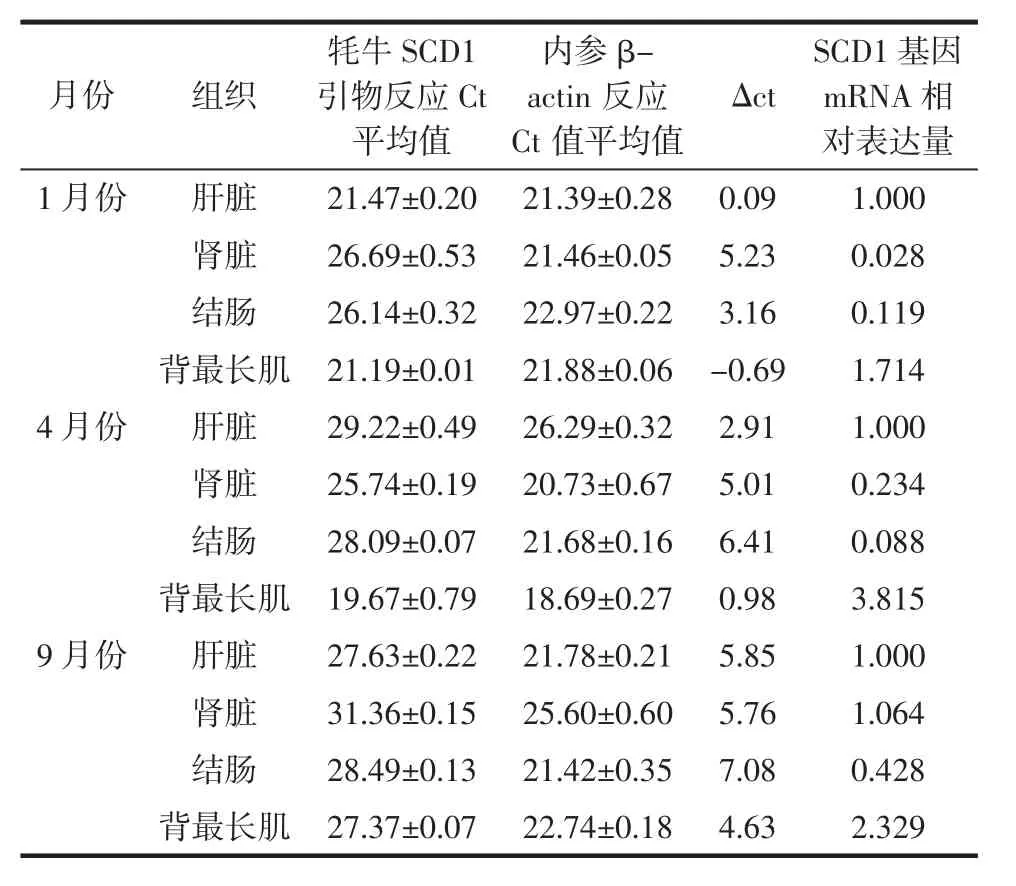
表2 牦牛SCD1基因荧光定量Table 2 Fluorescence quantification of SCD1 gene in yak
通过比较阈值法(2-ΔΔCt)进行相对定量。循环次数(cycle times,Ct)为样品中PCR扩增反应的荧光信号到达设定的域值时所经历的循环数。以牦牛肝脏样品作为对照样,将其2-ΔΔCt值设为1进行阈值比较,根据公式计算:
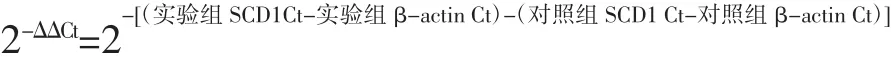
由上述公式计算得到的结果可以得到不同月份SCD1基因相对定量的拷贝数(见图3)。
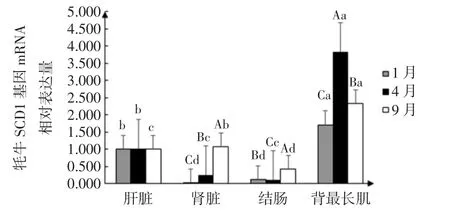
图3 牦牛SCD1基因mRNA相对表达量Fig.3 Relative mRNA expression of yak SCD1 gene
由表2和图3可得以每个月份的牦牛肝脏为对照组,1月份、4月份、9月份牦牛SCD1基因表达量在牦牛肝脏、结肠、肾脏、背最长肌4个组织中均有表达,其中背最长肌组织中mRNA相对表达量最高,且1月份牦牛SCD1基因在各个组织的表达量都低于4月份和9月份,且组织间SCD1基因表达量差异显著(P<0.05)。
2.4 牦牛SCD1蛋白含量分析
不同月份牦牛不同组织间SCD1蛋白含量见表3。

表3 牦牛SCD1蛋白含量Table 3 SCD1 protein content of yak (U/L)
同组织不同月份的牦牛SCD1蛋白含量见图4。
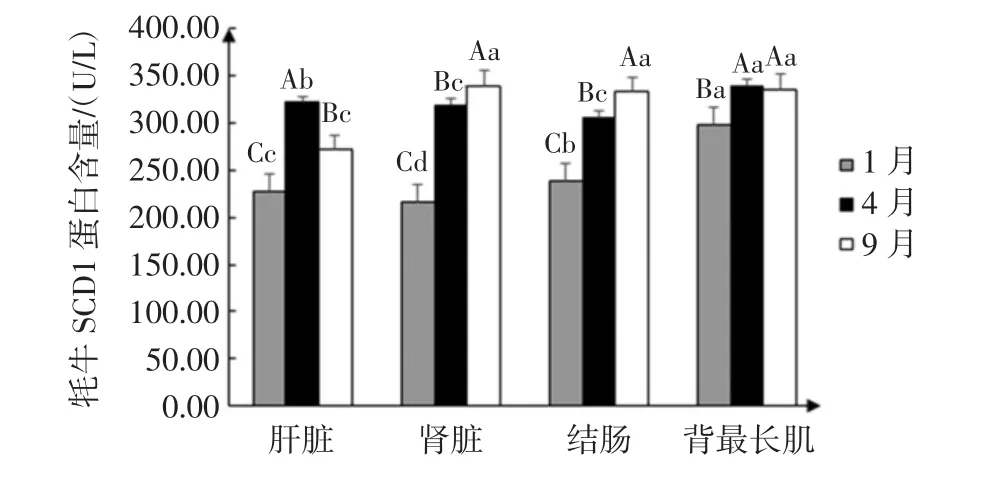
图4 牦牛SCD1蛋白含量Fig.4 SCD1 protein content of yak
由表3和图4可得,以肝脏为对照组,1月份、4月份、9月份牦牛SCD1蛋白含量在背最长肌中的普遍高于对照组,1月份牦牛SCD1基因在各个组织的蛋白含量都低于4月份和9月份,且组织间SCD1蛋白含量差异显著(P<0.05)。
ELISA试验结果与荧光定量PCR结果基本一致,相互印证。因此,牦牛SCD1基因在牦牛肝脏、肾脏、结肠和背最长肌4个组织中均有表达。以牦牛肝脏为对照组,不同月份间,牦牛SCD1基因在背最长肌组织中的表达量和蛋白含量普遍最高,1月份牦牛4个组织中SCD1基因表达量和蛋白含量都较低,不同环境会影响SCD1基因表达。
3 结论与讨论
本研究发现,以牦牛肝脏为对照组,SCD1基因在牦牛肝脏、肾脏、结肠、背最长肌4个组织中均有表达,且SCD1基因表达量和含量在背最长肌组织中最高,差异显著(P<0.05)。说明牦牛SCD1基因不同月份不同组织存在差异性,SCD1基因表达虽然影响肉品质,但是其不是唯一调控肌间脂肪含量的因素。1月份牦牛SCD1基因表达量和SCD1蛋白含量都低于9月份和4月份。青藏高原1月份的气候较4月份和9月份冷,草地枯黄,牦牛饲料缺乏,这可能是导致1月份牦牛SCD1基因表达较低的缘由,说明牦牛SCD1基因的表达可能会受到气候、饲料的影响,且在寒冷季节SCD1基因表达量可能会降低,同时降低了SCD1蛋白含量。有相关研究发现,SCD1的表达和酶活性受生长发育时期、牛品种、营养、激素、外部环境等诸多因素的影响[13-15],高碳水化合物饮食、胰岛素、过氧化物酶和胆固醇直接影响SCD1基因转录[16]。SCD1基因表达水平高,会导致脂肪储存和肥胖,反之,敲除SCD1基因,减少脂肪堆积,并使脂肪酸氧化从而保护饱和脂肪引起的肥胖[17]。也有研究表明,SCD1基因表达量与背最长肌的C16:1、C18:1和UFA含量呈正相关,与MUFA含量呈正相关,与PUFA含量呈负相关,该基因是肉品质评定的候选指标之一[18]。因此进一步研究SCD1基因在牦牛中的表达差异以及相关转录因子对肌间脂肪共同调控机理,可以试图去揭示牦牛高蛋白、低脂肪的机理,为改善牦牛肉营养品质提供理论依据。