人参总蛋白对Aβ25-35诱导SH-SY5Y细胞凋亡的机制研究
郑丽娜,赵大庆,赵文学,乔巨慧,刘颖,刘美辰
(长春中医药大学吉林省人参科学研究院,吉林长春130117)
阿尔茨海默病(Alzheimer’s disease,AD)是发病率最高的神经退行性疾病,以其在老年人群中的高发性和对社会的危害性而备受关注[1]。随着社会人口老龄化的进程,AD有效预防和治疗手段的研发迫在眉睫。AD 的发病机制复杂,β-淀粉样蛋白(amyloid β,Aβ)沉积形成的老年斑及神经原纤维缠结形成是AD典型病理特征[2]。研究表明Aβ可直接或间接对线粒体结构及功能造成损伤,进而诱发氧化应激、激活凋亡信号通路等级联反应[3];另一方面可促进Aβ生成,进一步加重线粒体损伤,从而形成恶性循环,导致神经元变性凋亡。因此,抑制Aβ诱导的线粒体损伤对减轻AD病理损害具有重要意义[4-5]。
天然药物对疾病的干预具有多靶点、低毒性和整体调节的作用优势,已被越来越多的研究人员所关注。其中,人参(Panax ginseng C.A.Mey)为“百草之王”,具有“调神益智”的传统功效,同时现代药理研究也证明了人参中多种活性成分在AD的预防和治疗中具有良好的作用效应[6-10],但其保护作用机制尚不明确。因此,本研究选择人参中主要活性成分——人参水溶性总蛋白,以Aβ25-35诱导SH-SY5Y细胞凋亡作为神经元损伤的体外模型,从细胞水平考察人参水溶性总蛋白对神经元的保护作用;进而利用分子生物学相关实验技术从线粒体功能维系的角度阐明人参总蛋白参与的细胞内调控途径,为研制更为有效的抗AD药物提供理论依据。
1 材料与方法
1.1 试剂
人参水溶性总蛋白(ginseng water soluble total protein,GTP):长春中医药大学中医药大健康创新中心提供,批号2018030701,总蛋白质量分数为83.25%;Aβ25-35:Sigma公司;CCK-8 试剂盒:博士德生物有限公司;细胞凋亡检测试剂盒:BD PharmingenTM;ROS检测试剂盒:Thermo Fisher Scientific;超氧化物歧化酶(superoxide dismutase,SOD) 活力、丙二醛(malondialdehyde,MDA)含量检测试剂盒:南京建成生物工程研究所;ATP检测试剂盒、罗丹明123、BCA蛋白浓度检测试剂盒、Beta-Tubulin内参抗体(β-tubulin rabbit monoclonal antibody,β-tubulin)和细胞色素C抗体(cytochrome C rabbit monoclonal antibody,Cyto C):碧云天生物有限公司;COX IV线粒体内参抗体(Anti-COX IV antibody,COX IV):爱必信生物科技有限公司,B淋巴细胞瘤-2基因抗体(B-cell lymphoma-2,Bcl-2)、Bcl-2相关 X蛋白抗体(Bcl-2 associated X protein,Bax)、甘油醛-3-磷酸脱氢酶抗体(glyceraldehyde-3-phosphate dehydrogensae,GAPDH):abcam 公司(美国)司;磷酸盐缓冲溶液(phosphate buffered saline,PBS):Hyclone 生物有限公司;DMEM/F12 培养基:BI公司;胎牛血清:Gibco公司。
1.2 主要仪器
Infinite M200PR0全自动酶标仪:Tecan公司;Flow Sight多维全景流式细胞仪:Amnis公司;Mini Protean蛋白电泳仪(PowerPacTMHC):Bio-rad公司;371细胞培养箱:Thermo公司。
1.3 细胞培养
人神经母细胞瘤细胞(SH-SY5Y):中国科学院上海细胞库。SH-SY5Y细胞于含10%胎牛血清的DMEM/F12培养液,37℃、5%CO2饱和湿度条件下培养,取对数生长期细胞用于后续实验。
1.4 AD细胞模型的建立
配制Aβ25-35母液,浓度为500μmol/L,于37℃孵育7d以形成聚集形式,即为老化的Aβ25-35。用DMEM/F12全培养基将老化的Aβ25-35稀释至25μmol/L,加入至细胞中培养24h,即获得AD细胞模型。
1.5 实验分组
对照组:DMEM/F12完全培养基正常培养;模型组:加入终浓度为25μmol/L老化的Aβ25-35培养SH-SY5Y细胞24 h;药物干预组:利用不同浓度的人参水溶性总蛋白(6.25、12.5、25μg/mL)预保护 SH-SY5Y 细胞 12 h,随后加入25μmol/L的Aβ25-35共同孵育24 h。
1.6 CCK-8法检测细胞活力
SH-SY5Y细胞接种于96孔培养板,按照实验分组干预处理后每孔加入CCK-8溶液20μL,37℃继续孵育1 h,终止培养,设置空白孔调零,酶标仪上震荡3 min后在450 nm波长处检测各孔OD值,记录并计算细胞存活率。
1.7 细胞凋亡检测
SH-SY5Y细胞接种于6孔培养板,按照实验2分组干预处理后收集细胞,用PBS洗涤细胞3次,1 200 r/min离心5 min,加入 200μL 1×Binding buffer悬浮细胞,之后加入5μL Annexin V-EGFP混匀后,加入5μL Propidium Iodied混匀,室温避光反应15 min,用流式细胞仪检测,激发波长Ex=488 nm,发射波长Em=530 nm。Annexin V-EGFP的绿色荧光通过FITC通道检测,PI红色荧光通过PI通道检测。荧光补偿调节使用未经凋亡诱导处理的正常细胞作为对照进行荧光补偿调节去除光谱重叠和设定十字门的位置。
1.8 胞内ROS水平检测
用无血清DMEM/F12培养基稀释DCFH-DA,终浓度为10μmol/L。细胞培养结束后,弃掉培养液,每孔加入100μL稀释好的DCFH-DA,在37℃的CO2培养箱内孵育20 min。用无血清DMEM/F12培养液轻轻洗涤细胞3次,去除未进入细胞内的DCFH-DA,注意不要将细胞吸出。使用流式细胞仪检测。使用激发波长488 nm,发射波长525 nm,检测药物作用前后荧光的强弱。
1.9 SOD活力和MDA含量检测
将各组细胞匀浆后置于冰上裂解,离心收集上清,使用SOD活力检测试剂盒进行SOD活力检测,MDA含量检测试剂盒测定MDA含量。
1.10 ATP含量检测
SH-SY5Y细胞接种于6孔培养板,按照实验分组干预处理后严格按ATP含量测试盒说明书进行操作,利用紫外分光光度计检测各孔吸光度值,记录并计算ATP含量。
1.11 线粒体膜电位(mitochondrial membrane potential,MMP)分析
SH-SY5Y细胞接种于6孔培养板,按照实验分组干预处理后收集细胞,用PBS洗涤细胞3次,加入罗丹明123使其终浓度为2μmol/L,37℃避光孵育30 min,1 200 r/min离心5 min,弃上清,加入PBS洗涤细胞3次,最后加入200μL PBS重悬细胞,使用流式细胞仪检测,激发波长507nm,最大发射波长529nm,检测药物作用前后荧光强弱。
1.12 蛋白提取和Western blot
SH-SY5Y细胞接种于6孔培养板,按照实验分组处理后收集细胞,PBS洗涤3次,加入细胞裂解液裂解细胞,使用BCA试剂盒测定蛋白含量,制样。SDSPAGE 凝胶配制,上样,70 V 30 min,140 V 50 min电泳后使用NC膜18 V 350 mA半湿法转膜20 min,5%PBS奶粉封闭30 min,PBST洗涤膜片3次,每次5 min,切膜,4℃一抗孵育过夜(β-Tubulin按1∶1 000稀释,COX IV及cyt-c按1∶500稀释),收集一抗,用1%PBS奶粉稀释二抗,二抗孵育1 h,显色处理,避光。
1.13 统计学分析
除特殊说明外,所有研究均进行3次生物学重复,数据以means±SD形式展示。统计学分析应用Graph-Pad Prism6软件完成,组间差异分析应用One-way ANOVA分析方法完成。
2 结果与分析
2.1 人参水溶性总蛋白对Aβ25-35损伤SH-SY5Y细胞的保护作用
GTP对Aβ25-35诱导的SH-SY5Y细胞活力和凋亡的影响见图1。
为了明确GTP对Aβ25-35损伤SH-SY5Y细胞的影响,首先采用CCK-8法检测GTP作用前后细胞活力的改变,如图1A所示,不同浓度的GTP可以减缓Aβ诱导所致细胞活力降低,并呈现浓度依赖性。由图1B和图1C可知,流式细胞术Annexin V/PI双染色定量检测细胞凋亡程度,结果显示GTP预处理可显著降低Aβ25-35诱导的SH-SY5Y细胞凋亡数量,且呈剂量依赖性。
2.2 GTP对Aβ25-35诱导SH-SY5Y细胞氧化应激压力的影响
GTP降低Aβ25-35诱导的SH-SY5Y细胞氧化应激压力见图2。
应用DCFH-DA荧光探针检测Aβ25-35损伤后细胞内ROS生成量。结果可见,Aβ25-35处理可显著增加SH-SY5Y胞内ROS生成量,给予不同浓度GTP预处理,可降低胞内ROS水平(图2A)。同时GTP预处理可降低胞内MDA含量,增加SOD活力(图2B和图2C)。
2.3 GTP对Aβ25-35诱导SH-SY5Y细胞线粒体功能紊乱的挽救
GTP对Aβ25-35诱导SH-SY5Y细胞线粒体功能紊乱的挽救见图3。

图1 GTP对Aβ25-35诱导的SH-SY5Y细胞活力和凋亡的影响Fig.1 Effect of GTP on Aβ25-35induced SH-SY5Y cell viability and apoptosis
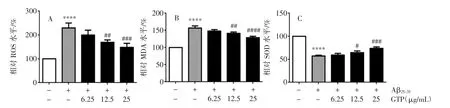
图2 GTP降低Aβ25-35诱导的SH-SY5Y细胞氧化应激压力Fig.2 GTP reduces the oxidative stress induced by Aβ25-35in SH-SY5Y cells

图3 GTP对Aβ25-35诱导SH-SY5Y细胞线粒体功能紊乱的挽救Fig.3 GTP rescue of mitochondrial dysfunction induced by Aβ25-35in SH-SY5Y cells
线粒体在细胞凋亡过程中发挥了重要的调控作用,线粒体膜电位和ATP产生量是衡量线粒体功能的关键指标。结果可见Aβ25-35处理可导致细胞MMP显著降低,而不同浓度GTP预处理可阻止Aβ25-35导致的MMP降低(图3A)。与此同时,GTP预处理可在一定程度上挽救Aβ25-35导致的胞内ATP含量降低(图3B)。以上结果共同证明了GTP对Aβ25-35诱导SH-SY5Y细胞线粒体功能紊乱的挽救作用。
2.4 GTP对 Aβ25-35诱导的SH-SY5Y细胞Bcl-2和Bax表达及细胞色素C释放的影响
GTP对线粒体相关凋亡信号途径关键蛋白表达的影响见图4。
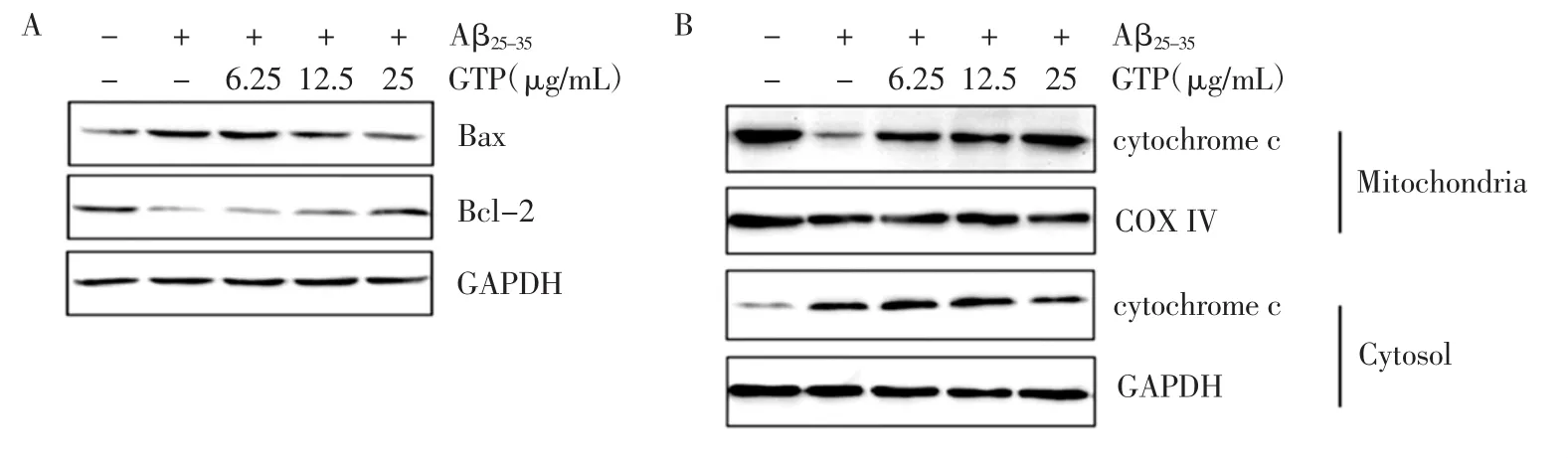
图4 GTP对线粒体相关凋亡信号途径关键蛋白表达的影响Fig.4 Effect of GTP on the expression of key proteins in mitochondria-associated apoptotic signaling pathway
与对照组相比,Aβ25-35建模细胞Bcl-2表达水平显著降低,同时Bax表达上调,与流式细胞技术定量检测结果相一致。给予不同浓度的GTP处理后,Bcl-2表达水平随着GTP浓度的增加逐渐升高,同时Bax表达水平逐渐降低,证明了GTP可通过上调Bcl-2表达、抑制Bax表达,从而对Aβ25-35诱导的SH-SY5Y细胞凋亡起到保护作用(图4A)。细胞色素C从线粒体释放入细胞质中,从而诱发细胞凋亡。结果可见,给予Aβ25-35刺激后,SH-SY5Y细胞质中cyto C含量增加;不同浓度GTP预处理可降低胞质中cyto C含量,证明GTP可抑制cyto C从线粒体向胞质中的释放(图4B)。
3 结论与讨论
Aβ是AD发病机制的核心参与者,其中Aβ25-35是由11个氨基酸组成的较短毒性片段,包含完整蛋白质的β片层[11]。使用Aβ25-35处理SH-SY5Y细胞,细胞活力显著降低,凋亡程度严重增加,首先证明了Aβ25-35对细胞的毒性作用。用GTP预处理则可逆转这些毒性效应,证明GTP对Aβ25-35诱导的细胞毒性具有神经保护作用,对AD可能具有潜在治疗价值。
进一步对GTP的神经保护作用机制进行探讨。Aβ积聚导致神经元过度凋亡,与AD脑内神经元丢失密切相关[12]。研究表明,Aβ25-35可通过诱发细胞产生过量的ROS,增加氧化应激,进而导致线粒体功能障碍[13-14];同时可促进线粒体释放凋亡相关因子,诱发线粒体相关凋亡途径,引起细胞凋亡[15]。研究结果表明,GTP可通过抑制ROS的产生发挥神经保护作用,且GTP预处理可以降低Aβ25-35诱导的线粒体超氧化物升高,减少Aβ25-35暴露后的氧化应激压力。为了进一步明确GTP对线粒体功能的维系作用,研究考察GTP对MMP和ATP水平的影响作用,可见GTP能够显著抑制Aβ25-35损伤导致的MMP降低,同时抑制ATP水平的下降。这些研究结果证明GTP可有效改善Aβ25-35损伤引起的线粒体功能紊乱。Cyto C是线粒体电子传递链的重要组成[16]。正常情况下,其位于线粒体的膜间隙,在凋亡过程中则从线粒体外模释放入细胞质中,cyto C向胞质的释放是引发凋亡的关键步骤[17]。MMP降低和ROS水平的升高均可通过不同作用途径诱导cyto C向胞质的释放[18]。除此之外,其向胞质的释放还依赖于线粒体外膜特异性通道的调控,该通道主要由Bcl-2家族成员形成。其中,Bcl-2(抗凋亡蛋白)和Bax(促凋亡蛋白)是Bcl-2家族的核心成员[19]。Bcl-2的上调可以稳定线粒体外膜,阻断cyto C自线粒体释放入胞质,从而抑制细胞凋亡;而Bax的上调则可以促进cyto C向胞质的释放,诱发凋亡[20]。研究结果显示,不同浓度的GTP预处理不仅可以挽救Aβ25-35诱导导致的MMP降低和ROS水平升高,同时可以上调抗凋亡蛋白Bcl-2的表达、抑制促凋亡蛋白Bax的表达,抑制cyto C从线粒体向胞质中的释放,降低胞质中cyto C含量,降低细胞凋亡,最终对Aβ25-35诱导的SH-SY5Y细胞凋亡起到保护作用。
综上,本研究证明了GTP对Aβ25-35诱导SHSY5Y细胞的保护作用效应,并从线粒体功能维系及线粒体相关凋亡信号途径阐明了作用机制,为抗AD有效药物的研发提供了理论依据。