黄皮果果核挥发油对小鼠黑色素瘤B16-F10细胞增殖和凋亡的影响
廖雪华,甘育鸿,梅思,符伟玉,吴科锋,4,*,李文德
(1.广东医科大学广东天然药物研究与开发实验室,广东湛江524023;2.梅州市人民医院,广东梅州514000;3.广东医科大学生物化学与分子生物学研究所,广东湛江524023;4.广东医科大学南海海洋医药研究院,广东湛江524023;5.广东省实验动物监测所,广东广州510000)
黑色素瘤又称恶性黑色素瘤,是由分布于神经嵴黑色素细胞所形成的痣或色素斑恶化而成,其恶性程度高,具有高度侵袭性,易发生转移,是目前为止导致死亡人数最多的皮肤肿瘤[1-2]。黑色素瘤主要发生在皮肤,但也可发生于眼睛、肠道及体内含有黑色素细胞的任何部分[3-4]。早期黑色素瘤可以通过手术切除达到有效治疗,但中晚期恶性黑色素瘤对常规的放疗、化疗不敏感,缺乏有效的治疗手段[5-6],且常规的化疗药物存在不良反应大,患者依从性差等特点[7]。因此,从天然的中药材中寻找有效的抗黑色素瘤药物成为研究的热点。
黄皮果为芸香科植物黄皮 [Clausena lansium(Lour.)Skeels]的成熟果实,是药食同源的民间药材,其肉、皮和核皆可入药[8]。黄皮果核具有行气止痛、健胃消肿等多方面的生物活性,常用于治疗胃痛、疝痛、痛经和风湿骨痛[9]。大量文献报道,黄皮果挥发油主要成分为萜类、醇类、酯类、酮类及醛类,进一步的研究也指出,该挥发油具有杀虫、抑菌、抗氧化等作用[10-11]。前期研究发现黄皮果核挥发油主要成分为烯醇类,占挥发油成分的56.74%以上,并可改善因紫外线引起的皮肤老化损伤[12],而对于其抗肿瘤活性及其他生物活性的研究鲜见报道。因此希望进一步探究该挥发油抗黑色素瘤细胞增殖作用的影响。
1 材料与方法
1.1 细胞株
小鼠黑色素瘤B16-F10细胞:中国科学院细胞库。
1.2 试剂与仪器
黄皮果核挥发油(essential oil of kernel,EOK):广东医科大学天然药物研究与开发重点实验室保存[12];磷脂酰丝氨酸蛋白抗体/碘化丙啶(Annexin V-FITC/propidiun iodide,Annexin V-FITC/PI) 细胞凋亡检测试剂盒:北京庄盟国际生物基因科技有限公司;0.25%胰酶溶液(1x):吉诺生物医药技术有限公司;超敏ECL(electro-chemi-luminescence)化学发光试剂盒(BeyoECL Plus)、罗丹明 123(rhodamine 123,Rh 123)、放射免疫沉淀(radio immunoprecipitation assay,RIPA)裂解液、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒:碧云天生物技术研究所;胎牛血清、高糖培养基(dulbecco’s modified eagle medium,DMEM)、磷酸盐缓冲液(phosphote buffered soline,PBS):美国 Gibco公司;青霉素-链霉素双抗溶液:广州威佳科技有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]:Sigma 公司;二甲基亚砜(dimethyl sulfoxide,DMSO):美国 SANTA CRUZ公司;十二烷基磺酸钠-聚丙烯酰胺(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE) 凝胶快速配置试剂盒:北京鼎国昌盛生物技术有限公司;预染蛋白标记:美国 Thermo公司;β-肌动蛋白(β-actin)、辣根过氧化物酶标记的二抗、P65、Bcl-2、Bax、Cleaved-caspase 3等一抗:美国SAB公司;一抗稀释液、二抗稀释液:Biosharp公司;0.22 μm聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF):美国 Millipore公司。
IX73型倒置荧光显微镜:Olympus公司;通用水套CO2培养箱:美国Thermo公司;SW-CJ-1D单人单面垂直净化工作台:江苏苏净集团有限公司;HR/T16MM微量高速冷冻离心机:湖南赫西仪器装备有限公司;SHA-B数显恒温水浴震荡器:天津赛得利斯实验分析仪器制造厂;AUW120D型电子分析天平:日本SHI-MADAU公司;迷你双垂直电泳槽、转印系统:美国Bio-Rad公司;Epoch 酶标仪:美国 Bio-Tek;EPICS XL-MCL流式细胞仪:美国BECKMAN COULTER公司。
1.3 方法
1.3.1 黄皮果果核挥发油(essential oil of kernel,EOK)的提取与分离
称取一定量黄皮果核,加水浸泡后采用水蒸气蒸馏法提取挥发油,冷却后收集挥发油。采用冷冻结晶法分离得到液态挥发油。通过气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS) 分析显示,在EOK中检测到33种化合物,其主要化合物是烯醇类,主要成分含量占56.74%。
1.3.2 细胞培养
B16-F10细胞均培养于含10%胎牛血清的DMEM培养基中,置37℃、5%CO2的培养箱中培养。待细胞长至80%左右时,按1∶3或1∶2传代,取对数生长期细胞进行试验。
1.3.3 MTT法检测细胞存活率
取对数生长期的细胞以3.5×103个/孔均匀接种于96孔板,置37℃、5%CO2培养箱,待细胞贴壁后,加入不同浓度的 EOK(0.2、0.4、0.6、0.8 μL/mL),空白组加入等量生理盐水,每组6个复孔,分别孵育24、48、72 h 后吸取上清液,每孔加入 MTT(5 g/L)20 μL,继续培养4 h,随后小心吸出培养液,加入DMSO 150 μL/孔溶解甲鐕,振荡摇匀,结晶完全溶解后,酶标仪于波长570 nm处测量各孔的吸光度(OD值),并计算细胞抑制率。
1.3.4 观察细胞形态
取对数生长期的细胞以2×104个/孔均匀接种于12孔板,置于37℃、5%CO2培养箱中培养至细胞贴壁,将培养基更换为不同浓度的含EOK培养基,在37℃孵育24 h后,将培养液更换为适量的PBS,在显微镜下观察并拍照。
1.3.5 细胞凋亡检测
取对数生长期的细胞以5×104个/孔均匀接种于6孔板,置37℃、5%CO2培养箱培养至细胞贴壁。将培养基更换为不同浓度的含EOK培养基,37℃孵育24 h后,用胰酶消化收集细胞于1.5 mL试管中,在4℃、2 000 r/min条件下离心5 min,弃去上清液,用PBS洗涤2遍。细胞悬浮于500 μL的缓冲液中,添加5 μL磷脂酰丝氨酸蛋白抗体并混匀,再加入碘化丙啶试剂10 μL,室温避光反应15 min,然后在1 h内进行流式细胞仪检测。
1.3.6 线粒体膜电位的检测
取对数生长期的细胞以5×104个/孔均匀接种6孔板,置37℃、5%CO2培养箱培养至细胞贴壁。将培养基更换为不同浓度的EOK培养基,37℃孵育24 h后,用无血清培养基洗涤1次,加入稀释好的Rh123工作液(20 μmol/L)1 mL,置细胞培养箱内继续孵育20 min,PBS洗涤3次,倒置荧光显微镜下观察并拍照。
1.3.7 蛋白免疫印迹试验
RIPA裂解液按试剂盒说明书要求裂解细胞,分离上清液,即细胞总蛋白。BCA法测定蛋白浓度,10%SDS-PAGE凝胶电泳分离蛋白,转膜。将印迹的聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)依次进行封闭、加入对应的一抗、二抗、抗体结合区带加入电化学发光显色液,扫描后保存。以β-actin为内参,分析各组细胞目的蛋白相对表达量。
1.3.8 统计学方法
2 结果与分析
2.1 黄皮果果核挥发油对小鼠黑色素瘤B16-F10细胞增殖抑制的影响
通过MTT法检测EOK对小鼠黑色素瘤细胞B16-F10细胞的抗增殖活性,结果如图1所示。
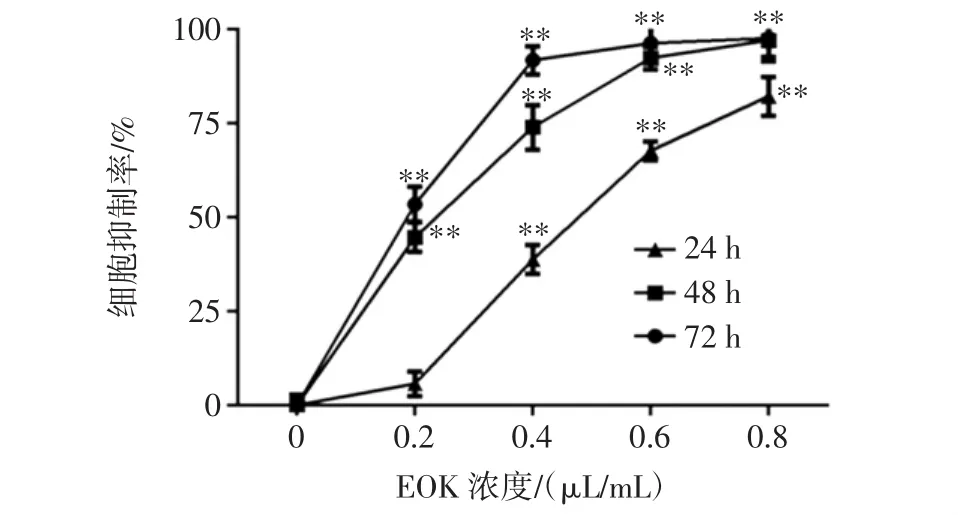
图1 EOK对B16-F10细胞增殖的影响Fig.1 Effect of EOK on the growth of B16-F10 cells
当挥发油浓度为0.2 μL/mL,作用24 h后,对小鼠黑色素瘤B16-F10细胞的抑制率为(5.67±3.25)%,但差异无统计学意义;当作用48、72 h后,抑制率分别为(44.65±3.96)%、(53.39±4.70)%(P<0.01)。当药物浓度分别为0.4、0.6、0.8 μL/mL时,随着作用时间的增加,细胞增殖抑制率明显升高,且呈现浓度依赖性和时间依赖性。由此可见,EOK对小鼠黑色素瘤B16-F10细胞具有明显的增殖抑制作用。
2.2 黄皮果果核挥发油对细胞形态影响
EOK处理24 h对B16-F10细胞形态变化的影响结果见图2。
图2显示,对照组细胞贴壁状态良好,紧密排列,呈不规则梭形(图2A);与对照组相比,EOK作用24 h后,0.2 μL/mL、0.4 μL/mL 组细胞变长,细胞间隙增大,呈现树突网状结构,且有黑色颗粒物;随着药物浓度的增加,细胞数量逐渐减少,细胞形态也骤变,0.8 μL/mL细胞体积明显缩小,呈现固缩的圆形结构,黑色颗粒物不明显,漂浮在细胞培养液中的细胞增多。从形态方面预示着B16-F10细胞处于凋亡状态。

图2 EOK处理24 h对B16-F10细胞形态变化的影响Fig.2 EOK deal with the effect of 24 h on the morphological changes of B16-F10 cells
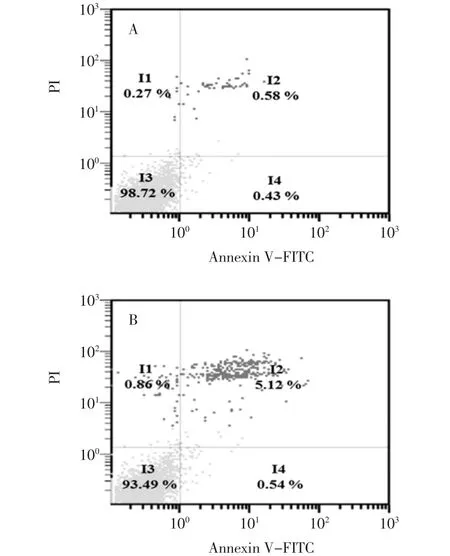
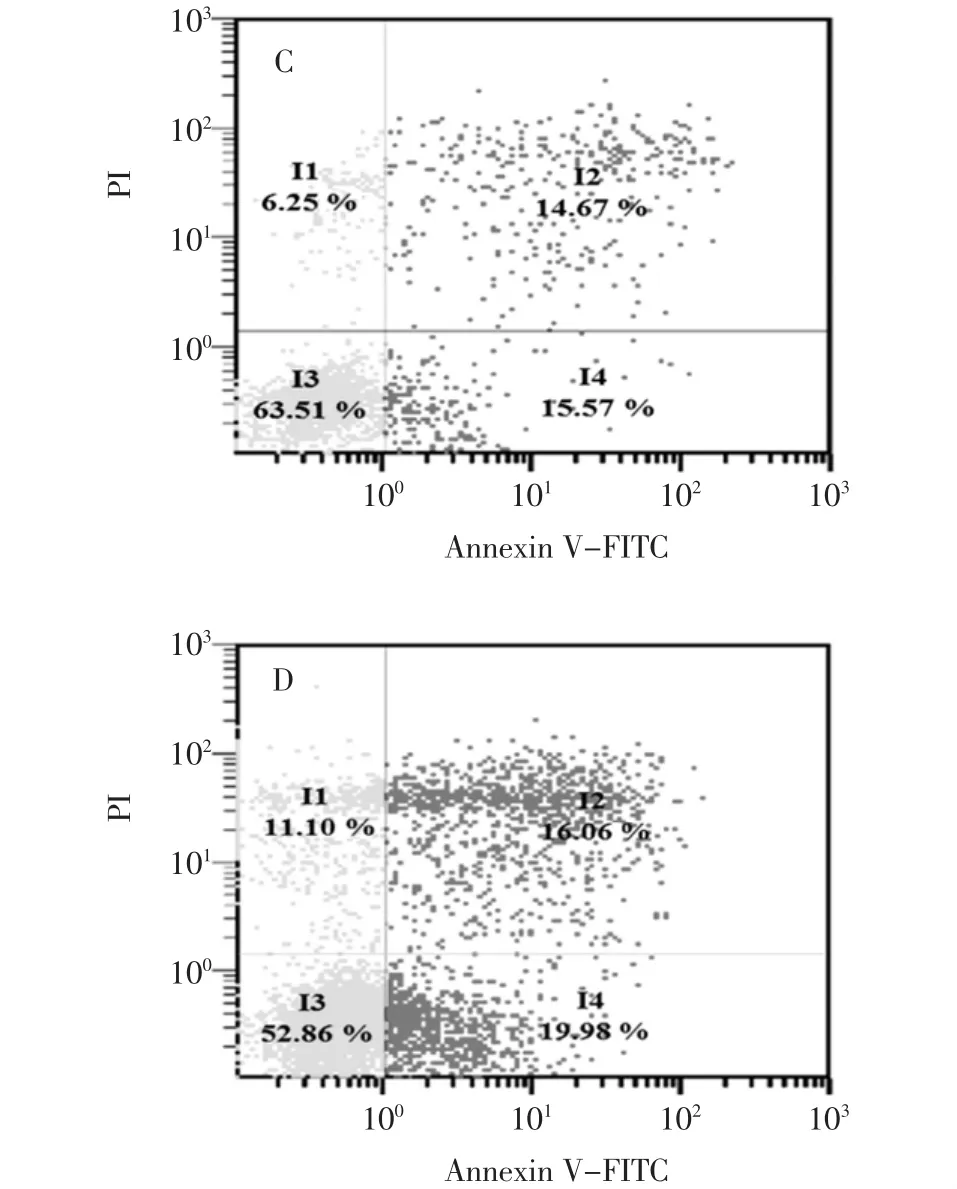
图3 Annexin V-FITC/PI双染的流式细胞术检测细胞凋亡率Fig.3 Apoptosis rate of B16-F10 cells detected by flow cytometric analysis
2.3 黄皮果果核挥发油对B16-F10细胞凋亡的影响
Annexin V-FITC染色观察B16-F10细胞凋亡情况见图3。
细胞凋亡的检测方法有很多中,各有其特点。流式细胞术检测细胞凋亡,具有快速、灵敏度高、可以定量等优点。其中Annexin V-FITC/PI双标记染色最为常用。磷脂酰丝氨酸(phasphatidylserine,PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,由于细胞膜失去对称性,PS可从细胞膜的内侧翻转至细胞膜的表面,暴露在细胞外环境中。磷脂结合蛋白V(Annexin V)是一种钙依赖的磷脂结合蛋白,它与PS高亲和力特异性结合。荧光素FITC标记的Annexin V可作为探针检测暴露在细胞膜外侧的的PS,指示凋亡细胞,但坏死细胞PS也会显露在外表使Annexin V-FITC结合成阴性,必须加入碘化丙啶(propidiun iodide,PI)才能区分坏死细胞[13-14]。碘化丙啶是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能通过细胞膜而使细胞核着色。流式细胞仪分析结果显示,与对照组(图3A)比较,随着EOK浓度的增加,凋亡比例也随着增加,其诱导B16-F10细胞凋亡率分别为5.66%、30.34%、36.04%。这表明EOK能诱导B16-F10细胞凋亡。
2.4 黄皮果果核挥发油对B16-F10细胞线粒体膜电位(mitochondrial membrane potential,MMP)的影响
罗丹明123(rhodamine 123)是一种可透过细胞膜的阳离子荧光染料,是一种线粒体跨膜电位的指示剂。其在正常细胞中能够依赖线粒体跨膜电位进入线粒体基质,荧光强度减弱或消失。而在凋亡发生时,线粒体膜完整性破坏,线粒体膜通透性转运孔开放,引起线粒体跨膜电位(ΔΨm)的崩溃,Rh123重新释放出线粒体,从而发出强黄绿色荧光,因此可以根据相对荧光信号的强度来衡量MMP的变化[15]。荧光染色法检测B16-F10细胞线粒体膜电位水平见图4。
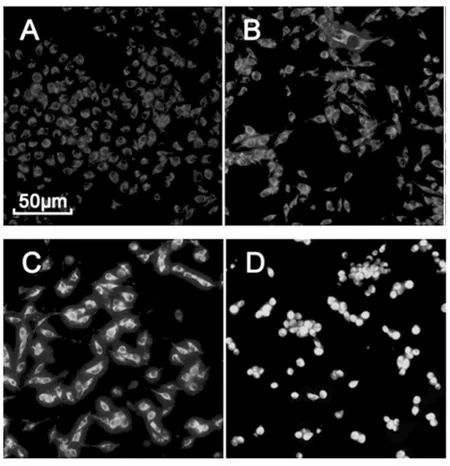
图4 荧光染色法检测B16-F10细胞线粒体膜电位水平Fig.4 Detection of mitochondrial membrane potential level of B16-F10 cells by fluorescent staining
从图4中可以看出,EOK处理24 h后,与对照组比较,药物处理组细胞内的荧光明显增强,而且随着浓度增大而增强,高浓度组所发荧光非常显著,说明线粒体膜完整性可能已破坏,引起ΔΨm的崩溃,并随药物浓度的不同而使MMP出现不同程度的受损。结果表明EOK诱导细胞凋亡与抑制线粒体膜电位密切相关。
2.5 黄皮果果核挥发油对B16-F10细胞凋亡相关蛋白的影响
NF-κB是一类具有多向转录调节作用的核蛋白因子,在细胞胞浆内是以无活性形式存在,通过I-B激酶(IK)激活后,受抑制的NF-κB得以释放,发生核移位,在核内积累并与特异性的B序列相结合启动转录。核转录因子NF-κB的下调,可促使与抗凋亡相关的NF-κB靶基因如TNF受体相关因子1等表达减弱,从而促进凋亡。NF-κB也可调控Bcl-2家族中两个抗凋亡蛋白:Bfl-1/A1、Bcl-X1的表达,也诱导Bcl-2和抑制Bax基因表达[16-17]。而Bcl-2与Bax这两种蛋白参与构成线粒体通路,分别具有抑制和促进细胞凋亡的作用,Bax/Bcl-2蛋白比值决定了细胞的生存和死亡。凋亡通路相关蛋白Bcl-2/Bax/caspase 3被激活,Bax/Cleaved-caspase 3蛋白表达增加,而Bcl-2蛋白被抑制,是经典的线粒体凋亡途径[18]。
EOK 对 B16-F10 细胞 NF-κB(P-P65)、NF-κB(P65)蛋白表达的影响结果见图5。
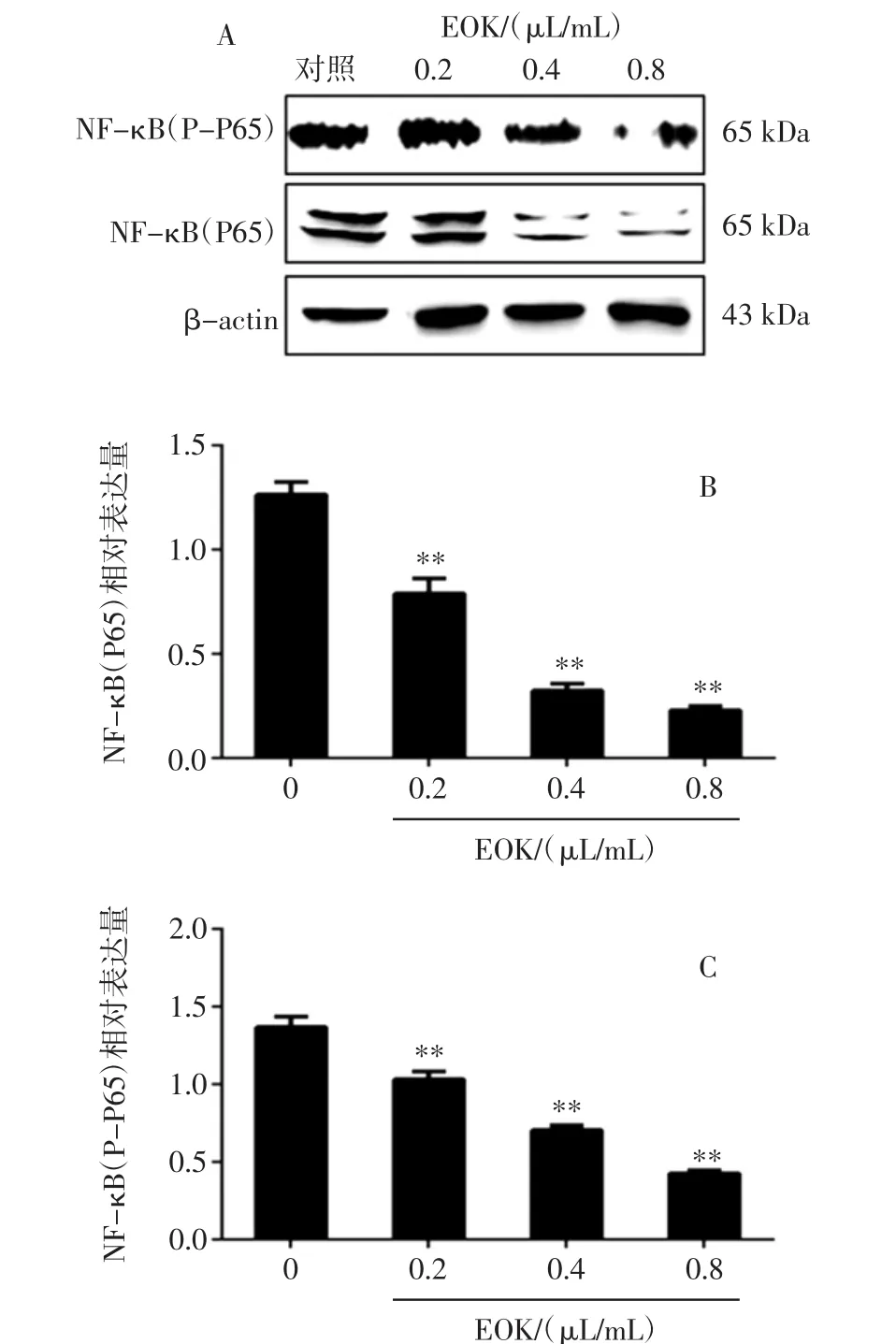
图5 EOK 对 B16-F10 细胞 NF-κB(P-P65)、NF-κB(P65)蛋白表达的影响Fig.5 Effect of EOK on NF-κB(P-P65)and NF-κB(P65)protein expression in B16-F10 cells
从图5中可以看出,与对照组相比,随着黄皮果果核挥发油浓度的增加,NF-κB(P-P65)与 NF-κB(P65)蛋白表达均下调,其中在浓度0.2 μL/mL作用下蛋白表达量有所减少(P<0.01);且对 NF-κB(P65)蛋白表达的抑制作用比对NF-κB(P-P65)蛋白表达的抑制作用更为明显。同时检测Bcl-2和Bax蛋白的表达情况,结果如图6所示。
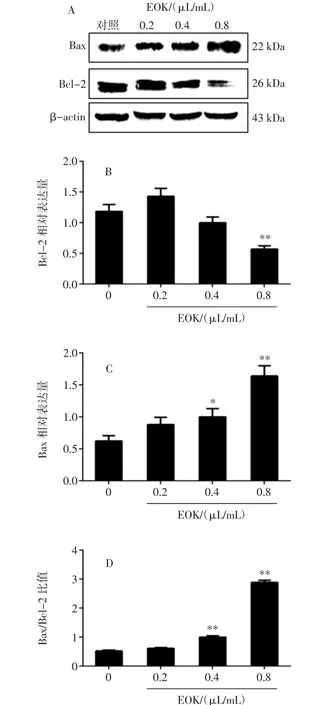
图6 EOK对B16-F10细胞Bax、Bcl-2蛋白表达的影响Fig.6 Effect of EOK on Bax and Bcl-2 protein expression in B16-F10 cells
与对照组相比,随着果核挥发油浓度的增大,Bax蛋白表达增多,其中0.4、0.8 μL/mL组尤为明显(P<0.05或 P<0.01);而 Bcl-2 蛋白表达在 0.8 μL/mL 组减少尤为明显(P<0.01)。通过统计,Bax/Bcl-2的比值增大,0.4、0.8 μL/mL组与对照组比较差异有统计学意义(P<0.01)。
对B16-F1细胞Cleaved-caspase 3蛋白表达的影响结果见图7。
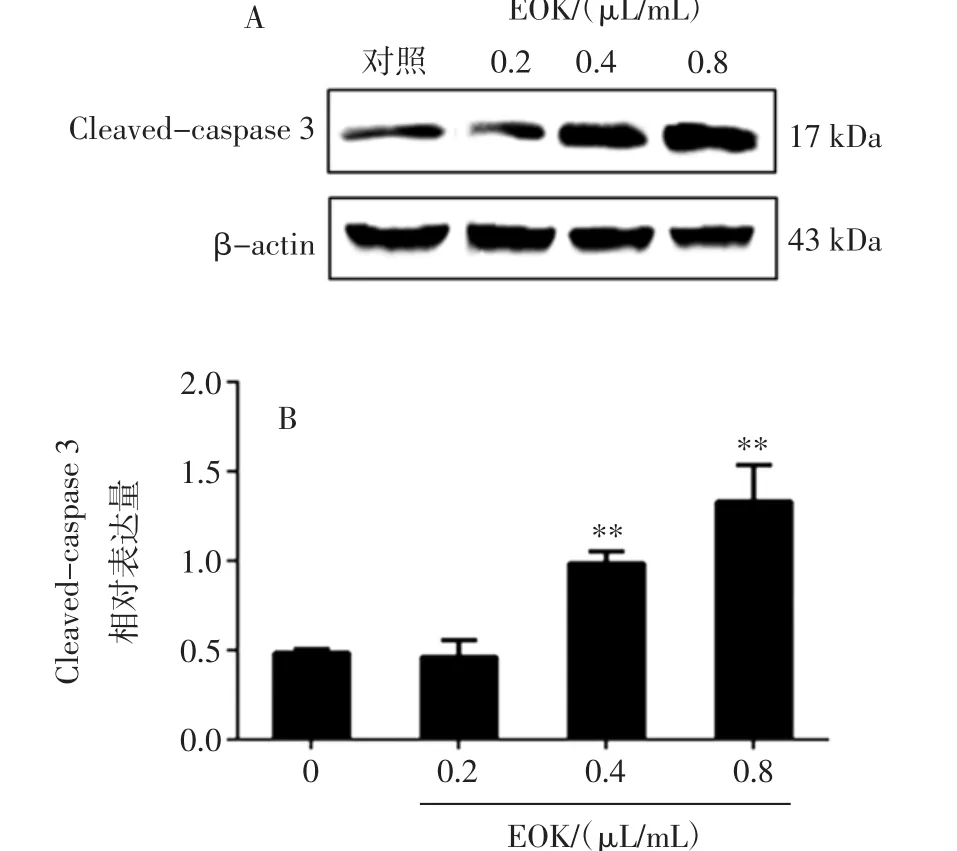
图7 EOK对B16-F10细胞Cleaved-caspase 3蛋白表达的影响Fig.7 Effect of EOK on Cleaved-caspase 3 protein expression in B16-F10 cells
如图7所示,黄皮果果核挥发油也能上调Cleaved-caspase 3蛋白的表达。与对照组相比,0.4、0.8 μL/mL 组差异有统计学意义(P<0.01)。这些结果表明,线粒体途径参与黄皮果果核挥发油诱导B16-F10细胞的凋亡,其机制可能与抑制胞内NF-кB P65蛋白表达,降低其磷酸化水平,激活Bcl-2/Bax/caspase 3信号通路有关。
3 结论
水蒸气蒸馏法提取的黄皮果核挥发油作用于小鼠黑色素瘤B16-F10细胞后,MTT法测定药物浓度≥0.2 μL/mL时,黄皮果核挥发油对B16-F10细胞增殖有明显的抑制作用。Annexin V-FITC/PI染色结果表明,在黄皮果核挥发油作用24 h后,0.8 μL/mL组凋亡细胞的比例高达36.06%。在罗丹明123染色检测黄皮果核挥发油对B16-F10细胞线粒体膜电位有显著影响,且随着药物浓度增大,荧光强度增强。蛋白免疫印迹结果表明,黄皮果核挥发油能下调NF-κB(PP65)、NF-κB(P65)、Bcl-2 的表达,同时上调 Bax、Cleaved-caspase 3的表达。因此,试验结果表明:黄皮果果核挥发油以诱导细胞凋亡的方式抑制小鼠黑色素瘤B16-F10细胞增殖,其机制与抑制胞内NF-кB P65蛋白表达,降低其磷酸化水平,激活Bcl-2/Bax/caspase 3信号通路有关。