醒脑静注射液对脓毒症大鼠急性肾损伤的改善作用及机制▲
杨 妮 郑少微 张 瑞 周 阳 赵翊迪 张正良
(西安交通大学第二附属医院,陕西省西安市 710000,电子邮箱: yangni200607@163.com)
急性肾损伤是脓毒症的常见并发症之一,具有较高的患病率与死亡率[1]。近来研究表明,脓毒症患者体内积聚的内毒素会诱导机体免疫系统产生过量的内源性炎症介质,而这些炎症介质则是导致患者发生急性肾损伤的主要病因,同时细胞凋亡、自噬、线粒体功能障碍、氧化应激等则是造成肾功能损伤的主要因素[1-4]。醒脑静注射液是以安宫牛黄丸为底方提炼而成的新型中药注射剂,能透过血脑屏障起到调节中枢神经功能和改善微循环的作用,其治疗脓毒症的疗效也已不断得到临床证实[5-6]。研究表明,醒脑静注射液对脓毒症患者的肝脏以及心肌损伤均具有改善作用,然而其对脓毒症所致急性肾损伤的改善作用与机制并不明确[7-8]。本研究建立脓毒症急性肾损伤大鼠模型,分析醒脑静注射液的治疗作用,并建立肾小管上皮细胞体外模型,探究醒脑静注射液在脓毒症急性肾损伤中减轻细胞凋亡、炎性反应等的作用机制,为深入了解中药制剂醒脑静注射液的药理机制提供依据。
1 材料及方法
1.1 实验动物与细胞 90只雄性SD级大鼠(体重220~250 g)购自西安交通大学医学实验动物中心[生产许可证号:SYXK(陕)2018-001]均为8周龄,自由饮食。肾小管上皮细胞由我院中心实验室保存。
1.2 主要试剂 醒脑静注射液(无锡济民可信山禾药业股份有限公司,规格2 mL/支,国药准字H37022632,批号:1201091);大肠杆菌脂多糖(Sigma公司,批号:017M4112V)、核因子κB (nuclear factor kappaB,NF-κB)激活剂佛波醇脂(美国Sigma公司,批号:016P21120);B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)相关X蛋白(B-cell lymphoma-2 associated X protein,Bax;批号:17082533)、Bcl-2(批号:16112411)、NF-κB(批号:17031470)、β肌动蛋白 (批号:17024502)、核纤层蛋白(Lamin)B1 (批号:17050061)一抗、羊抗兔二抗(批号:17044613)均购自上海酶联生物研究所;细胞凋亡检测试剂盒(上海碧云天生物技术有限公司,批号:C1062);肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-6酶联免疫吸附实验试剂盒(美国BioSource公司,批号:BO32822A、BO40412D);肌酐测定试剂盒(北京北化康泰临床试剂有限公司,批号:20170130);尿素氮测定试剂盒(北京北化康泰临床试剂有限公司,批号:20170826);核蛋白提取试剂盒(上海贝博生物科技有限公司,批号:BB-319811);总蛋白提取试剂盒(上海贝博生物科技有限公司,批号:BC-307702)。
1.3 大鼠脓毒症急性肾损伤模型实验
1.3.1 脓毒症急性肾损伤大鼠模型制备与干预:将90只大鼠按随机数字表法随机分为模型组、处理组、对照组,每组30只。参照国内学者提出的方法[9-11]建模。用生理盐水将脂多糖制成浓度为1 mg/mL的脂多糖溶液,按照10 mg/kg剂量,对模型组、处理组大鼠腹腔注射脂多糖溶液制备脓毒症模型,对照组大鼠腹腔注射等体积生理盐水。造模后通过观察大鼠呼吸频率、皮温、心率、口鼻分泌物、精神状态等判断造模成功与否。确定造模成功后,处理组大鼠腹腔注射醒脑静注射液(剂量6.4 mL/kg)12 h后,对照组与模型组大鼠腹腔注射等体积生理盐水。观察各组大鼠生存状况。
1.3.2 血液及组织标本的采集与处理:分别于腹腔注射醒脑静或生理盐水后6、12、24 h,各组麻醉处死10只大鼠。无菌采集腹主动脉血约10 mL,常温下3 000 r/min离心15 min,-20℃保存血清。无菌留取肾组织,-20℃密封。
1.3.3 肾功能的评估:取各组血清样本,采用相应试剂盒,使用自动生化分析仪(贝克曼库尔特AU680型)检测样本中血清肌酐、尿素氮。
1.4 肾小管上皮细胞模型建立及分组干预 将肾小管上皮细胞培养于含10%胎牛血清的杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)中,融合至80%时,以无血清培养基于37℃、5%CO2条件下培养细胞24 h后,以5 mg/L脂多糖溶液处理细胞8 h,构建细胞模型。将模型细胞分为模型组、处理组、NF-κB激活组。处理组细胞加入200 μL醒脑静注射液(50 ng/mL),NF-κB激活组细胞先以200 μL醒脑静注射液(50 ng/mL)预处理6 h,再加入2 μL NF-κB激活剂佛波醇酯(终浓度1 μmol/L)共同处理细胞,模型组细胞不做处理。各组细胞培养时间均为48 h后。
1.5 炎性因子检测 采用酶联免疫吸附法检测各组大鼠肾组织(经匀浆处理后)及处理后培养48 h的培养上清液中炎性因子TNF-α、IL-6水平,严格按照试剂盒说明书进行操作。
1.6 蛋白质印迹法检测 取各组大鼠肾组织以及处理后培养48 h的各组细胞,提取组织的总蛋白及细胞的核蛋白,经聚丙烯酰胺凝胶电泳后转膜、封闭,一抗(1 ∶1 000)4℃过夜孵育,洗膜后与二抗(1 ∶500)室温孵育1 h,采用增强化学发光法显色,分析蛋白条带灰度值,检测肾组织的Bax和Bcl-2蛋白的相对表达量,以及细胞的NF-κB蛋白的相对表达量。严格按照试剂说明书进行操作。
1.7 细胞凋亡检测 取各组处理后培养48 h的细胞,调整密度至1×106个/mL,以异硫氰酸荧光素(0.5 μg/mL)和碘化丙啶(0.6 μg/mL)进行双染色,严格按照试剂说明书进行操作。流式细胞仪(贝克曼库尔CytoFLEX S型)分析细胞凋亡情况。
1.8 统计学分析 采用SPSS 16.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用方差分析,以Bonferroni法进行两两比较。以P<0.05为差异具有统计学意义。
2 结 果
2.1 3组大鼠一般状况及血清肌酐、尿素氮水平 模型组大鼠出现明显的脓毒症症状:呼吸、心率显著增加,精神萎靡,少动,口鼻分泌物增多,尿色加深,出现血尿;处理组大鼠与模型组相比症状明显减轻。3组间肌酐及尿素氮水平比较,差异均有统计学意义(F组间=231.001,P组间<0.001;F组间=118.201,P组间<0.001),其中在干预后6 h、12 h、24 h,模型组、处理组的肌酐值及尿素氮均高于对照组(均P<0.05),处理组的肌酐值及尿素氮值均低于模型组(均P<0.05);肌酐及尿素氮水平均有随时间变化的趋势(F时间=218.301,P时间<0.001;F时间=494.603,P时间<0.001);肌酐及尿素氮的分组与时间有交互效应(F交互=55.350,P交互<0.001;F交互=155.003,P交互<0.001)。见表1。

表1 3组大鼠血清肌酐与尿素氮水平的比较(x±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05。
2.2 3组大鼠肾组织炎性水平比较 3组间TNF-α及IL-6水平的比较,差异均有统计学意义(F组间=558.101,P组间<0.001;F组间=84.080,P组间<0.001),其中,在干预后6 h、12 h、24 h,模型组、处理组的TNF-α及IL-6均高于对照组(均P<0.05),处理组的TNF-α及IL-6均低于模型组(均P<0.05);TNF-α及IL-6均有随时间变化的趋势(F时间=81.730,P时间<0.001;F时间=375.041,P时间<0.001);TNF-α及IL-6的分组与时间有交互效应F交互=28.870,P交互<0.001;F交互=170.300,P交互<0.001)。见表2。

表2 3组大鼠肾组织中炎性因子TNF-α、IL-6水平的比较(x±s,pg/mL)
注:与对照组比较aP<0.05;与模型组比较bP<0.05。
2.3 3组大鼠肾组织凋亡相关蛋白的表达以及细胞凋亡率比较 处理组、模型组大鼠肾组织中Bax水平较对照组增高,而Bcl-2水平则降低(P<0.05);处理组Bax水平较模型组降低,Bcl-2水平较模型组升高(P<0.05),见图1与表3。模型组细胞凋亡率较对照组增加,而处理组细胞凋亡率则较模型组下降(均P<0.05),见图2与表4。

图1 3组大鼠肾组织中Bax、Bcl-2表达水平的比较

表3 3组大鼠肾组织中Bax、Bcl-2蛋白相对表达水平(x±s)
注:与对照组比较aP<0.05;与模型组比较bP<0.05。
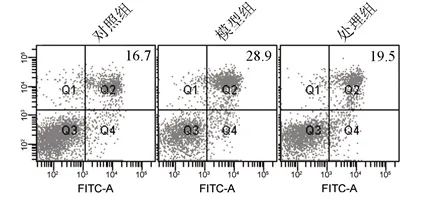
图2 3组细胞凋亡水平的比较

表4 3组细胞凋亡率(x±s,%)
注:与对照组比较aP<0.05;与模型组比较bP<0.05。
2.4 3组肾小管上皮细胞的凋亡率及炎症因子水平比较 NF-κB激活组、处理组细胞 NF-κB量、TNF-α、IL-6水平及细胞凋亡率较模型组降低 ,而NF-κB激活组NF-κB组、TNF-α、IL-6水平较处理组升高(P<0.05),见图3、图4与表5。
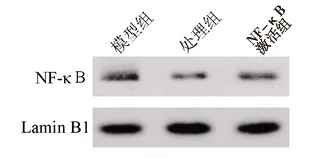
图3 3组细胞中NF-κB水平的比较
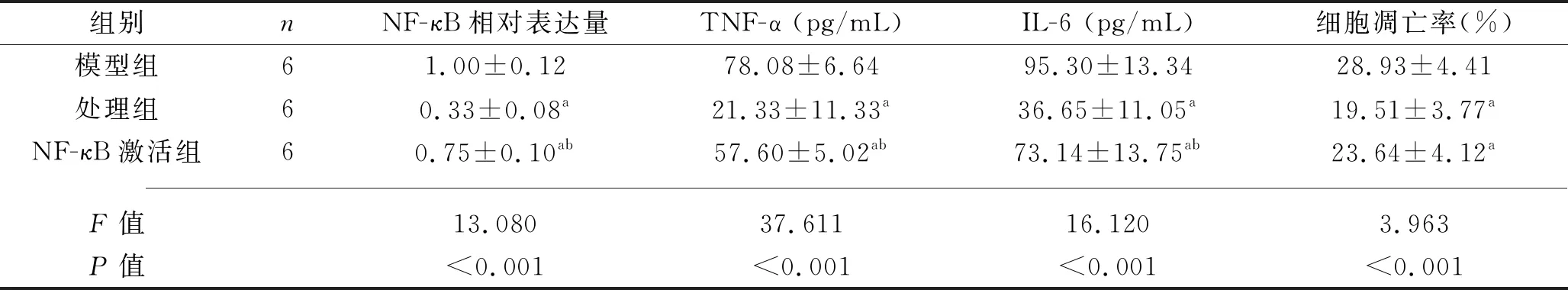
表5 3组细胞中NF-κB、TNF-α、IL-6水平及细胞凋亡率比较(x±s)
注:与模型组比较aP<0.05;与处理组比较bP<0.05。

图4 3组细胞凋亡率的比较
3 讨 论
醒脑静注射液是由天然麝香、冰片等中药材提炼而成的中药注射剂,对于多种病因引发的脑损伤、意识障碍、急性酒精中毒等均具有显著疗效[6,12-15]。研究表明,醒脑静注射液可有效降低脓毒症大鼠脑、心脏以及肝脏组中织线粒体的氧化应激水平,提高机体对氧自由基的清除能力,并能抑制TNF-α、IL-1、IL-6等细胞炎性因子水平,从而减轻脓毒症引起的脑、肝脏以及心肌损伤[7-8,16]。然而醒脑静注射液是否也能够改善脓毒症引起的急性肾损伤,目前尚未明确,相关作用机制的研究也较少。本研究结果显示,模型组及处理组大鼠均出现脓毒症症状,且血清肌酐值及尿素氮水平均高于对照组(均P<0.05),提示脓毒症大鼠模型建立成功,且大鼠均出现了急性肾功能损伤;但处理组大鼠的脓毒症症状轻于模型组,且在干预后6 h、12 h、24 h其血清肌酐及尿素氮水平均低于模型组(均P<0.05),提示醒脑静注射液可改善大鼠脓毒症症状,并减轻其肾功能损伤。
肾脏上皮细胞凋亡及大量炎性因子的释放是引发脓毒症急性肾损伤的主要病理生理基础[17-18]。TNF-α、IL-1、IL-6等大量前炎症因子的形成,可引发黏附分子、血小板活化因子、前列腺素E2、白细胞三烯等的过量产生和活化,导致微血管功能紊乱、通透性增加,引起肾灌注不良、肾内血流异常、肾组织炎性细胞浸润,造成肾小管和肾小球功能障碍和结构损伤[19-20]。而发生脓毒症时凋亡相关因子Bax的表达水平增高,凋亡抑制因子Bcl-2的表达量降低,从而引起肾脏细胞凋亡,直接导致肾脏损伤[21-22]。既往研究表明,干预细胞凋亡可减轻肾脏的损伤程度[23],这为脓毒症所致肾损伤提供了新的治疗策略。目前,关于醒脑静注射液对细胞凋亡调控作用的研究主要集中在神经细胞领域,其在神经细胞凋亡的诱导启动、凋亡相关因子表达活化、凋亡过程的执行等多个环节均能发挥抑制作用,从而抑制神经细胞凋亡,对脑损伤发挥保护作用[24]。本研究结果显示,干预后对照组、处理组、模型组大鼠肾组织的炎性因子TNF-α、IL-6水平以及Bax蛋白表达水平均依次升高,而Bcl-2蛋白表达水平则依次降低(P<0.05)。这提示醒脑静注射液能显著抑制体外脂多糖诱导的炎性因子水平及肾小管上皮细胞的凋亡,其对脓毒症所致急性肾损伤的改善作用,可能与其抑制炎性因子过度产生及肾脏细胞凋亡密切相关。
核转录因子NF-κB在脓毒症的发生发展过程中也具有重要作用:静息状态下,NF-κB于细胞质中与抑制因子相结合并处于无活性状态;当抑制因子被磷酸化降解,NF-κB得以释放并转移至细胞核,发挥调控基因表达的作用[25-26]。研究表明,发生脓毒症急性肾损伤时,近端肾小管中NF-κB表达显著增强,NF-κB能够上调TNF-α、IL-6、IL-8等炎性因子水平而加重肾脏炎症反应,并对细胞凋亡过程具有促进作用,同时参与内毒素等所引发的肾损伤过程[27-30]。有学者报告醒脑静注射液可通过调控NF-κB信号通路,从而减轻脓毒症大鼠模型的心肌损伤程度[31]。余文静等[32]发现,醒脑静注射液也能通过抑制Toll样受体4/NF-κB通路的活化,对内毒素休克引起的肾损伤发挥保护作用。本研究结果显示,NF-κB激活组、处理组细胞 的NF-κB、TNF-α、IL-6水平及细胞凋亡率均较模型组降低 ,且处理组细胞的NF-κB、TNF-α、IL-6水平低于NF-κB激活组(P<0.05)。这提示醒脑静注射液可抑制脂多糖诱导的NF-κB活化,进而抑制肾小管上皮细胞的凋亡及炎性反应。
综上所述,醒脑静注射液可减轻脓毒症大鼠的症状及急性肾损伤,这可能与其调控NF-κB活性,从而抑制肾小管上皮细胞的凋亡及炎性因子的释放有关。

