人成纤维样滑膜细胞原代培养的改良方法▲
(武汉大学人民医院骨外科,湖北省武汉市 430060,电子邮箱:1032759008@qq.com)
骨关节炎(osteoarthritis,OA)是一种常见的关节退行性疾病,其特点是软骨损伤、骨赘形成、软骨下骨硬化和关节周围组织退变[1],临床上主要表现为关节肿痛、僵硬、活动受限,严重者甚至残疾。OA的病因主要有生物力学因素、年龄、肥胖、关节损伤等。随着社会人口老龄化进程的加速,OA的患病率逐年升高,已成为当今严重的社会医学问题之一。研究OA的病因、发病机制及防治方法具有极其重要的价值。OA病损不仅累及关节软骨,还可累及整个滑膜关节器官,包括半月板,滑膜、韧带、关节囊、软骨下骨及肌肉[2-3],其中滑膜还参与OA的软骨退变过程[4]。在OA的早期阶段即存在滑膜炎,而在OA的进展过程中滑膜组织出现增生和肥大。研究表明成纤维样滑膜细胞在OA的发病机制中起重要作用,其可以通过分泌炎性细胞因子[肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),白细胞介素-1β(interleukin-1β,IL-1β)]和基质金属蛋白酶(matrix metalloproteinase,MMP)促进滑膜炎和软骨退变[5-6]。因此,通过体外分离培养获得原代成纤维样滑膜细胞,研究其在正常条件下的形态和功能对阐明OA的病因具有重要意义。本研究通过优化体外分离培养方法获得原代成纤维样滑膜细胞,现报告如下。
1 材料与方法
1.1 主要试剂 杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)/F12高糖培养基(美国塞默飞世尔科技有限公司,批号:WG);胎牛血清(美国Gibco公司,批号:10100147);青霉素/链霉素双抗(武汉谷歌生物科技有限公司,批号:G4003)、Ⅱ型胶原酶(美国西格玛奥德里奇公司,批号:G5026-1);anti-CD90/Thy1免抗人抗体、波形蛋白(Abcam公司,批号:ab13350、ab45939);山羊抗兔异硫氰酸荧光素(fluorescein isothiocyante,FITC)缀合的二抗和山羊抗兔CY3缀合的二抗(武汉赛维尔生物科技公司,批号:GB22303、GB21303);0.25%胰蛋白酶(武汉科瑞公司,批号:GNM15400);牛血清白蛋白(武汉赛维尔生物科技公司,批号:G5001)。完全培养液由DMEM/F12高糖培养基、胎牛血清、双抗按100∶15∶1比例配制而成,于4℃环境下储存备用;Ⅱ型胶原酶工作液用100 mg Ⅱ型胶原酶溶解于100 ml DMEM/F12高糖培养基配制而成,于-20℃环境下储存备用。
1.2 主要仪器 二氧化碳培养箱购自德国BINDER股份有限公司,超净工作台购自美国Airtech公司,超纯水系统购自德国Merck Millipore公司,普通显微镜及倒置显微镜均购自Olympus公司,高压灭菌锅购自日本SANYO公司,低速离心机购自上海白杨公司(BY-160C型),眼科镊、眼科剪、10 cm玻璃培养皿、巴士吸管、离心管(15 ml、50 ml)、25 cm2细胞培养皿购自美国康宁公司。
1.3 标本来源 标本来源于在我院骨外科行关节置换术的6例OA患者,诊断符合美国风湿病学院制定的OA诊断标准[7]。患者均签署知情同意书,研究方案经武汉大学人民医院伦理委员会批准。获取的滑膜组织保存于无菌的生理盐水中,置于冰盒运送至我院中心实验室处理。
1.4 成纤维样滑膜细胞的分离培养 在超净工作台上,将滑膜组织置于经高压灭菌的无菌玻璃皿中,使用无菌磷酸缓冲盐(phosphate buffer saline,PBS)溶液漂洗数次后,用眼科剪和眼科镊分离出滑膜组织周围的脂肪,并用眼科剪将滑膜组织剪成1 mm3的碎块,用无菌PBS溶液漂洗1次,再用无菌巴士吸管吸入15 ml离心管中以1 000 r/min离心10 min,去掉上清液,将剪碎的组织块按照一定量分别放入25 cm2透气培养瓶中,每瓶加入2 ml Ⅱ型胶原酶工作液,置于37℃、5%CO2培养箱分别消化0 h、2 h、4 h、8 h、12 h、24 h后,将瓶内混合物分别转移至5 ml离心管中,以1 000 r/min离心10 min,去掉上清液。用PBS溶液漂洗,将不同消化时间的细胞和组织块沉淀,用2 ml完全培养液重悬(完全培养液过多细胞不易贴壁,因此培养瓶内最多加2 ml培养基),转移至25 cm2透气培养瓶中,置于37℃、5%CO2培养箱内培养,倒置显微镜观察到细胞贴壁后,用无菌PBS溶液洗去悬浮的死细胞和组织块,更换培养液。
1.5 成纤维样滑膜细胞传代 在倒置显微镜下观察到有80%的成纤维样滑膜细胞融合时,弃掉完全培养液,加入无菌PBS溶液冲洗2~3次,加入1 ml胰蛋白酶消化,用2 ml完全培养液终止消化后,移至5 ml的无菌EP管中,1 000 r/min离心5 min后,弃掉完全培养液和胰蛋白酶,加入2 ml完全培养液,按照1传2的传代方法,将细胞接种到新的细胞培养瓶中,置于37℃、5%CO2、饱和湿度的细胞培养箱中连续培养。
1.6 成纤维样滑膜细胞计数 原代培养时,待细胞贴壁后,于倒置显微镜下分别计数不同消化时间的成纤维样滑膜细胞数。
1.7 成纤维样滑膜细胞免疫荧光鉴定 在6 cm细胞培养皿上放置无菌盖玻片,取原代分离的成纤维样滑膜细胞,按1×105个/ml的密度接种在6 cm细胞培养皿上,轻微晃动使细胞均匀铺在培养皿中。培养24 h后,用4%多聚甲醛固定15 min,用PBS溶液洗涤后用含有Triton X-100(检测CD90/Thy-1时为0.1%,检测波形蛋白时为0.3%)与5%牛血清白蛋白的溶液透化1 h,然后分别加入一抗兔波形蛋白抗体(1 μg/ml)和anti-CD90/Thy-1抗体(1∶100);4℃孵育过夜,PBS溶液洗涤3次,5 min/次,分别加入兔FITC和兔CY3缀合的二抗,在室温下培养2 h。最后细胞用4′,6-二脒基-2-苯基吲哚复染色。使用显微镜拍照,用Image J软件分析结果。以波形蛋白免疫荧光显色为绿色、CD 90/Thy-1免疫荧光显色为红色作为阳性标准。
1.8 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用单因素方差分析,两两比较采用t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 成纤维样滑膜细胞的原代培养及传代情况 成功培养出成纤维样滑膜细胞,细胞生长状态良好。不同消化时间的细胞培养24 h后于倒置显微镜下均可观察到大量细胞贴壁且呈梭形,并可见成纤维样滑膜细胞从组织块下方爬出,随着培养时间的延长细胞逐渐增多,6 d左右细胞即可长满瓶底,见图1。随着传代次数的增加,成纤维样滑膜细胞体积逐渐增大,生长周期逐渐变长,细胞活性降低,见图2。

图1 原代成纤维样滑膜细胞
注:A为胶原酶消化12 h培养1 d后的贴壁细胞;B为胶原酶消化12 h培养6 d后的贴壁细胞。
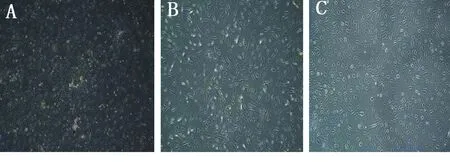
图2 传代成纤维样滑膜细胞
注: A为第一代滑膜细胞,B为第二代滑膜细胞,C为第三代滑膜细胞,均胶原酶消化12 h。
2.2 不同消化时间的成纤维样滑膜细胞计数比较 随着消化时间的延长,贴壁细胞数逐渐增多,经胶原酶消化12 h的贴壁细胞数最多(P<0.05),见表1。

表1 不同消化时间的贴壁细胞数比较(x±s,个)
注:与消化12 h比较,*P<0.05。
2.3 成纤维样滑膜细胞的免疫荧光鉴定结果 免疫细胞化学染色显示波形蛋白和CD90/Thy-1阳性,提示所培养的细胞是成纤维细胞样滑膜细胞(见图3)。

图3 胶原酶消化12 h成纤维样滑膜细胞免疫荧光鉴定结果(400×)
注:A为成纤维样滑膜细胞波形蛋白阳性; B为成纤维样滑膜细胞CD90/Thy-1阳性。
3 讨 论
滑膜是关节囊的内层,由一种特殊的结缔组织组成,其产生的润滑分子透明质酸和润滑素可以有效减少关节表面的摩擦[8]。正常的滑膜分为细胞层和血管层,滑膜细胞分A、B两型。A型也称滑膜巨噬样细胞,具有吞噬功能;B型细胞也称滑膜成纤维样细胞,含有高浓度的内质网,其功能是分泌透明质酸[9-10]。成纤维滑膜细胞表面标志物有波形蛋白、Thy-1(CD90)、细胞内黏附分子(CD54)和血管细胞黏附分子(CD106)[11],其中波形蛋白和CD90标志物与其他解剖部位成纤维细胞相同,可以用于鉴别成纤维滑膜细胞与其他种类细胞[12]。
滑膜细胞原代培养主要有酶消化法和组织块贴壁培养法,目前成纤维样滑膜细胞多取材于行关节置换的OA患者、OA大鼠和兔模型[13]。通过体外分离培养获得的滑膜细胞生长周期长,细胞传代次数少,不利于OA的研究。组织块培养法是在无菌的条件下取出滑膜组织,用无菌的PBS溶液冲洗3遍,然后用眼科剪分离滑膜周围的脂肪组织并将滑膜剪碎成1~2 mm3的碎块,将碎块在细胞培养瓶底部均匀铺展,加入2 ml DMEM完全培养液,置于37℃、5%CO2的培养箱中培养,每3~5 d更换培养基并小心除去非贴壁组织块,当成纤维样滑膜细胞铺满70%~80%的瓶底时传代[14]。该方法的优点是操作步骤简单,缺点是从组织块获取的细胞不易贴壁,需要充分剪碎,而且培养周期比较长,不利于实验进展。酶消化法是在超净台内取出滑膜组织,用无菌PBS溶液冲洗3遍,分离滑膜组织,然后将滑膜组织充分剪碎后放入培养瓶中,用0.25%胰蛋白酶(含乙二胺四乙酸)消化30 min,离心弃胰酶,再加入胶原酶消化2 h,最后过滤加入2 ml DMEM完全培养液,置于37℃、5%CO2的培养箱中培养,每24 h换液1次,细胞长满瓶底时传代[15-17]。该方法的优点是培养周期比较短,缺点是酶浓度过高或者酶消化时间过长都会对细胞造成损伤,降低细胞传代活性;而酶消化时间过短,组织块消化不充分,消化分离的细胞比较少,此外细胞过筛网时组织块容易堵塞筛孔而导致滤过的细胞量比较少,且细胞容易被污染[18]。因此,如何在短期内获得大量原代滑膜细胞一直是研究的热点。
本次实验采用胶原酶消化法获取原代滑膜细胞,培养瓶内既保留了消化完全的组织块,又保留了消化未完全的组织块,未消化完全的组织块贴壁后,在倒置显微镜下可见成纤维样滑膜细胞从底部爬出。该方法操作简单,可在短时间内获得大量原代滑膜细胞。本实验结果显示,剪碎的组织块经Ⅱ型胶原酶消化12 h后,贴壁细胞数量最多,提示消化12 h对细胞的损伤程度较小,获取的细胞数较多。袁琴等[19]采用胶原酶消化法培养大鼠膝OA滑膜细胞,结果也显示单独采用胶原酶消化法进行细胞培养是获得原代滑膜细胞的有效方法。程浩等[20]采用胶原酶消化法、分段胶原酶消化法及组织块法分离成骨细胞,结果显示胶原酶消化法获取的成骨细胞数量多于其他两种方法,且细胞存活率高。
综上所述,采用胶原酶消化法可以成功培养出原代成纤维样滑膜细胞,以胶原酶消化12 h最佳。但是随着传代次数的增加,细胞活性逐渐降低,且细胞生长周期逐渐延长,不利于长期细胞实验。

