18F-氟代脱氧葡萄糖正电子发射断层成像/CT在噬血细胞综合征中的临床价值
(1 广西医科大学研究生学院,南宁市 530021,电子邮箱:qlyok5477@163.com;2 广西医科大学第一附属医院PET/CT部,南宁市 530021)
噬血细胞综合征(hemophagocytic syndrome,HPS)亦称噬血细胞性淋巴组织细胞增生症(hemophagocytic lymphohistiocytosis,HLH),是由原发或继发免疫系统异常而导致过度炎症反应的一类临床综合征。HPS可发生于任何年龄,40%的HPS发生在成人[1],临床上主要表现为持续发热、脾大、全血细胞减少及骨髓、脾脏、淋巴结内发现噬血细胞等[2]。然而,HPS临床表现多样且缺乏特异性,通常与全身炎症反应综合征、多脏器衰竭、败血症等疾病的临床表现相近或重叠[3],易造成误诊和漏诊,故病死率较高(20.4%~88.0%)[4],因此及时准确地诊断至关重要。目前,关于HPS的影像学(包括B超、CT、核磁共振)研究报道较少。本文探讨18F-氟代脱氧葡萄糖正电子发射断层成像/CT(18F-Fluorodeoxyglucose Positron Emission Computed Tomography/Computed Tomography,18F-FDG PET/CT)在HPS中的临床应用价值,以期提高对本病的认识。
1 资料与方法
1.1 临床资料 回顾性分析2010年1月至2017年11月在广西医科大学第一附属医院行18F-FDG PET/CT全身扫描的38例HPS患者(研究组)的临床资料,其中男21例,女17例;年龄9~76岁,中位年龄37.0岁。纳入标准:(1)按照HLH-2004年的诊断标准[5]诊断为HPS,并有完整的临床诊治资料;(2)行18F-FDG PET/CT检查前均行骨髓穿刺,病理明确诊断为HPS,且无其他肿瘤或慢性疾病史。排除标准:(1)未经病理诊断为HPS者;(2)不符合HLH-2004年的诊断标准者;(3)合并其他肿瘤病史或慢性疾病者。另选取50例同期在该院进行健康体检者作为对照组,其中男35例,女15例;年龄35~55岁,中位年龄46.8岁。纳入标准:(1)无肝脏、脾脏、骨骼等相关性疾病者;(2)无肿瘤或慢性病史者(3)白细胞、红细胞、血小板等实验室指标在正常范围内。排除标准:(1)合并有肝脏、脾脏、骨骼等相关性疾病者;(2)合并有肿瘤或慢性病史者;(3)白细胞、红细胞、血小板等实验室指标异常者。两组研究对象的性别、年龄比较,差异均无统计学意义(均P>0.05)。
1.2 主要仪器 德国Siemens公司Biograph Sensation 16型PET/CT,美国通用公司RDSⅢ型回旋加速器,德国Siemens公司HWMBJ-PET-SD1型合成系统自动合成18F-FDG,其放化纯>95%,经无菌、无热源、内毒素等检测。
1.3 检查方法 研究组患者均于治疗前一周完善18F-FDG PET/CT检查,测量肝脏、脾脏及骨骼的最大标准化摄取值(maximum standardized uptake value,SUVmax)。SUVmax是判断组织代谢活性及生物学特征的指标,具有非侵入性及实时性。一般来说,细胞分化增殖速度越快,糖代谢越旺盛,18F-FDG摄取越高,而SUVmax>2.5为异常。对照组于同期完成PET/CT检查,并测量肝脏、脾脏及骨骼的SUVmax。所有受检者行PET/CT显像前空腹4~6 h,并测量血糖、体重、身高,若受检者血糖>11.0 mmol/L,则予静脉注射胰岛素控制血糖至正常水平(3.89~6.10 mmol/L)后再行PET/CT显像。受检者按3.7~7.4 MBq/kg经手背静脉注射18F-FDG,在避光、安静条件下静卧休息30 min后在平静呼吸下行颅脑显像:先行CT扫描,在体位保持不变下行PET扫描一个床位,扫描时间7~10 min。颅脑图像采集结束后30 min饮纯净水300~500 ml,排空膀胱,再行躯干扫描:先行CT扫描,后体位保持不变并于平静呼吸下行躯干PET扫描,根据患者身高采集5~7个床位,3 min/床位。躯干常规扫描范围为颅底至大腿中段,对于双下肢有明确病变者,加扫双下肢,扫描条件同躯干。
1.4 图像处理方法 PET图像重建采用迭代法,将得到的PET图像与相应的CT图像进行帧对帧融合,得到横断位、矢状位及冠状位的PET、CT及PET/CT融合图像。所有研究对象的PET/CT图像均由两位具有高级职称的PET/CT医师独立阅片,在详细了解研究对象的临床资料后,独立做出诊断,当结论不一致时,经讨论或请放射科的专家会诊统一意见后,做出诊断结论。
1.5 统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,比较采用t检验;肝脏、脾脏及骨骼SUVmax与实验室指标的相关性采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 研究组患者的18F-FDG PET/CT显像特征 38例HPS患者中,两系或三系血细胞减少38例(100%),骨髓涂片可见噬血细胞30例(78.9%),脾脏肿大38例(100%),脾脏葡萄糖代谢异常36例(94.7%),肝脏肿大27例(71.1%),肝脏葡萄糖代谢异常14例(36.8%),骨骼葡萄糖代谢异常38例(100%),合并胸腔、腹腔或盆腔积液6例(15.8%),合并淋巴结肿大2例(5.3%),合并肺部病变1例(2.6%),见表1。其中骨骼葡萄糖代谢异常主要表现为骨髓葡萄糖代谢不均匀增高,呈点状、片状或结节样的葡萄糖代谢增高灶,病灶主要分布在腰椎、骶椎、双侧髂骨、双侧股骨头及双侧髋臼,但骨骼均未见骨质破坏,见图1。
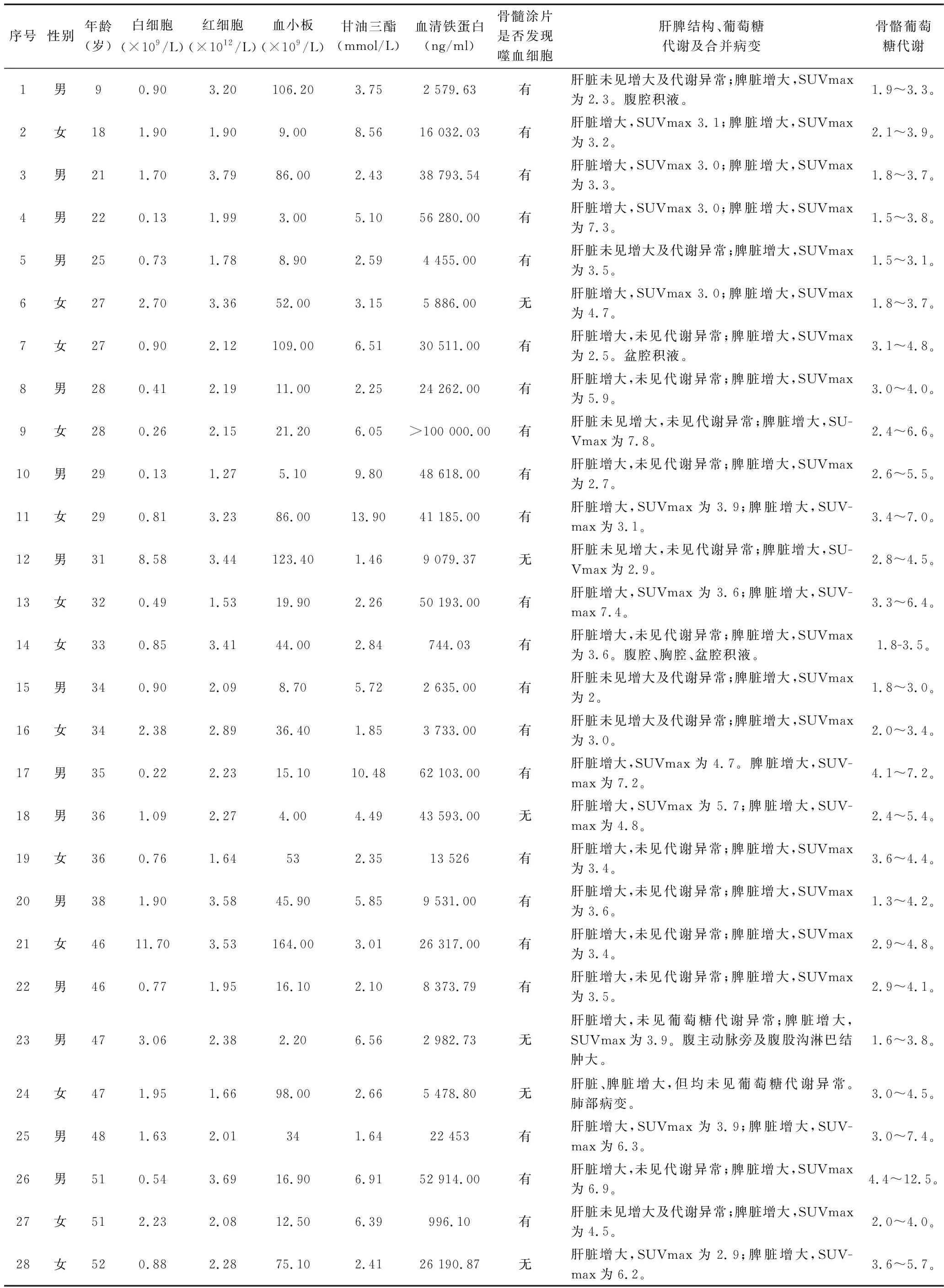
表1 38例HPS患者实验室指标及18F-FDG PET/CT显像特征

续表1
2.2 两组研究对象肝脏、脾脏及骨骼的SUVmax比较 38例HPS患者的肝脏、脾脏及骨骼的SUVmax分别为(3.86±0.97)、(4.47±1.60)、(4.75±1.72);50例健康者的肝脏、脾脏及骨骼的SUVmax分别为(2.26±0.18)、(1.65±0.19)、(1.00±0.12)。两组研究对象的肝脏、脾脏及骨骼的SUVmax比较,差异均具有统计学意义(t=6.150、10.693、13.449,均P<0.001)。
2.3 38例HPS患者肝脏、脾脏及骨骼的SUVmax与实验室指标的相关性分析 HPS患者肝脏、脾脏及骨骼SUVmax与血清铁蛋白含量均呈正相关(均P<0.05),与白细胞水平、红细胞水平、血小板水平及甘油三酯水平等实验室指标均无相关性(均P>0.05)。见表2。

表2 38例HPS患者肝脏、脾脏及骨骼SUVmax与各实验指标的相关性分析
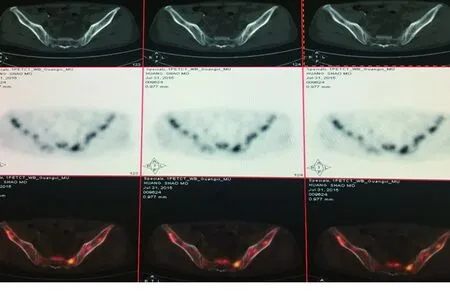
图1 HPS患者18F-FDG PET/CT显像图
注:患者男性,49岁,骨髓涂片找到噬血细胞,18F-FDG PET/CT显像:骨骼未见骨质破坏,但见骨髓葡萄糖代谢不均匀、不对称性增高,SUVmax:4.4~12.5。
3 讨 论
HPS为临床罕见的严重疾病,以反复发热、肝脾或淋巴结肿大、血细胞减少、铁蛋白异常升高等为主要特点。根据病因不同,HPS可分为原发性和继发性两大类。原发性HPS为常染色体隐性遗传病,具有明确的生物学分子病变,而继发性HPS则由恶性肿瘤、感染、自身免疫性疾病和药物等因素引起[6]。HPS是由免疫系统异常而导致过度炎症反应的一类临床综合征,其临床表现缺乏特异性,易造成误诊和漏诊,病死率较高,因此,早期正确诊断对该病的治疗及预后具有决定性作用。近年来,18F-FDG PET/CT显像作为一种全身无创检查手段,可以准确显示病变所累及的范围,逐渐被运用于HPS的诊断、鉴别诊断、病因查找、疗效评价和预后分析等[7-9]。而目前有关HPS的18F-FDG PET/CT显像特征的报道较少。
本研究中HPS患者的PET/CT显像特征主要表现为肝脾肿大并葡萄糖代谢增高,骨骼未见骨质破坏,但骨髓见葡萄糖代谢增高。其中脾脏肿大38例(100%),脾脏葡萄糖代谢异常36例(94.7%),SUVmax为(4.47±1.60);肝脏肿大27例(71.1%),肝脏葡萄糖代谢异常14例(36.8%),SUVmax为(3.86±0.97);骨骼葡萄糖代谢异常38例(100%),SUVmax为(4.75±1.72)。骨骼葡萄糖代谢异常主要表现为骨髓葡萄糖代谢不均匀增高,呈点状、片状或结节样的葡萄糖代谢增高灶,病灶主要分布在腰椎、骶椎、双侧髂骨、双侧股骨头及双侧髋臼,但骨骼均未见骨质破坏,部分病例合并纵隔、腹主动脉旁、腹股沟淋巴结肿大,心包、胸腔、腹腔积液。由于HPS临床表现呈多样性并缺乏特异性,HPS的上述表现应主要与发热和自身免疫性疾病(如成人Still病)相鉴别,这几种疾病均表现为肝脾肿大,但发热和自身免疫性疾病的骨髓葡萄糖代谢表现为全身性、对称性、均匀性、弥漫性增高,骨髓涂片未找到噬血细胞。此外有研究表明,由淋巴瘤引起的HPS表现为骨髓摄取18F-FDG弥漫性增高,可结合患者淋巴结活检病理结果进行鉴别[10-11]。本研究结果显示,HPS患者肝脏、脾脏及骨骼的SUVmax与血清铁蛋白含量均呈正相关(均P<0.05);两组的肝脏、脾脏及骨骼的SUVmax差异具有统计学意义(P<0.05),提示HPS患者肝脏、脾脏及骨骼的SUVmax增高可能与血清铁蛋白升高有关,血清铁蛋白数值越高,SUVmax越大。
综上所述,18F-FDG PET/CT显像在HPS的诊断中具有一定的临床应用价值。因此,当患者出现反复发热,血常规出现三系减少,抗炎治疗效果差时,可考虑行PET/CT检查,以协助临床医生对HPS进行早期诊断。

