TGF-β1和β-catenin在儿童结肠息肉中的表达及意义
王松阳
(漯河市第二人民医院 外二科,河南 漯河 462000)
儿童结肠息肉(colonic polyps)为儿童肠黏膜隆起赘生物,一般均为具有错构瘤特征的幼年性息肉,并会诱发儿童下消化道出血。目前,儿童结肠息肉通过结肠镜的检查,检出率较高。该病的发病机制还不明确,文献认为该病的发生与遗传因素有关,并与多个信号通路异常表达有关,为多基因参加和调控的过程[1]。
研究表明,转化生长因子β1(transforming growth factor-β, TGF-β1)与结肠癌、肝癌等多种肿瘤发生有关,通过双向调控影响肿瘤生物学行为[2]。而β-连环蛋白(β-catenin)作为Wnt/β-catenin通路的细胞因子,可以直接调节细胞的增殖和分化。目前有关TGF-β1和β-catenin在儿童结肠息肉中的表达、进展及机制报道较少,本研究主要分析儿童结肠息肉中TGF-β1和β-catenin蛋白的阳性表达及基因表达水平,并分析其分子机制,为儿童结肠息肉预防和治疗提供依据。
1 资料与方法
1.1 研究对象
选取2006年1月—2017年1月河南省漯河市第二人民医院病理科存档的儿童息肉石蜡标本54例。其中,单发幼年性息肉29例。男性18例,女性11例;年龄4~13岁,平均(6.2±1.9)岁。多发幼年性息肉25例。男性16例,女性9例;年龄4~12岁,平均(6.1±1.7)岁。收集同期标本旁组织25例,病理分析为正常组织。标本采集均告知家属并知情同意。
1.2 主要试剂
兔抗人TGF-β1多克隆抗体(北京中杉金桥生物技术有限公司),兔抗β-catenin单克隆抗体(美国Santa Cruz公司),二氨基联苯胺显色试剂盒,SP法免疫组织化学(以下简称免疫组化)试剂盒(北京中杉金桥生物技术有限公司),Fast-King一步法逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)试剂盒[天根生化科技(北京)有限公司]。
1.3 免疫组化染色检测TGF-β1和β-catenin的表达
常规固定标本、脱水并进行石蜡包埋,连续切片(4μm),抗原修复,采用SP法行免疫组化染色,二氨基联苯胺显色,镜检。磷酸盐缓冲液替代一抗制作阴性对照切片。TGF-β1和β-catenin为胞浆、胞膜和/或细胞核染色,呈棕黄色颗粒状或线状,其中单一或混合染色即为阳性染色细胞。随机选择4个视野(×400)双盲法读片。TGF-β1的阳性诊断:胞浆和/或胞膜着色≥30%。β-catenin异常表达:胞膜着色≥70%为正常,相反为胞膜表达缺失,胞浆和/或胞核着色>10%为异位表达,胞膜表达缺失和异位表达均为异常表达。
1.4 RT-PCR检测TGF-β1和β-catenin mRNA的表达
Trizol提取总RNA,按照Fast-King一步法RT-PCR试剂盒说明书进行RT-PCR实验。引物序列由上海英骏公司提供。TGF-β1(NM_000660.6)序列:正向5'-G GGCTACCATGCCAACTTCT-3',反向 5'-GACACAGAG ATCCGCAGTCC-3',扩增产物长度384 bp;β-catenin(X87838.1)序列:正向5'-GGCCTAGGTGTCCAAAG GTG-3',反向 5'-AGAATGACCGCATAGTGCCC-3',产物长度201 bp;内参GAPDH(NM_001289745.2)序列:正向5'-GAATTTGGCCACACTCAGTCC-3',反向5'-GT ACATGACAAGGTGCGGCT-3',长度 110 bp。
1.5 统计学方法
数据分析采用SPSS 18.0统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,两两比较用用LSD-t检验。计数资料以率(%)表示,比较用χ2检验,相关分析用Spearman法,P<0.05为差异有统计学意义。
2 结果
2.1 TGF-β1和β-catenin的表达情况
TGF-β1蛋白在正常结肠组织的腺体腺上皮细胞、间质细胞细胞膜可见少量表达,而幼年性息肉组织中表达主要位于胞膜、胞浆和/或细胞核中,呈棕黄色颗粒。β-catenin蛋白在正常结肠组织上皮细胞(包括腺体上皮细胞)膜可见少量的表达,呈棕黄色。而幼年性息肉组织中可见膜表达、胞浆表达和部分核表达。见图1。
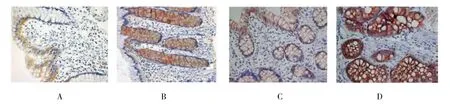
图1 TGF-β1和β-catenin蛋白在儿童幼年性息肉组织中的表达 (×400)
TGF-β1在儿童多发幼年性息肉组织中的阳性表达率高于正常组织阳性表达率(P<0.05),而单发幼年性息肉组织中的阳性表达率与正常组织阳性表达率比较,差异无统计学意义(P>0.05)。β-catenin蛋白在儿童多发幼年性息肉组织中的表达率高于正常组织表达率以及单发幼年性息肉组织中的表达率(均P<0.05),而单发幼年性息肉组织中的表达率与正常组织比较,差异无统计学意义(P>0.05)。见表1。
2.2 TGF-β1和β-catenin mRNA的表达情况
多发幼年性息肉组织中TGF-β1和β-catenin mRNA相对表达水平高于单发以及正常组,差异有统计学意义(P<0.05)。而单发幼年性息肉组织中的TGF-β1和β-catenin mRNA相对表达水平与正常组织比较,差异无统计学意义(P>0.05)。见表2和图2。
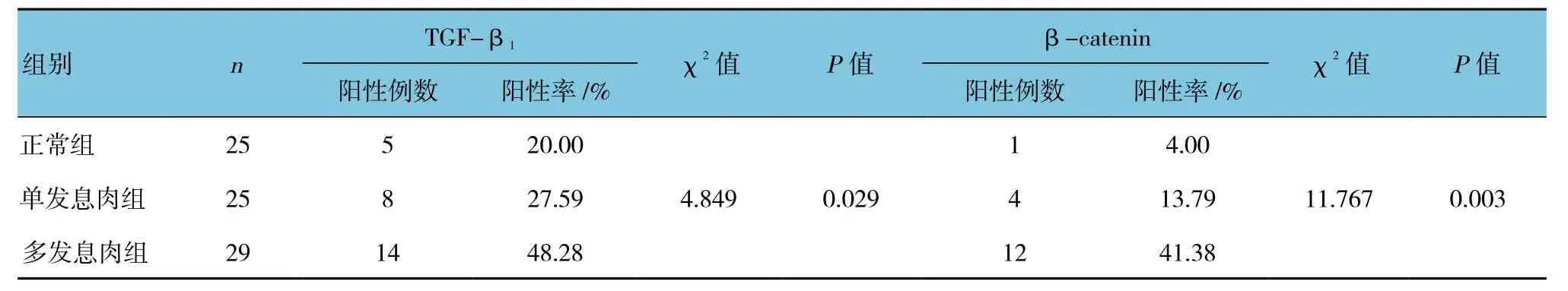
表1 TGF-β1和β-catenin在儿童幼年性息肉组织中的表达
表2 TGF-β1和β-catenin mRNA的表达 (±s)
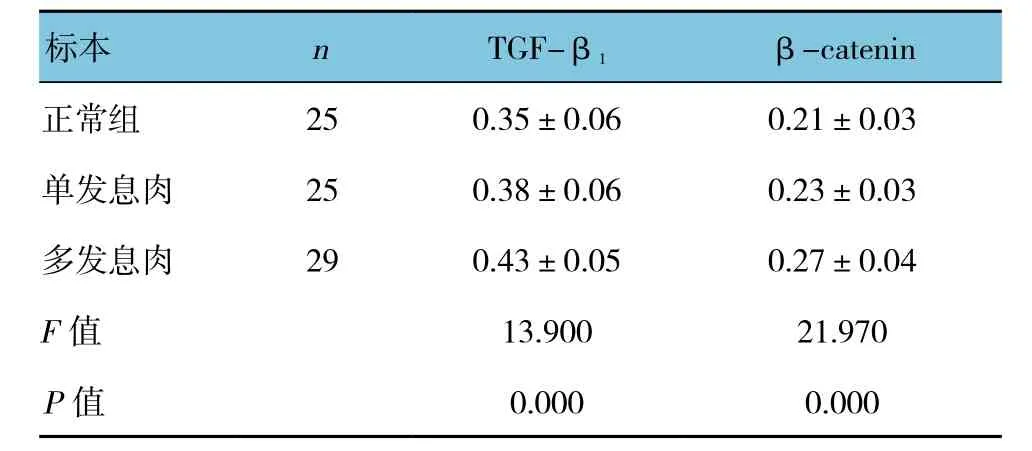
表2 TGF-β1和β-catenin mRNA的表达 (±s)
标本 n TGF-β1 β-catenin正常组 25 0.35±0.06 0.21±0.03单发息肉 25 0.38±0.06 0.23±0.03多发息肉 29 0.43±0.05 0.27±0.04 F值 13.900 21.970 P值 0.000 0.000
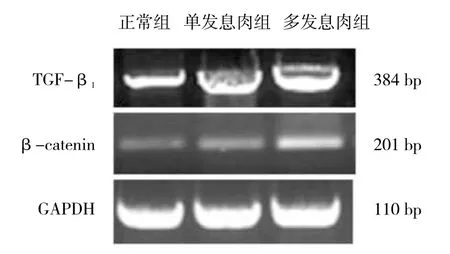
图2 TGF-β1和β-catenin mRNA的表达
2.3 TGF-β1和β-catenin相关性分析
儿童多发幼年性息肉组织中T G F-β1和β-catenin的表达呈正相关(rs=0.463,P=0.000),见表3。

表3 TGF-β1和β-catenin相关性分析 (n =14)
3 讨论
幼年性息肉病常易诱发溃疡、糜烂出血。部分还出现炎症细胞浸润,最初的研究显示幼年性息肉无癌变的倾向,生物学效应表现为良性[3]。但近年来部分研究显示,幼年性息肉也具有转化为腺瘤样息肉恶变的风险。BOSKOVIC等[4]报道1例儿童3个息肉中伴有低级别上皮内瘤变(IEN),而国外ADOLPH等[5]认为幼年性息肉可以和腺瘤共存,这也提示幼年性息肉部分可能发生癌变。
TGF-β1为TGF-β/Smad4信号通路的多功能生长因子,能调节上皮细胞分化,协调组织重塑和细胞外基质的形成。并通过诱导细胞因子,促进细胞的生长和分化,破坏细胞基质的生长和降解平衡,促进纤维化并参与息肉的形成。郝国荣等[6]研究发现,子宫内膜息肉中TGF-β1水平高于正常子宫内膜息肉水平。LEONARDO等[7]研究发现,17例鼻息肉病患者的息肉的TGF-β1水平高于11例正常对照的鼻黏膜中TGF-β1水平。有研究显示TGF-β1与肿瘤的发生、侵袭和转移有关,对肿瘤具有双向调节作用,早期抑制肿瘤的生长,而晚期主要具有促进作用[8]。而且有报道TGF-β1与乳腺癌的进展、浸润和预后相关[9]。本研究显示,TGF-β1在多发幼年性息肉中的阳性表达率以及TGF-β1mRNA相对表达水平均高于正常组,提示TGF-β1蛋白水平的改变与息肉的发生有关,并可能促进腺瘤、腺癌的发生,对此患儿可以询问家族史,并采用基因检测或肠镜检查。而单发幼年性息肉组织中的阳性表达率以及TGF-β1mRNA相对表达水平与正常组织阳性表达率比较无差异,提示单发幼年性息肉发生癌变的风险较低。而且TGF-β1蛋白以及基因水平在单发以及多发幼年性息肉组织中较正常组依次增加,这也证明了上述的观点。
β-catenin对癌基因、抑癌基因具有一定的调节作用,高水平的的β-catenin容易产生降解障碍,并出现过度积聚,通过对下游基因的激活,调控细胞增殖和分化,严重时扰乱增殖和凋亡平衡,并最终形成肠息肉[10]。金美芳等[11]发现,儿童幼年性息肉中,β-catenin蛋白表达和分布改变明显。目前针对肿瘤中β-catenin水平的变化研究报道较多,但针对儿童幼年性息肉中的β-catenin水平的变化研究报道较少。本研究中,多发幼年性息肉组织中的β-catenin阳性表达率以及β-catenin mRNA的相对表达水平高于正常组织和单发幼年性息肉组织中的表达水平,而单发幼年性息肉组织中的β-catenin阳性表达水平以及β-catenin mRNA的相对表达水平与正常组织异常表达率比较无差异,提示单发幼年性息肉恶变倾向较低,但不排除多发幼年性息肉癌变的风险,尤其针对有家族史的患儿需要定时的检查和检测,减少癌变的风险。
研究表明,TGF-β/Smad4、Wnt/β-catenin信号通路与肿瘤的发生和进展有关,并彼此影响调控细胞分化[12]。已有研究证实,TGF-β1和β-catenin共同参与、调节原发性肝癌的发生和进展,表明TGF-β/Smad4信号通路中TGF-β1在参与经典通路外,还可调节Wnt通路,并通过某些途径共同调节基因的表达[13]。WINCEWICZ等[14]研究发现,TGF-β1与β-catenin间的联系有差异。本研究结果表明,幼年性息肉的发生与TGF-β1和β-catenin异常表达有关,并具有正相关性,提示TGF-β1基因可能通过β-catenin途径促进息肉的形成,尤其多发幼年性息肉中更加明显,级联激活TGF-β/Smad4信号通路,调控息肉组织细胞的增殖、分化和侵袭。

