抗癌药物吉西他滨纳米递送系统的研究进展
罗芳,王丹,夏桂民
抗癌药物吉西他滨纳米递送系统的研究进展
罗芳,王丹,夏桂民
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所制剂研究室
吉西他滨(gemcitabine,Gem)(图 1)属细胞周期特异性抗代谢类药物,外观为白色至类白色固体,易溶于水,微溶于甲醇,非极性有机溶剂中几乎不溶,主要作用于S 期,是一种人工合成的胞嘧啶核苷衍生物,首先由美国礼来公司于 1996 年研制成功并获准上市,我国于 1999 年批准进口。Gem 是非小细胞肺癌、胰腺癌、乳腺癌、卵巢癌、宫颈癌、子宫癌及膀胱癌等的一线化疗用药,Gem 代谢产生吉西他滨二磷酸盐(dFdCDP)和三磷酸盐(dFdCTP),dFdCDP 抑制核苷酸还原酶的活性,减少 DNA 合成;dFdCTP 可插入到 DNA 链中,引起细胞凋亡[1]。
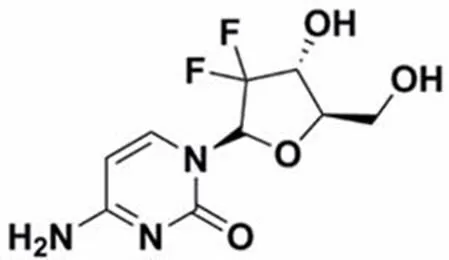
分子式:C9H11F2N3O4 分子量:263.2
目前,Gem 临床上仅有供静脉滴注的一种剂型——注射用盐酸吉西他滨(无菌粉末针剂)。美国国家癌症综合网络及欧洲肿瘤协会指南推荐的标准剂量 1000 ~ 1250 mg/m2,且 30 min 内静脉输注完成。Gem 经输注给药后,体内的脱氧胞苷脱氨酶(人血浆与肝脏中含量较高)可迅速将其代谢为无活性的双氟脱氧尿苷(dFdU)[2],故 Gem 的半衰期较短,仅 32 ~ 94 min[1],若要维持有效的药物浓度就必须大剂量的给药,但持续大剂量给药又带来了较强毒副作用,如:呼吸困难、脱发、水肿、骨髓抑制、肾毒性、胃肠道反应、流感样反应、过敏反应等[1]。因此,科学家就如何延长其半衰期或增效减毒等开展了诸多探索与研究,尤其在 Gem 纳米递送系统方面研究较多,期望克服以上不足,呈现新型高效低毒的制剂。现就 Gem 纳米递送系统研究进展综述如下。
1 基于纳米载体的药物递送系统
1.1 脂质体
脂质体是目前应用最广泛的纳米载体之一。经美国 FDA 批准应用于临床的抗肿瘤的脂质体主要有紫杉醇、阿霉素、阿糖胞苷及长春新碱等。尽管多项研究结果都表明,Gem 脂质体的体内外抗肿瘤活性均优于游离药物 Gem,但仍未见 Gem 脂质体获批应用于临床,说明依然还存在着各种各样的问题有待解决。
Yalcin等[3]选用大豆磷脂酰胆碱(SPC)、二棕榈酰磷脂酰胆碱(DPPC)、二油酰磷脂酰胆碱(DOPC)及胆固醇,利用薄膜分散法成功构建了盐酸吉西他滨脂质体[粒径 203 ~ 225 nm,表面电位–14.3 ~ –15 mV,包封率(26.1 ± 0.18)%];又选用聚乳酸-羟基乙酸共聚物(PLGA)和聚乙烯醇(PVA),采用复乳溶剂挥发法成功制备了盐酸吉西他滨 PLGA 纳米粒[粒径 231 ~ 245 nm,表面电位–12.4 ~ –19.2 mV,包封率(18.8 ± 1.52)%]。上述脂质体的包封率是 PLGA 纳米粒的 1.4 倍;粒径、包封率及 Gem 的释放受磷脂/胆固醇的比例、磷脂种类、磷脂分子量及 PLGA 的用量等因素影响。尽管 MTT 法结果表明 Gem 脂质体与 PLGA 纳米粒的抗肿瘤活性均优于市售的注射用吉西他滨(表 1),但遗憾的是此脂质体及纳米粒易渗漏,在 4 ℃条件下贮存,均仅有 3 个月的稳定期限。

表 1 吉西他滨 4 种试药对人乳腺癌细胞 MCF-7及 MDA-MB-231 的半数抑制浓度(μmol/L)
有研究报道,用氢化卵磷脂与胆固醇按摩尔比 55:45,选用高压均质法成功制备了吉西他滨脂质体(Gem-Lip),平均粒径 36 nm,包封率 47%。在人胰腺癌细胞系 MIA PaCa-2 裸鼠原位移植瘤模型中,静脉给予 8 mg/kg 的 Gem-Lip(1 次/周,连续 5 周),抑瘤率为 68%,与剂量为 240 mg/kg 的游离 Gem(抑瘤率几乎为零)相比具有显著性差异(< 0.05)。在人胰腺癌细胞系 AsPC-1 裸鼠原位移植瘤模型中,Gem-Lip 抑瘤率为 64%,与剂量为240 mg/kg 的游离 Gem(抑瘤率 36%)相比也具有显著性差异(< 0.05)。Gem-Lip 在 8 mg/kg 剂量时体内抗肿瘤效果良好,毒副作用相对较少且轻[4-5]。
Xu 等[6]选用酸敏脂质化合物二油酰磷脂酰乙醇胺(DOPE)、胆固醇琥珀酸盐(CHEMS)和二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-mPEG2000)按质量比6:4:0.3,采用孵育法制备了吉西他滨的酸敏脂质体,粒径(145 ±5)nm,电位(–8.1 ± 0.4)mV,包封率(30.2 ± 0.5)%,最高载药率仅(4.5 ± 0.1)%。该酸敏脂质体载药率的高低不影响主成分的体外释放速率;选用人胰腺癌细胞系 MIA PaCa-2 为实验细胞,利用 MTT 法开展的体外细胞毒实验结果表明:载药率为 4.5% 的酸敏脂质体的细胞毒性最强[IC50=(0.7 ± 0.1)μmol/L,48 h],载药率为 0.5% 的酸敏脂质体次之[IC50=(1.1 ± 0.1)μmol/L,48 h],载药率为 4.2% 的非酸敏脂质体最弱[IC50=(37.0 ± 7.5)μmol/L,48 h];该酸敏脂质体的消除半衰期(6.2 h)较游离 Gem(1.4 h)延长了3.4 倍。
Tong 等[7]选用四氧化三铁(磁性材料)及氢化大豆磷脂(HSPC),采用逆向蒸发法设计并构建了磁性吉西他滨 PEG 化脂质体(Gem-Fe-PEG-Lip),粒径 201 nm,包封率 87.2%。与吉西他滨脂质体(Gem-Lip)、吉西他滨 PEG 化脂质体(Gem-PEG-Lip)及磁性吉西他滨脂质体(Gem-Fe-Lip)相比,利用 HPLC 法测得 Gem-Fe-PEG-Lip 在肿瘤组织中分布最多。体外研究结果表明,Gem-Fe-PEG-Lip 对人乳腺癌 MCF-7 细胞的杀伤作用高于其他 3 种脂质体。在人乳腺癌细胞系 MCF-7 荷瘤裸鼠中,分别静脉给予 45 mg/kg 的 Gem-Fe-PEG-Lip、Gem-Fe-Lip、Gem-Lip 以及 Gem-PEG-Lip,前两者注射完后立即在荷瘤部位给予0.5 T 的连续磁场作用 30 min,结果表明,Gem-Fe-PEG-Lip(抑瘤率 87.3%)的抗肿瘤作用明显高于 Gem-Lip (抑瘤率 35.9%)、Gem-PEG-Lip(抑瘤率 70.5%)和 Gem-Fe-Lip(抑瘤率 59.9%)。
为了提高 Gem 的包封率和稳定性,Li 等[8]用胆固醇(Chol)合成了一种 Gem 衍生物(Gem-Chol),采用薄膜分散法将其包封于脂质体中,得到的脂质体粒径为(112.57 ± 1.25)nm,电位(–32.08 ± 0.91)mV,包封率大于 99%,载药量约为 50%。体外研究表明,Gem-Chol 脂质体能够延缓药物的释放,但该脂质体在 4 ℃下仅有 2 个月的贮存期。在小鼠肉瘤(H22)和肝癌(S180)细胞异种移植瘤模型中,Gem-Chol 脂质体抗肿瘤效果显著高于游离 Gem(< 0.05)。研究者利用脂质体组成必不可少的成分胆固醇对 Gem 进行修饰,改善了其亲脂性,得到的 Gem-Chol 脂质体不仅包封率高,效果也好。为设计水溶性药物脂质体递送系统提高药物包封率和载药量提供了新思路。
1.2 聚合物纳米粒
聚合物是目前研究较广泛的生物材料,科学家选用或合成不同的聚合物是希望借助这些生物材料通过纳米技术构建智能响应或靶向释放药物的纳米粒,以实现药物的高效低毒,其中,天然聚合物壳聚糖和白蛋白是目前备受青睐的用于递送吉西他滨的聚合物纳米材料[9]。
1.2.1 白蛋白纳米粒 人血清白蛋白(rHSA)是人体血浆中丰富的蛋白质,也是一种安全、生物相容、可生物降解的水溶性蛋白,被广泛应用于临床。白蛋白具有无毒、易获得、循环半衰期长(19 d)、能自我更新等优点。由于白蛋白的特殊化学结构及理化性质,它既是亲脂性药物的载体,也是亲水性药物的天然高分子载体,且 rHSA 代谢生成的氨基酸可优先被肿瘤组织吸收[10]。这使 rHSA 成为药物递送的理想载体。
牛血清白蛋白(BSA)与 rHSA 的序列具有 80% 的同源性,与 rHSA 分子量差异小于 1%,且具有相同的等电点[11]。因其低成本,易于纯化,也是良好的纳米药物递送载体[12]。
粒径和粒径分布对纳米系统的稳定性具有重要影响。去溶剂-交联法是制备白蛋白纳米粒的常用方法,但通过这种方法很难控制纳米粒的粒径和粒径分布,而纳米白蛋白结合技术能够将粒径很好的控制在 100 ~ 200 nm 范围内。Yu 等[13]用人血白蛋白采用纳米白蛋白结合技术制备了吉西他滨白蛋白纳米粒(Gem-HSA-NPs),粒径(150 ± 27)nm,电位为(–10.2 ± 3.2)mV,包封率 82.99% ± 3.5%,载药量 10.42% ± 3.5%。在人胰腺癌细胞系 BxPC-3 皮下荷瘤小鼠模型中,与游离 Gem、Gem-C14(Gem 的 4-氨基与 C14 直链酰基衍生物的偶联物)相比,Gem-HSA-NPs 能够显著抑制肿瘤细胞的生长(< 0.05),但体外却未见有相一致的效果。这可能是由于 Gem-HSA-NPs 在 120 h 释放量才达到 82.6%,具有相对的控制或缓释释放的特性,而体外实验观察时间仅有 48 h 的缘故。
白蛋白纳米粒表面修饰靶向多肽可显著提高纳米粒的靶向性。整合素受体 αvβ3 在多种肿瘤细胞中高表达,用精氨酸-甘氨酸-天冬氨酸多肽(RGD)修饰 BSA-NPs可以显著提高抗肿瘤效果[14-15]。Ji 等[16]用去溶剂-交联法制得的 Gem-RGD-BSA-NPs,平均粒径 130 nm,Zeta 电位–30.77 mV,包封率 92.16%,载药量 12.8%。在体内人胰腺癌 BxPC-3 细胞模型中,与 Gem 和 Gem-BSA-NPs 相比,Gem-RGD-BSA-NPs 具有显著的抗肿瘤活性(< 0.05)。利用 FITC 标记 Gem-BSA-NPs 和 Gem-RGD-BSA-NPs,与 BxPC-3 细胞共孵育,用荧光显微镜进行观察,RGD-BSA-NPs 能够选择性蓄积在 BxPC-3 细胞中,具有良好的靶向性。
Wang 等[17]用去溶剂-交联法制备了西妥昔单抗(C225)修饰的 Gem 磁性牛血清白蛋白纳米球(C225-Gem-MA-Ns)(图 2),该纳米球平均粒径 200 nm,包封率 82.16%,能持续稳定释放 Gem,48 h 药物累积释放达到 80%。C225-Gem-MA-Ns 可作为磁性诊断探针,能有效地将表达不同 EGFR 的胰腺癌细胞区分开。也可用于双靶向化学热疗,借助外部磁场,在抗体和磁靶向的联合作用下提高肿瘤细胞内的药物浓度,能更有效地抑制肿瘤生长。选用人胰腺癌 AsPC-1 细胞进行 MTT 法实验,结果表明,C225-Gem-MA-Ns的肿瘤细胞抑制作用(抑制率 85.18%)明显高于 C225-Gem-Ns(抑制率 70.92%)、Gem-MA-Ns(抑制率 46.95%)和 Gem-Ns(抑制率 30.97%)。C225-Gem-MA-Ns 在提高药物靶向性和减少毒副作用方面表现出较大潜力。

图 2 C225-Gem-MA-Ns 制备过程示意图[17]
1.2.2 壳聚糖 壳聚糖是一种天然无毒、可生物降解和生物相容性好的生物材料。由于其碱性氨基在生理 pH 下可被质子化,故在生理液体中壳聚糖荷正电,这是它有别于其他生物材料的独特之处,壳聚糖在药物递送系统研究方面选用较多[18]。
Parsian 等[19]用二价铁盐、三价铁盐和壳聚糖等合成了吉西他滨壳聚糖磁性纳米粒(Gem-CsM-NPs),平均粒径 60 nm,电位–9 mV,包封率 39%。该纳米粒药物的释放具有 pH 依赖性,在 pH 4.2 时可释放 65%的药物,但在 pH 7.2 时仅释放 8%,选用人乳腺癌细胞系 SKBR-3 和 MCF-7 为实验细胞,分别进行 MTT 法实验,结果表明,Gem-CsM-NPs 的 IC50值比游离 Gem 分别要低 1.4 倍和 2.6 倍,抗肿瘤效果均优于游离 Gem。
利用同轴电喷雾技术制备的叶酸受体靶向的 Gem 壳聚糖核壳 NPs(FA-Chi-Gem-NPs),粒径 200 ~ 300 nm,载药量(3.91 ± 0.12)%,包封率(85.37 ± 4.9)%。该纳米粒的释药特性具有 pH 依赖性,在 pH 5.0 时可以快速释放 Gem,在肿瘤弱酸性微环境中是一种理想的药物释放载体。体外研究表明,在人胰腺癌细胞系 BxPC-3 中,与 Chi-Gem-NPs 相比,FA-Chi-Gem-NPs 细胞摄取效率高,具有显著的抗肿瘤活性(< 0.05)[20]。Zhou 等[21]得到的研究结果与上述结果一致。体内外实验结果表明,在人胰腺癌细胞系 COLO357、SW1990、MIA PaCa-2、Capan1、L3.6pl 及 BxPC-3 中,与 Chi-Gem-NPs 相比,FA-Chi-Gem-NPs 都具有显著的抗肿瘤活性(< 0.05),说明 FA-Chi-Gem-NPs是一种良好的靶向抗肿瘤药物递送系统。
为了增强肿瘤细胞对 Gem 的摄取,减少脱靶效应,Xiao 和Yu[22]设计了一种双抗修饰的Gem 壳聚糖纳米粒(Abc-GC-Gem-NPs),包封率 91.63%、载药量 9.97%。在体外人胰腺癌 SW1990 细胞系中,和 GC-Gem-NPs 相比,Abc-GC-Gem-NPs 能够极显著地抑制肿瘤细胞增殖、转移和侵袭(< 0.01)。研究者根据人胰腺癌细胞中 EGFR 高表达的特点,在 GC-Gem-NPs 基础上共轭连接抗 EGFR 抗体,提高了靶向性,降低了对正常组织的损伤。目前的研究结果表明,Abc-GC-Gem-NPs 有望用于胰腺癌的治疗。这些还需要进一步的动物实验和临床研究来验证。
1.3 聚合物胶束
聚合物胶束(PMs)是由两亲性嵌段共聚物或聚合物链组成的胶体溶液,在液体中通过聚合物链段之间的疏水或离子对相互作用自组装形成。聚合物胶束由于粒径小(通常小于 100 nm),而不易被网状内皮系统摄取、不易被肝代谢、肾排泄,延长了药物在血液中的循环时间,提高了药物的生物利用度。此外,聚合物胶束还具有增加难溶性药物在水中的溶解度、提高药物稳定性、增强溶出能力、延缓释放等优点,是一种理想的抗癌药物载体[23]。
Daman 等[24]用溶剂蒸发法制备了硬脂酰吉西他滨聚合物胶束(GemC18-PEG-PLA-PMs)。优化得到的 GemC18-PEG-PLA-PMs 粒径约为 120 nm,包封率大于 90%,载药量 12.1%。分别选用人胰腺癌细胞系 Panc-1 和 AsPC-1 细胞进行 MTT 法实验,结果表明,GemC18-PEG-PLA-PMs在 Panc-1 和 AsPC-1 中的 IC50分别为 25.64 和58.88 μmol/L,优于 GemC18 的 29.24 和 100 μmol/L。
由于肿瘤组织中谷胱甘肽(GSH)的浓度(约10 mmol/L)至少比正常组织(约 2 mmol/L)高 4 倍,含有二硫键的前药化合物在肿瘤组织中可被还原切割,从而释放出游离药物。Han 等[25]设计合成了还原敏感 Gem 前药胶束用于胰腺癌的治疗,粒径约 175.4 nm(PDI = 0.174)。体外 MTT 法实验表明,前药胶束在肿瘤细胞缺氧环境中二硫键被还原释放出Gem,从而抑制 BxPC-3 细胞的增殖。在人胰腺癌 BxPC-3 异种移植瘤模型中,用近红外荧光染料(IR820)标记前药胶束,用近红外荧光成像系统观察前药胶束在体内的分布情况。结果显示,分别静脉注射游离 IR820 和 IR820 标记的前药胶束后,3 h 后两者均分布于小鼠全身,但 3 ~ 24 h 后,游离 IR820 组小鼠体内荧光信号开始降低直至消失;而 IR820 标记的前药胶束组荧光信号在肿瘤部位逐渐增强,24 h 后信号依然很强。表明前药胶束可通过 EPR 效应在肿瘤组织中积累,且具有长循环特性。具有良好还原敏感性的 Gem 前体药物胶束有望提高 Gem 的疗效,同时也可作为生物探针用于胰腺癌治疗。
1.4 角鲨烯化纳米粒
角鲨烯来源于鲨鱼肝油,是一种三萜类化合物(C30H50)。角鲨烯化是指角鲨烯与抗癌核苷类似物通过化学键结合。亲水性药物的角鲨烯化可形成两亲性,无论核苷类似物的性质和连接位点如何,其在水中都可自组装成平均粒径为 100 ~ 200 nm 的纳米粒[26]。角鲨烯化可以改善 Gem 的药代动力学行为,如:降低代谢速度、更好地分布于网状内皮系统的各个器官(如脾脏和肝脏)等。角鲨烯化也有助于克服化疗耐药性的发展,在耐药的人胰腺癌细胞系 Panc-1 中,具有显著的抗增殖作用[27]。
角鲨烯化吉西他滨(SQ-Gem)因能保护体内 Gem 免受胞苷脱氨酶的快速代谢而改善了其药代动力学行为进而具有较好的治疗效果。Réjiba 等[28]合成了角鲨烯化吉西他滨纳米粒(SQ-Gem-NPs),粒径 135 nm,电位–27 mV,在 3 种人胰腺癌细胞系 BxPC-3、Capan-1 及 Panc-1 中,SQ-Gem-NPs 的 IC50分别为 0.40、0.04 和 5 μmol/L;Gem 的 IC50分别为 2、1 和 50 μmol/L,SQ-Gem-NPs 的抑制效果都显著优于等剂量的 Gem(< 0.05)。在 Panc-1 原位异种移植瘤模型中,以 20 mg/kg 静脉注射治疗 30 d 的结果显示,SQ-Gem-NPs(抑瘤率 68%)抗肿瘤效果显著高于游离 Gem 组(抑瘤率 32%)。Maksimenko 等[27]制备了角鲨烯吉西他滨核苷单磷酸纳米自组装体(SQ-Gem-MP-NAs),粒径约 100 nm,电位 −40.9 mV,载药率 47.2%。在人胰腺癌细胞系 MIA PaCa-2 小鼠异种移植瘤模型中,以7 mg/kg 静脉注射治疗 26 d 后,SQ-Gem-MP-NAs 抑瘤率达到 70%,抗肿瘤效果显著优于对照组 SQ-Gem-NAs(抑瘤率 35%)和游离 Gem(抑瘤率几乎为零)。免疫组化结果表明,其可以克服由血液脱氨酶引起的 Gem 快速失活和由脱氧胞苷激酶或核苷转运蛋白下调引起的细胞化学耐药性的发生。同时,SQ-Gem-MP NAs 提高了肿瘤细胞对 Gem 的敏感性,为胰腺癌治疗带来了更多选择。
1.5 无机纳米粒
常用于药物递送的无机纳米载体有:金纳米粒(GNPs)、磁性氧化铁纳米粒(MIONPs)、碳纳米管和介孔二氧化硅纳米粒等[29]。其中以 GNPs 和MIONPs 的研究最广。无机纳米粒具有很多优点:①具有刺激反应释放功能。当对外界的触发(如高温、光和磁场)作出反应时,可在肿瘤微环境中特异性释放药物,以避免药物外排转运体识别,减少多药耐药。②抗癌药物以及基因(DNA 或 RNA)可被包载于无机纳米粒中,以实现协同效应。③还可提供分子成像功能,有助于监测药物递送过程和治疗结果,从而提高疗效[30]。因此,以无机纳米粒作为药物递送载体的研究受到关注。
由于胰腺癌细胞中人表皮生长因子受体(EGFR)高度表达,Kudgus 等[29]合成了 C225修饰的 Gem 金纳米粒(Au-C225-Gem NPs)。粒径约 32.09 nm,电位约–30 mV。体外稳定性实验表明,该纳米粒在不同的生理环境下稳定性良好,在磷酸盐缓冲系统中 24 h 仅释放 5%;在小鼠血浆中 24 h 释放 12%。在人晚期胰腺癌细胞系 AsPC-1 小鼠原位移植瘤模型中,小剂量 450 μg/kg 的 Au-C225-Gem NPs 就能显著抑制肿瘤生长,而剂量 1.8 mg/kg 的 Gem 则达不到相同的效果。该研究为治疗晚期胰腺癌提供了一个重要参考。
磁性 NPs 具有超小的粒径、良好的生物相容性和超顺磁性,在生物医学研究中应用前景广阔[31]。Lee 等[32]合成了尿激酶型纤溶酶原激活物受体(uPAR)靶向磁性氧化铁纳米粒(IONPs)用于 Gem 的递送。前者与氨基末端片段(ATF)结合形成 ATF-IONP-Gem,粒径约 66 nm。该纳米粒 Gem 的释放具有 pH 依赖性,在 pH 5.5 酸性条件下比 pH 7.4 生理条件下药物释放量要高 1.5 ~ 2 倍;该纳米粒同时具有酶依赖性,在 pH 7.4 及含组织蛋白酶 B 情况下释药率为 54%;而在 pH 5.5 及含组织蛋白酶 B 情况下释药率高达 82%;在人胰腺癌细胞系 MIA PaCa-2 裸鼠原位异种移植瘤模型中,与 Gem(抑瘤率 30%)和IONP-Gem(抑瘤率 23%)相比,ATF-IONP-Gem 能够显著抑制胰腺癌细胞的生长(抑瘤率 50%)。上述结果表明,与传统 Gem 治疗相比,体内受体介导的 Gem 靶向递送对胰腺癌的治疗效果更优。
2 共递送
2.1 吉西他滨与小分子抗癌药物的共递送
两种或两种以上药物的共载因其能产生协同作用而备受青睐。共载具有协同作用的药物能够减少单个药物的毒副作用,也能抑制多药耐药的形成。将两种或两种以上药物共载于同一纳米载体中,能改善药物体内药代动力学行为,提高药物的治疗效果,减少药物的副作用[33]。
Poon 等[34]选用DOPC、二油酰磷脂酸(DOPA)和二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-mPEG2000)利用逆向微乳法研制了协同递送奥沙利铂前药(pro-Oxa)和 Gem 的自组装配位聚合物纳米粒(NCP),用于胰腺癌的治疗。在该纳米粒中 pro-Oxa 与 Gem 分别占总质量的 30% 和 12%。该纳米粒平均粒径(49.5 ± 0.6)nm(PDI = 0.062),Zeta 电位近中性;在人胰腺癌细胞系 AsPC-1 和 BxPC-3 中具有很强的协同效应(联合指数 CI < 1);在小鼠结肠癌细胞 C26 荷瘤鼠中静脉注射该纳米粒,其药代动力学实验结果表明:该纳米粒能有效避开单核巨噬系统(MPS)的吞噬,显著抑制肿瘤的生长和增殖,pro-Oxa 和 Gem 的血液循环半衰期分别为(10.1 ± 3.3)h、(8.0 ± 2.3)h,显著延长了 pro-Oxa 和 Gem 血液循环半衰期[pro-Oxa 半衰期(0.01 ± 0.004)h;游离 Gem 半衰期0.5 ~ 1.5 h]。2005 年 FDA 批准 Oxa 和 Gem 联合用药(在第 1 天和第 15 天 60 min 内以剂量 1000 mg/m2静脉注射 Gem;在第 2 和第 16 天,以剂量 100 mg/m2静脉注射奥沙利铂 2 h 以上)进入临床试验用于肝癌的治疗,现已完成了II期临床。但目前仍未见 Oxa 和 Gem 共载递送系统进入临床研究的报道。配位聚合物纳米粒是否具有临床应用价值,仍有待进一步研究。
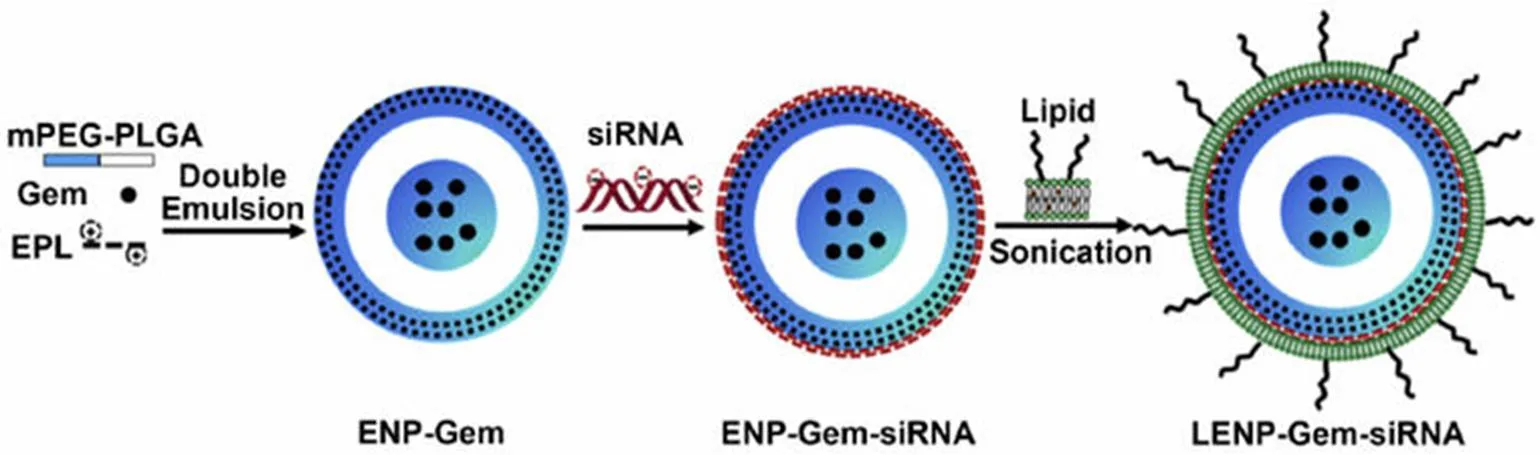
图 3 LENP-Gem-si-HIF1α制备过程示意图[37]
2.2 吉西他滨与小干扰 RNA 的共递送
RNA干扰(RNAi)是双链 RNA 诱导的抑制同源基因表达的现象。耐药性是影响吉西他滨疗效的一个重要原因,自 RNA 干扰现象发现以来,吸引了诸多科学家的关注,旨在借助 RNAi 消除或沉默耐药基因,逆转化疗药物的功效。有报道将特异的小干扰 RNA(siRNA)与吉西他滨共载,递送至体内,沉默吉西他滨的耐药基因,可恢复肿瘤细胞对 Gem 的敏感性,提高药物疗效[35]。
Zhang 等[36]将 Gem 单磷酸和对 c-Myc 癌基因特异性的 siRNA(c-Myc siRNA)包封于同一纳米囊泡中制备了脂质-钙-磷酸盐纳米粒(LCP-NPs),其粒径约 20 nm,电位(28.9 ± 4.5)mV,包封率 75%。在人非小细胞肺癌细胞系 H460 和 A549 皮下荷瘤和原位瘤模型中,分别共递送该纳米粒,均能有效诱导肿瘤细胞凋亡并抑制肿瘤细胞增殖。此外,该研究小组又将靶向血管内皮生长因子(VEGF)的 siRNA 和Gem 单磷酸盐共载到靶向纳米粒中,在 H460 和 A549 皮下荷瘤和原位异种移植瘤模型中进行了系统给药评价,认为与 siRNA 或 Gem 单磷酸盐单药治疗相比,该共载的纳米粒疗效更高,且能降低肿瘤微血管密度。
Zhao 等[37]用双重乳化法制备了生物相容性脂质-聚合物杂化纳米粒用于靶向缺氧诱导因子 1α 的 siRNA(si-HIF1α)和 Gem 的共递送,制备过程见图 3。阳离子ε-多聚赖氨酸共聚物(ENPs)能将荷负电的 si-HIF1α 有效吸附在其表面,同时将 Gem 包封在亲水内核,用 PEG 化脂双层进一步涂覆 ENPs,形成具有相反表面电荷的 ENPs(LENPs)。LENPs 的脂双层能有效防止血清中纳米粒聚集和 si-HIF1α 降解以及 Gem 渗漏,这赋予了 LENP-Gem-si-HIF1α 长循环和缓释特性。研究表明,该共聚物在体内外均有效抑制 HIF1α 的表达,并表现出显著的协同抗癌活性(CI < 1)。该研究为共递送基因特异性 siRNA 和化疗药物,提供了新的思路。
3 结语
吉西他滨属于胞嘧啶核苷衍生物,是治疗非小细胞肺癌、胰腺癌、乳腺癌等的一线药物。由于人体内的脱氧胞苷脱氨酶可迅速降解吉西他滨,导致吉西他滨在体内的半衰期较短。针对这一不足,科学家开展了许多吉西他滨纳米递送系统的研究,旨在延长其半衰期,增效减毒。但是,自 1996 年吉西他滨用于临床以来,至今仍无吉西他滨纳米递送系统问世,笔者认为尽管科学家们做出了诸多探究,但需要解决的问题主要有:①稳定性不良,报道的纳米递送系统的稳定性均不足 3 个月,不具有开发、产业化价值;②作用机制的理论基础不足,纳米化后的药物与游离药相比体内生物学行为以及特性都发生了很大变化,各种递送系统在体内具体的作用机制如何,大多数研究没做清晰阐述,没能为后续的研究提供理论指导,因此,至今缺少突破性进展。今后的研究应具有系统性,如注重和加强吉西他滨体内新型递送系统稳定性、体内药代动力学和体内作用机制等方面的研究。希望在不久的将来,能研制出稳定性好、高效低毒、半衰期长、毒副作用小的吉西他滨纳米递送系统,从根本上改善游离吉西他滨用药带来的不足。
[1] Zhang YS, Tian L, Chen TZ. Application of gemcitabine in various tumors. Chongqing Med, 2018, 47(20):2724-2728. (in Chinese)
张云嵩, 田莉, 陈田子. 吉西他滨在多种肿瘤中的应用. 重庆医学, 2018, 47(20):2724-2728.
[2] Moog R, Burger AM, Brandl M, et al. Change in pharmacokinetic and pharmacodynamic behavior of gemcitabine in human tumor xenografts upon entrapment in vesicular phospholipid gels. Cancer Chemother Pharmacol, 2002, 49(5):356-366.
[3] Yalcin TE, Ilbasmis-Tamer S, Ibisoglu B, et al. Gemcitabine hydrochloride loaded liposomes and nanoparticles: Comparison of encapsulation efficiency, drug release, particle size and cytotoxicity. Pharm Dev Technol, 2018, 23(1):76-86.
[4] Bornmann C, Graeser R, Esser N, et al. A new liposomal formulation of gemcitabine is active in an orthotopic mouse model of pancreatic cancer accessible to bioluminescence imaging. Cancer Chemother Pharmacol, 2008, 61(3):395-405.
[5] Graeser R, Bornmann C, Esser N, et al. Antimetastatic effects of liposomal gemcitabine and empty liposomes in an orthotopic mouse model of pancreatic cancer. Pancreas, 2009, 38(3):330-337.
[6] Xu H, Paxton JW, Wu Z. Development of long-circulating pH-sensitive liposomes to circumvent gemcitabine resistance in pancreatic cancer cells. Pharm Res, 2016, 33(7):1628-1637.
[7] Tong Q, Li H, Li W, et al. In vitro and in vivo anti-tumor effects of gemcitabine loaded with a new drug delivery system. J Nanosci Nanotechnol, 2011, 11(4):3651-3658.
[8] Li T, Chen L, Deng Y, et al. Cholesterol derivative-based liposomes for gemcitabine delivery: preparation, in vitro, and in vivo characterization. Drug Dev Ind Pharm, 2017, 43(12):2016-2025.
[9] Devulapally R, Paulmurugan R. Polymer nanoparticles for drug and small silencing RNA delivery to treat cancers of different phenotypes. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2014, 6(1):40-60.
[10] Misak HE, Asmatulu R, Gopu JS, et al. Albumin-based nanocomposite spheres for advanced drug delivery systems. Biotechnol J, 2014, 9(1):163-170.
[11] Kurrat R, Prenosil JE, Ramsden JJ. Kinetics of human and bovine serum albumin adsorption at silica-titania surfaces. J Colloid Interface Sci, 1997, 185(1):1-8.
[12] Lou J, Hu W, Tian R, et al. Optimization and evaluation of a thermoresponsive ophthalmic in situ gel containing curcumin-loaded albumin nanoparticles. Int J Nanomedicine, 2014, 9:2517-2525.
[13] Yu X, Di Y, Xie C, et al. An in vitro and in vivo study of gemcitabine-loaded albumin nanoparticles in a pancreatic cancer cell line. Int J Nanomedicine, 2015, 10:6825-6834.
[14] Buckley CD, Pilling D, Henriquez NV, et al. RGD peptides induce apoptosis by direct caspase-3 activation. Nature, 1999, 397(6719): 534-539.
[15] Hosotani R, Kawaguchi M, Masui T, et al. Expression of integrin v3 in pancreatic carcinoma: relation to MMP-2 activation and lymph node metastasis. Pancreas, 2002, 25(2):e30-e35.
[16] Ji S, Xu J, Zhang B, et al. RGD-conjugated albumin nanoparticles as a novel delivery vehicle in pancreatic cancer therapy. Cancer Biol Ther, 2012, 13(4):206-215.
[17] Wang L, An Y, Yuan C, et al. GEM-loaded magnetic albumin nanospheres modified with cetuximab for simultaneous targeting, magnetic resonance imaging, and double-targeted thermochemotherapy of pancreatic cancer cells. Int J Nanomedicine, 2015, 10:2507-2519.
[18] Bernkop-Schnürch A, Dünnhaupt S. Chitosan-based drug delivery systems. Eur J Pharm Biopharm, 2012, 81(3):463-469.
[19] Parsian M, Unsoy G, Mutlu P, et al. Loading of gemcitabine on chitosan magnetic nanoparticles increases the anti-cancer efficacy of the drug. Eur J Pharmacol, 2016, 784:121-128.
[20] Xu S, Xu Q, Zhou J, et al. Preparation and characterization of folate-chitosan-gemcitabine core-shell nanoparticles for potential tumor-targeted drug delivery. J Nanosci Nanotechnol, 2013, 13(1): 129-138.
[21] Zhou J, Wang J, Xu Q, et al. Folate-chitosan-gemcitabine core-shell nanoparticles targeted to pancreatic cancer. Chin J Cancer Res, 2013, 25(5):527-535.
[22] Xiao J, Yu H. Gemcitabine conjugated chitosan and double antibodies (Abc-GC-gemcitabine nanoparticles) enhanced cytoplasmic uptake of gemcitabine and inhibit proliferation and metastasis in human SW1990 pancreatic cancer cells. Med Sci Monit, 2017, 23:1613-1620.
[23] Gong J, Chen M, Zheng Y, et al. Polymeric micelles drug delivery system in oncology. J Control Release, 2012, 159(3):312-323.
[24] Daman Z, Ostad S, Amini M, et al. Preparation, optimization and in vitro characterization of stearoyl-gemcitabine polymeric micelles: a comparison with its self-assembled nanoparticles. Int J Pharm, 2014, 468(1-2):142-151.
[25] Han H, Wang H, Chen Y, et al. Theranostic reduction-sensitive gemcitabine prodrug micelles for near-infrared imaging and pancreatic cancer therapy. Nanoscale, 2016, 8(1):283-291.
[26] Bildstein L, Pili B, Marsaud V, et al. Interaction of an amphiphilic squalenoyl prodrug of gemcitabine with cellular membranes. EurJ Pharm Biopharm, 2011, 79(3):612-620.
[27] Maksimenko A, Caron J, Mougin J, et al. Gemcitabine-based therapy for pancreatic cancer using the squalenoyl nucleoside monophosphate nanoassemblies. Int J Pharm, 2015, 482(1-2):38-46.
[28] Réjiba S, Reddy LH, Bigand C, et al. Squalenoyl gemcitabine nanomedicine overcomes the low efficacy of gemcitabine therapy in pancreatic cancer. Nanomedicine, 2011, 7(6):841-849.
[29] Kudgus RA, Szabolcs A, Khan JA, et al. Inhibiting the growth of pancreatic adenocarcinoma, in vitro, and, in vivo, through targeted treatment with designer gold nanotherapeutics. PLoS One, 2013, 8(3):e57522.
[30] Lin G, Mi P, Chu C, et al. Inorganic nanocarriers overcoming multidrug resistance for cancer theranostics. Adv Sci (Weinh), 2016, 3(11):1600134.
[31] Dilnawaz F, Singh A, Mohanty C, et al. Dual drug loaded superparamagnetic iron oxide nanoparticles for targeted cancer therapy. Biomaterials, 2010, 31(13):3694-3706.
[32] Lee GY, Qian WP, Wang L, et al. Theranostic nanoparticles with controlled release of gemcitabine for targeted therapy and MRI of pancreatic cancer. ACS Nano, 2013, 7(3):2078-2089.
[33] Parhi P, Mohanty C, Sahoo SK. Nanotechnology-based combinational drug delivery: an emerging approach for cancer therapy. Drug Discov Today, 2012, 17(17-18):1044-1052.
[34] Poon C, He C, Liu D, et al. Self-assembled nanoscale coordination polymers carrying oxaliplatin and gemcitabine for synergistic combination therapy of pancreatic cancer. J Control Release, 2015, 201:90-99.
[35] Saneja A, Dubey RD, Alam N, et al. Co-formulation of p-glycoprotein substrate and inhibitor in nanocarriers: an emerging strategy for cancer chemotherapy. Curr Cancer Drug Targets, 2014, 14(5):419-433.
[36] Zhang Y, Peng L, Mumper RJ, et al. Combinational delivery of c-myc siRNA and nucleoside analogs in a single, synthetic nanocarrier for targeted cancer therapy. Biomaterials, 2013, 34(33):8459-8468.
[37] Zhao X, Li F, Li Y, et al. Co-delivery of HIF1α siRNA and gemcitabine via biocompatible lipid-polymer hybrid nanoparticles for effective treatment of pancreatic cancer. Biomaterials, 2015, 46:13-25.
国家重点研发计划(2016YFA0201504);中国医学科学院医学与健康科技创新工程(2016-12M-3-013);国家自然科学基金(81673383)
夏桂民,Email:xiaguimin@126.com
2018-10-09
10.3969/j.issn.1673-713X.2019.01.017

