p38 MAPK抑制剂对高糖诱导神经母细胞瘤细胞凋亡的作用及机制
刘瑞婷,朱文瑛,张琳,唐跃,曹铭锋,蒋进皎
(山东大学附属山东省立医院,济南250021)
糖尿病神经病变作为一种常见的糖尿病并发症,严重影响患者的生活质量。早期糖尿病神经病变的研究多集中于糖尿病周围神经病变,近期研究表明,糖尿病对中枢神经系统同样存在损伤。研究表明,糖尿病患者可出现记忆力、定向力等认知功能下降,同时可出现人格改变、学习能力下降等[1~4]。目前,糖尿病中枢神经病变的分子机制尚未充分阐明,阻碍了其治疗的进一步进展。既往研究表明,糖尿病患者脑神经元凋亡较无糖尿病病史患者明显增多[5];糖尿病小鼠模型神经元凋亡较正常对照组增加[6];高糖处理神经元细胞可促进神经元细胞凋亡的发生[7]。研究结果证实,丝裂原活化蛋白激酶p38 (p38 MAPK)作为细胞凋亡调控密切相关的激酶,在高糖作用下其活性显著增加[8]。因此认为,高糖环境可能通过调节p38 MAPK活性以调控神经元细胞凋亡。2017年9月~2018年5月,本研究观察高糖对神经母细胞瘤细胞SH-SY5Y凋亡及凋亡相关蛋白表达的影响,并探讨p38 MAPK在其中的作用。
1 材料与方法
1.1 细胞、试剂及仪器 SH-SY5Y细胞,购于美国菌种保藏中心。抗磷酸化p38 MAPK及总p38 MAPK均购于美国Cell Signaling Technology公司,抗BAX、BID、BCL-2、BAD抗体均购于中国Proteintech公司,p38 MAPK抑制剂购于美国Sigma公司,Annexin V-PI染色试剂盒购于中国碧云天生物技术公司,ECL显色液购于美国Millipore公司,胎牛血清购于美国Gibco公司,谷氨酰胺购于美国Sigma公司,青链霉素双抗购于美国Sigma公司。蛋白电泳仪及电泳槽购于美国Bio-rad公司,显影仪购于美国Thermo公司,荧光显微镜购于德国Zeiss公司。
1.2 细胞培养及处理 SH-SY5Y细胞采用含10%的胎牛血清、100 U/mL的青链霉素双抗、2 mmol/L的谷氨酰胺的DMEM高糖培养基,在37 ℃、含5%二氧化碳的孵箱中进行培养。于无血清培养基中培养12 h,随机进行分组,A、B、C组分别加入45、90、135 mmol/L高糖处理1.5、3、6 h,D、E组分别加入10、25 μmol/L的p38 MAPK抑制剂PD169316预处理30 min,之后加入135 mmol/L高糖溶液培养12 h。对照组仅常规培养不做干预。另随机选部分细胞用135 mmol/L高糖处理3 h作为高糖对照组。
1.3 细胞内磷酸化p38 MAPK及凋亡相关蛋白检测 采用Western blotting法。细胞处理后,用预冷的PBS洗涤细胞3次,加入含有PMSF及磷酸酶抑制剂的RIPA,冰上裂解30 min,离心后取上清,BCA法测定蛋白浓度,加入上样缓冲液后沸水煮10 min变性。根据蛋白浓度调整上样量,12%的SDS-聚丙烯凝胶电泳后电转至PVDF膜,5%脱脂奶粉室温封闭1 h,一抗4 ℃孵育过夜,PBS洗膜后二抗室温孵育1 h,采用ECL法显影。目的蛋白条带密度与对应内参比较后,以相应对照组的倍数作为目的蛋白相对表达量。
1.4 细胞凋亡检测 采用Annexin V-PI染色法。细胞处理后,根据试剂盒说明书采用Annexin V-FITC及PI染色,荧光显微镜细胞染色情况并拍照。绿色染色代表凋亡早期细胞,红色染色代表凋亡中晚期及死亡细胞。

2 结果
2.1 高糖对细胞内磷酸化p38 MAPK及细胞凋亡相关蛋白表达的影响 高糖处理1.5 h,与对照组比较,其他各组磷酸化p38 MAPK蛋白相对表达量高(P均<0.05),而总p38 MAPK蛋白表达变化不大,差异无统计学意义(P均>0.05);各组BCL-2蛋白相对表达量低,其中C组与对照组比较差异有统计学意义(P<0.05),而BAX、BAD、BID蛋白相对表达量较对照组高,其中B、C组的BAX蛋白,C组的BAD蛋白,B组的BID蛋白相对表达量与对照组比较差异有统计学意义(P均<0.05)。高糖处理3 h,与对照组相比,各组磷酸化p38 MAPK蛋白相对表达量呈浓度依赖性升高(P均<0.05),而总p38 MAPK蛋白表达变化不大,差异无统计学意义(P均>0.05)。与对照组相比,各组BCL-2蛋白相对表达量呈浓度依赖性降低,但仅C组与对照组差异有统计学意义(P<0.05);各组BAX、BAD、BID蛋白相对表达量均呈浓度依赖性升高,与对照组相比差异均有统计学意义(P均<0.05)。高糖处理6 h后,与对照组相比,各组磷酸化p38 MAPK蛋白相对表达量呈升高趋势,其中A组升高更为明显,而B、C组均较A组低(P均<0.05)。总p38 MAPK在高糖处理后变化较对照组均无统计学意义(P均>0.05)。BCL-2蛋白相对表达量呈浓度依赖性降低,其中B、C组与对照组比较差异有统计学意义(P均<0.05)。与对照组相比,A、B组BAX蛋白相对达量高(P均<0.05),A、B、C组BAD蛋白相对达量高(P均<0.05),A组BID蛋白相对达量高(P<0.05)。见表1。
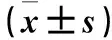
表1 高糖对细胞内磷酸化p38 MAPK及细胞凋亡相关蛋白表达的影响
2.2 p38 MAPK抑制剂对细胞内磷酸化p38 MAPK及细胞凋亡相关蛋白表达的影响 与高糖对照组比较,D、E组磷酸化p38 MAPK蛋白相对表达量低(P均<0.05),BCL-2蛋白相对表达量高(P均<0.05),BAD蛋白及BID蛋白相对表达量低(P均<0.05),E组以上指标变化最明显(P均<0.05)。见表2。
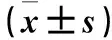
表2 p38 MAPK抑制剂对细胞内磷酸化p38 MAPK及细胞凋亡相关蛋白表达的影响
2.3 p38 MAPK抑制剂对各组细胞凋亡的影响 根据染色结果与对照组比较,C组细胞凋亡重;与C组比较,E组细胞凋亡轻。
3 讨论
作为中枢神经系统的重要组成部分,神经元损害在中枢神经系统的损伤中起重要作用。既往研究表明,高糖环境中培养的神经元细胞可能出现Aβ沉积、突触数目减少,突触功能异常等损害[9];糖尿病动物模型的研究也证实长期高糖可能导致动物发生学习能力减低[10];流行病学调查证实,糖尿病患者较非糖尿病患者语言学习能力降低[11],2型糖尿病患者疾病晚期可出现中枢神经系统病变[12],而早发的1型糖尿病患者可能出现中枢神经系统发育的异常及认知功能减低[2,13]。因此,研究高糖引起神经元损害的机制对高糖引起的中枢神经系统疾病的治疗具有极其重要的意义。
p38 MAPK是真核细胞中高度保守的激酶,广泛分布于全身各种器官及组织。作为压力激活性激酶,p38 MAPK参与包括细胞凋亡、细胞因子产生、转录调节等等在内的诸多调控过程[14]。在多种高血糖影响的细胞信号通路中,p38 MAPK与高糖刺激的关系非常密切,在高糖环境下p38 MAPK活性显著增加,激活的p38 MAPK在肝脏糖脂代谢、骨骼肌及脂肪组织糖分摄取、炎性因子产生以及凋亡调控中发挥重要作用,与细胞的凋亡及死亡密切相关[15],而且,应用p38 MAPK抑制剂显著改善了糖尿病引起的伤口愈合不良[16]。同时,p38 MAPK为在神经细胞的功能和凋亡调控中发挥重要作用[17],p38 MAPK通路的抑制对神经细胞具有保护作用[18,19]。因此我们认为,p38 AMPK通路抑制剂在减轻糖尿病相关的神经元损伤中有一定价值。
神经细胞的凋亡在神经系统功能的损害中发挥重要作用[20]。目前已知的凋亡途径共有3种:线粒体途径、内质网途径以及死亡受体途径,其中线粒体途径是凋亡调控的主要途径。线粒体凋亡途径主要通过BCL家族调节,包括主要对凋亡起抑制作用的BCL-2亚家族(BCL-2),对凋亡起促进作用的BAX亚家族(BAX)以及BCL-2同源的结构域3亚家族(BAD、BID),当细胞被某些外界或内在信号影响,凋亡促进蛋白及凋亡抑制蛋白之间的平衡稳态被打破时,凋亡途径将被激活,出现细胞凋亡[21,22]。研究表明,BCL-2、BAX、BAD、BID作为重要的凋亡调控蛋白,在脑组织中发挥重要作用[23]。
本研究采用不同浓度的高糖处理SH-SY5Y细胞,结果显示,高糖可显著促进p38 MAPK的磷酸化,同时增加促凋亡蛋白BAX、BAD、BID的表达,而凋亡抑制蛋白BCL-2的表达则降低,此作用在处理持续3 h时达到顶峰,其中C组p38 MAPK磷酸化程度及各凋亡相关蛋白表达均较为明显,因此后续p38 MAPK抑制剂相关试验我们选择此处理浓度及时间点。加入p38 MAPK抑制剂可显著减少高糖引起的细胞凋亡及凋亡蛋白的表达。可见高糖浓度的培养基对SH-SY5Y细胞的凋亡有促进作用,该作用可能是通过增加p38MAPK的磷酸化并影响凋亡相关蛋白的表达来实现的。该作用在处理3 h时达高峰。
综上所述,本研究证实高糖可促进SH-SY5Y细胞凋亡,而p38 MAPK抑制剂可抑制高糖导致的SH-SY5Y细胞凋亡,这为后续糖尿病中枢神经系统保护药物的研究提供了理论基础。

