NLRP3基因敲除对非酒精性脂肪性肝炎小鼠的影响
邓涛,龚建平,何堃
(1重庆市永川区中医院,重庆402160;2重庆医科大学附属第二医院)
非酒精性脂肪性肝炎(NASH)已成为全球范围内的慢性肝脏疾病,其以肝细胞游离脂肪酸(FFA)沉积、肝细胞损伤、小叶内炎症为特征[1]。肥胖、代谢异常、2型糖尿病、高血压及血脂异常等是NASH发生发展的高危因素[2,3]。NASH患者肝脏存在广泛脂毒性,主要以大量脂肪酸沉积,导致肝细胞内总胆固醇、甘油三酯水平升高,FFA的利用和摄取失衡,肝细胞损伤,炎症因子释放,最终导致NASH[2,4]。其疾病发展走向为从NASH到肝硬化,甚至发展为肝癌[4]。目前国际上认为单纯性脂肪肝(NAFLD)对人体不足以造成不可逆转的危害,属于良性病变,但一旦发展为NASH,就很有可能发展为肝癌[5,6]。NASH是NAFLD发展过程中的关键步骤。有研究提出NASH的发生发展与“二次打击”学说有关[7,8]。促炎因子白细胞介素1β(IL-1β)的分泌与点头样受体3(NLRP3)炎症小体的激活密切相关,而NLRP3炎症小体的激活又与高脂饮食脂肪酸的大量摄入有关[7,9]。NLRP3炎症小体通过各种信号通路控制IL-1β的成熟和分泌,导致肝脏慢性炎症的发生发展。IL-1β导致的肝脏慢性代谢性炎症在NAFLD向NASH的发展过程中发挥重要作用,是肝脏脂质代谢紊乱的重要影响因素[10,11]。2017年1月~2018年3月,本研究探讨NLRP3炎症小体在NASH小鼠发病过程中的确切作用。
1 材料与方法
1.1 动物、试剂及仪器 雄性野生型(WT)C57BL/6小鼠20只,6~8周龄,体质量(20±2)g;雄性NLRP3基因敲除(NLRP3-/-)小鼠20只,6~8周龄,体质量(20±2)g。小鼠均为清洁级,均购自重庆医科大学实验动物中心。NLRP3-/-小鼠在重庆医科大学实验动物中心自行繁殖,实验操作符合重庆医科大学实验动物伦理保护标准及国家相关法律规定。氨酸胆碱缺乏的饲料购于美国Research diets公司,Western blotting所用抗体及IL-1β检测试剂盒购于Abcam公司,免疫荧光所用共聚焦显微镜为Nikon C1+。
1.2 动物分组及饲养方法 用普通饲料(ND组,n=10)与蛋氨酸胆碱缺乏的饲料(MCD组,n=10)分别喂养WT小鼠、NLRP3-/-小鼠4周,喂养结束后经眼球取血,分离血清。处死小鼠,取其肝脏。
1.3 肝组织病理变化观察 采用苏木素伊红(HE)染色法。取肝组织放入甲醛溶液中固定48 h,用石蜡包埋,制作切片,按照HE染色说明书进行染色,镜下观察肝组织病理变化。
1.4 血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、FFA及IL-1β检测 将血清标本从-80 ℃冰箱取出,放在冰上逐渐融化,用速率法检测ALT及AST水平,用酶法检测FFA水平,用ELISA法检测IL-1β水平。
1.5 肝组织中NLRP3、ASC及半胱氨酸的天冬氨酸蛋白水解酶1(Cleaved-Caspase-1)蛋白表达检测 采用Western blotting法。配制SDS-PAGE凝胶,把蛋白样品和maker上样到凝胶加样孔内,电泳液进行电泳,用电转液转膜,BSA封闭,用相应抗体孵育一抗过夜,洗膜3次,用相应二抗孵育,洗膜3次,显影仪上显影。目标蛋白相对表达量=目标蛋白灰度值/内参蛋白灰度值。

2 结果
2.1 各组肝组织病理变化比较 ND组WT小鼠肝细胞无脂肪变,排列整齐,无炎症细胞浸润,肝血窦间隙正常;MCD组WT小鼠肝细胞脂肪变明显,排列紊乱,胞质疏松呈空泡状,部分细胞核肿胀,脂滴将肝细胞核挤压至胞质的边缘。ND组NLRP3-/-小鼠肝细胞同WT小鼠ND组,而MCD组NLRP3-/-小鼠肝组织损伤程度较MCD组WT小鼠明显减轻,肝细胞气球样变及炎症细胞浸润均不明显。
2.2 各组血清ALT、AST、FFA、IL-1β水平比较 MCD组WT小鼠血清ALT、AST水平较ND组高(P均<0.05);MCD组NLRP3-/-小鼠血清ALT、AST水平较ND组高,但差异无统计学意义(P均>0.05)。MCD组WT小鼠与NLRP3-/-小鼠血清FFA水平均较ND组高(P均<0.05)。MCD组WT小鼠血清IL-1β水平较ND组高(P均<0.01),NLRP3-/-小鼠血清IL-1β水平较ND组高,但差异无统计学意义(P均>0.05)。见表1。
表1各组血清ALT、AST、FFA、IL-1β水平比较

2.3 各组肝组织中NLRP3、ASC及Caspase-1蛋白表达比较 MCD组WT小鼠肝组织中NLRP3、ASC和Cleaved-Caspase-1蛋白表达较ND组高(P均<0.05),MCD组NLRP3-/-小鼠ASC、Cleaved-Caspase-1蛋白表达与ND组比较差异无统计学意义(P均>0.05)。见表2。
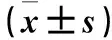
表2 各组肝组织中NLRP3、ASC及Cleaved-Caspase-1蛋白表达比较
3 讨论
代谢性炎症在NASH的发生发展中起重要作用[12,13]。有研究发现,NASH的发生发展与多种因素有关,包括饮食、环境因素、先天免疫因素、肝细胞损伤、细胞凋亡等。在通常情况下细胞维持内外环境平衡,当炎症因子的活化和抑制失衡,导致免疫系统受损,细胞损伤,从而发生疾病[14~16]。有研究认为,Kupffer细胞(KCs)中NLRP3炎症小体和IL-1β信号通路的激活在NASH的发生发展起重要作用[17,18]。
NLRP3炎症小体由NLRP3、ASC、Caspase-1组成[19]。有研究发现,当机体受到FFA等刺激时,机体NLRP3活化增高,促进IL-1β分泌,这一过程是导致NASH形成的关键[20]。NLRP3炎症小体多在KCs胞质中表达,而KCs是NASH发展过程中的关键细胞,且大量存在于肝脏中[21~23]。本研究结果发现,MCD饲料诱导的NASH小鼠肝脏组织中FFA、NLRP3、IL-1β高表达。FFA可作为触发NLRP3炎症小体活化的扳机,导致肝脏组织中NLRP3表达增高。血清中FFA水平增高,刺激KCs分泌大量促炎因子IL-1β,对肝脏细胞造成炎症损伤[24,25]。
NLRP3在炎症活化过程中起关键作用。本研究结果发现,MCD饲料可诱导WT小鼠NASH形成,敲除小鼠NLRP3基因可以明显抑制MCD饲料导致的小鼠NASH形成,减轻肝脏损伤。MCD饲料喂养的WT小鼠血清ALT、AST升高,可见其肝细胞受到损伤;而NLRP3-/-小鼠血清ALT、AST升高不明显,血清中促炎因子IL-1β水平亦明显下降,可见NLRP3-/-可以明显减轻MCD饲料导致的肝细胞损伤,减轻肝组织炎症程度,阻止NASH形成。
Cleaved-Caspase-1是Caspase激活后具有催化活力的产物。本研究结果表明,NASH小鼠肝组织中NLRP3、ASC及Cleaved-Caspase-1蛋白表达增加,而NLRP3-/-小鼠肝组织中表达降低。证实NLRP3在NASH的形成过程中发挥重要作用。Henao-Mejia等[26]研究发现,NLRP3-/-小鼠发展为更加严重的NASH,该结果的发生与体内肠道益生菌紊乱有关,该研究结果与本研究结果不同。有研究发现,NLRP3的激活可能存在活性氧自由基(ROS)的产生,溶酶体的损伤,钾离子的刺激这三种机制[27]。钾离子、溶酶体、ROS的稳态失衡会导致线粒体的功能紊乱,而细胞内线粒体的功能状态,与NLRP3炎症小体的激活有密切关系[27,28]。
众所周知,线粒体是细胞内氧化磷酸化和合成三磷酸腺苷(ATP)的主要场所,线粒体能够合成ATP为细胞活动供应能量,参与细胞信息传递和细胞凋亡等过程[29,30]。而有研究指出持续的ROS过氧化反应不仅可通过诱导磷脂酸的过氧化反应从而导致线粒体膜电位的紊乱,还能促进KCs释放炎症因子肿瘤坏死因子α(TNF-α)和IL-1β[29,31]。目前认为线粒体氧化应激是NLRP3炎症小体激活的三种可能机制的聚集点。最近有研究证实巨噬细胞在受到NLRP3炎症小体激动剂ATP刺激后,线粒体出现功能受损,并释放出氧化线粒体DNA(mtDNA),氧化mtDNA与NLRP3结合,并导致NLRP3炎症小体的激活,导致促炎因子IL-1β大量分泌,从而导致肝细胞损伤,NASH的形成[32],其中mtDNA在NLRP3炎症小体的激活过程中发挥核心作用;而当小鼠敲除NLRP3基因后,在其肝脏巨噬细胞胞质中未发现氧化mtDNA,并且IL-1β的分泌也明显减少,敲除小鼠NLRP3基因后,MCD饲料喂养的小鼠NASH形成不明显。因此,推测FFA可能通过作用于KCs中线粒体,导致其功能损伤,释放的氧化mtDNA与NLRP3炎症小体结合,并激活NLRP3炎症小体。氧化mtDNA可能为介导FFA激活NLRP3炎症小体的重要中间介质。
本研究结果表明FFA可促进肝脏NLRP3表达增高及NLRP3炎症小体激活,促进促炎因子IL-1β的分泌,从而诱导WT小鼠NASH形成。敲除小鼠NLRP3基因可明显减轻炎症反应,阻止NASH的发生发展。NLRP3有望成为抑制NASH发生发展的关键靶点。但本研究也有一定局限性,未探讨NLRP3导致肝脏NASH形成的确切机制。NLRP3可通过线粒体等来影响肝脏状态,后期研究将重点探讨NASH形成过程中NLRP3炎症小体激活的确切机制。

