燕窝低聚肽制备工艺及生物学评价
高建萍,姚之龙,张贵锋
(1.中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190;2.衡水第一中学,衡水 053000)
燕窝含多种蛋白和碳水化合物,蛋白质主要以糖蛋白的形式存在[1-2]。近年来大量研究表明食用燕窝具有增强免疫力、调节血压和提高代谢速率等多种价值[3-4]。燕窝中的糖蛋白主要以黏蛋白的形式存在,唾液酸是其主要的糖基[5]。天然黏蛋白通过酶法进行降解存在一定难度,随着年龄的增长,人体分泌的蛋白酶逐渐下降,人体摄入蛋白之后存在难以消化及蛋白质生物利用度不高等问题,因此,采用体外降解将燕窝制备成低聚肽的技术引起广泛关注[6]。
燕窝中非水溶性成分经模拟胃肠液降解后会释放出黏液素、几丁质酶类似物和部分球蛋白的降解物[7]。刘琳等采用糖苷酶将非变性的燕窝黏蛋白进行预处理,采用蛋白酶进行降解,酶解产物中检测出与生长因子具有相同局部序列的蛋白[8]。燕窝经过80°C热水处理后进行蛋白提取,提取液中存在蛋白聚糖,体外活性分析结果表明这些成分可保护关节软骨,对抑制类风湿关节炎效果显著[9]。燕窝经过胰酶降解后的混合物中存在可显著抑制流感病毒的组分,这些活性成分主要是多肽或糖肽类物质[10]。这些研究表明燕窝经过提取或降解处理后,不仅有利于吸收而且会表现出多种生物活性。因此,研究并建立燕窝低聚肽的制备工艺对于提高燕窝生物活性等具有重要意义。
采用不同的生物酶研究对燕窝中黏蛋白的降解行为,比较酶解前后燕窝蛋白质含量、氨基酸组成及唾液酸含量变化,并采用动物实验评价燕窝低聚肽的生物学活性,为基于燕窝的深加工技术提供科学依据。
1 材料与方法
1.1 材料
毛燕窝由马来西亚瑞玛燕窝有限公司提供;胰蛋白酶购自北京格源天润生物科技有限公司;胃蛋白酶、碱性蛋白酶、中性蛋白酶分别购自南宁庞博生物工程有限公司。刀豆蛋白A(ConA)购自美国Sigma试剂公司,CCK8试剂盒和乳酸脱氢酶细胞毒性检测试剂盒购自上海碧云天生物技术有限公司。色谱纯乙腈(ACN)及三氟乙酸(TFA)购自Merck 公司;其他试剂均为市售分析纯。淋巴瘤细胞YAC-1购自国家实验细胞资源共享平台。
BALB/c雌性小鼠(6~8周龄)购自北京维通利华实验动物技术有限公司。
1.2 仪器
胶体磨购自廊坊市惠友机械有限公司;喷雾干燥机为瑞士Buchi公司B290。HPLC为美国Agilent 1260系统,离子阱质谱(LCQ DecaXP)和三重四级杆质谱(TSQ)均为美国Thermo公司仪器,质谱数据采集和分析软件分别为Xcalibur1.3 和Biowroks3.1,凝胶过滤色谱柱TSk 2000SW购自Tosoh公司。
1.3 燕窝低聚肽制备方法
1)清洗:取100.0 g毛燕窝加入1 L去离子水,浸泡3.0 h后过滤,使用2.0 L去离子水清洗2次。2)粉碎:将毛燕窝悬浮在1.5 L去离子水中,使用胶体磨将毛燕窝打成浆状。3)酶解:将毛燕窝浆装入2.0 L的玻璃反应釜中,将加入1.0 mol/L的Na2CO3将pH值调至8.0,将夹套温度调至38℃,按照燕窝∶酶=100∶1的质量比例加入胰蛋白酶(250 U/mg),搅拌速率控制在120.0 r/min。在酶解过程中分时取样。4)固液分离:将酶解产物使用300目滤网进行过滤,收集透过液,将透过液在10 000 r/min条件下进行离心5 min,收集上清液。5)喷雾干燥:进风温度195.0℃,出口温度100.0℃,进风气流量,5.0 m3/min。将酶种类分别更换为胃蛋白酶(250 U/mg)、碱性蛋白酶(250 U/mg)和中性蛋白酶(200 U/mg)并将溶液调至合适的pH值条件,按照燕窝∶酶=100∶1的质量比例加入燕窝浆中,重复上述实验。
1.4 分析方法
1)氨基酸组成分析。采用2,4-二硝基氟苯(DNFB)柱前衍生的方法对燕窝中的氨基酸组成进行分析。氨基酸高效液相色谱分离条件,色谱柱:Zorbax C18(4.6×250 mm,5 μm);流动相:A为0.05 mol/L 乙酸钠水溶液,B为50%乙腈水溶液(V/V);梯度:0~15 min,30%~55% B,15~25 min,55%~100% B,25~35 min,100%~30% B,35~45 min,30% B保持10 min;流速:0.5 mL/min;检测波长:360 nm;柱温:32.0℃;上样量5.0 μL。毛燕和燕窝肽的氨基酸组成分析方法参照文献[11]。2)分子量范围测定。凝胶过滤色谱法(HPSEC)分析,色谱柱:TSK2000SW(300 mm × 7.5 mm I.D.,10 μm);流动相:乙腈∶水∶三氟乙酸=45∶55∶0.1(体积比);流速:0.5 mL/min;检测波长:220 nm;进样量:10 μL。参照国家标准[12]中的方法。3)唾液酸含量分析。采用邻苯二胺盐酸盐衍生化法测定燕窝中的唾液酸含量。唾液酸高效液相色谱分离条件,色谱柱:Zorbax C18(3.0×150 mm,5 μm);流动相:乙腈∶水=18∶85(体积比);流速:1.0 mL/min;检测波长:230 nm;进样量:10 μL。参照文献[13]中的方法。4)LCQ质谱测定方法。色谱柱:Zobarx SB C18(150×2.1 mm I.D.,5 μm);流动相A:水(含0.1% TFA),B:乙腈(0.1% TFA);梯度:0~90 min,5%~80%B;流速:0.2 mL/min;柱温:30℃;质谱条件:ESI电喷雾离子源喷雾电压4.5 kV,加热电压15.0 V,离子导入电压-20.0 V,壳气流速:60.0 arb,辅助气流速:5.0 arb,离子传输毛细管温度:300.0℃。
1.5 功效评价
1)小鼠淋巴细胞增殖活性检测。BALB/c小鼠(雌性,6~8周龄)给予口服生理盐水、燕窝和燕窝低聚肽进行处理,正常成年人燕窝食用量4.5~9 g/d,实验以6~8周小鼠,体重20.0 g以上,每天喂食10.0 mg,相当于成人每天食用4.5 g[14],共14 d,于第15天取小鼠脾脏,于生理盐水中研磨后,将脾细胞以5×104每孔种于96孔细胞培养板,加入Con A(10 μg/mL)刺激48 h后,使用CCK8试剂盒测定淋巴细胞增殖活性[15-16]。2)小鼠NK细胞活性检测。上述药物处理小鼠脾细胞5×104与淋巴瘤细胞YAC-1 1×104种于96孔细胞培养板共培养4 h后,500.0 r/min离心取上清,以乳酸脱氢酶细胞毒性检测试剂盒测定NK细胞对YAC-1细胞的细胞毒活性[17]。
1.6 统计学分析
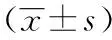
2 结果与讨论
2.1 燕窝酶解工艺研究
燕窝中能在常温水中溶解的蛋白质含量较低,浸泡过程中水溶液中几乎检测不出水溶性蛋白质,将浸泡后的燕窝进行胶体磨打浆处理后,溶液中仅释放出少量分子量较低的蛋白质(图1);将燕窝浆60℃加热处理1 h后,溶液中逐渐释放出水溶性蛋白质,凝胶过滤色谱分析结果表明这些释放的主要蛋白质分子量范围80~100 ku,而低分子量水溶性蛋白质的含量低于10%(图1)。在60℃条件下将加热时间延长至3 h,水溶性蛋白质的总释放量增加了300%,但分子量范围几乎没有变化。
为了提高燕窝中的蛋白质释放量并加速蛋白质酶解过程,实验首先使用了胰蛋白酶,将燕窝匀浆经过60℃热处理1 h后进行酶解处理。在37℃下加入1%胰蛋白酶后搅拌处理1 h后上清液的凝胶过滤色谱图,结果表明溶液中逐渐释放出低分子量的多肽,根据色谱峰面积定量方法计算得到低分子量的多肽含量达到16%(图2);随着酶解时间延长,溶液中低分子量多肽的比例逐渐升高;酶解2.0 h后溶液中多肽含量较酶解1 h的含量提高了3倍,虽然分子量范围无显著差异,但溶液中固形物含量大幅度下降。随着酶解时间的延长,色谱图中保留时间在11 min的组分含量逐渐降低,酶解3.0 h后溶液中燕窝几乎全部被降解,肉眼观察不到燕窝固形物,色谱图中保留时间为11 min的组分含量不足5%,溶液中多肽的保留时间较酶解2 h的保留时间明显右移,表明溶液中释放出的蛋白质逐渐被酶解为多肽;继续延长酶解时间,色谱图中酶解产物内多肽的分子量继续向右移动,酶解4 h后溶液中逐渐形成了保留时间为24、27.5和30 min的分子量小于5 ku的低聚肽,与酶解3 h的溶液相比,保留时间为24 min的多肽逐渐被降解为保留时间为27.5和30 min的低聚肽。4 h后继续延长酶解时间,多肽平均分子量有所下降,但保留时间为11 min组分的含量没有显著降低,可能是燕窝中存在一定量难以被降解的蛋白。
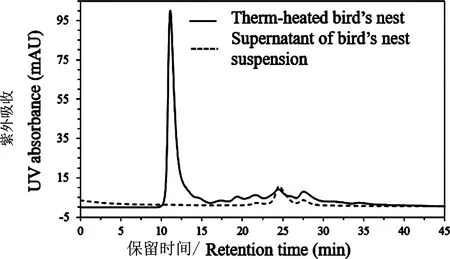
图1 燕窝清洗后水溶液和热处理后溶液凝胶过滤色谱图Figure 1 Gel filtration chromatogram of washing solution of bird′s nest and the supernatant of thermo-heated bird′s nest
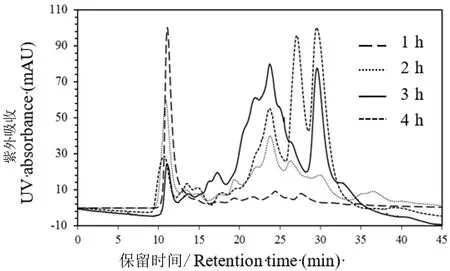
图2 不同酶解时间条件下燕窝水解物凝胶过滤色谱图Figure 2 Gel filtration chromatogram of tryptic digest of raw bird′s nest with different digest time
燕窝中蛋白质含量在60%左右,文献报道的燕窝蛋白质主要是黏蛋白且糖基化程度较高[8],在非变性条件下难以被酶解;为了便于酶解处理并提高酶解效率,实验首先对燕窝进行了热变性处理。由于蛋白质高温条件下长时间热变性处理易导致随机降解,且在多糖存在的条件下易发生美拉德反应并形成希夫碱等有色物质,为此实验选择了可促使蛋白变性并溶解的合适温度。文献报道60℃~80℃条件下部分蛋白质可释放,但部分蛋白质在长时间(3~5 h)提取条件下方可得以释放[18],为此实验选择了60℃作为预处理温度。酶解过程中燕窝残留量变化以及基于凝胶过滤色谱的分子量范围分析结果表明,该条件可以制备出燕窝低聚肽。
为了研究不同蛋白酶对燕窝降解的影响,实验在相同的工艺条件下使用胃蛋白酶、碱性蛋白酶和中性蛋白酶等进一步考察了脱毛燕窝的降解过程。图3是不同条件下燕窝悬浮物中未降解燕窝的残留量随酶解时间的变化曲线。结果表明碱性蛋白酶和中性蛋白酶对燕窝的降解作用不显著,酶解6 h后溶液中不溶物的残留量仍高达40%以上;基于胃蛋白酶的燕窝降解速率显著高于碱性蛋白酶和中性蛋白酶,酶解3 h和4 h后固形物残留量分别为18%和10%,但酶解速率显著低于胰蛋白酶。另外,胃蛋白酶催化作用最适pH 2.5~3.0,反应结束后需要加入大量的碱将溶液pH调至中性,导致获得的低聚肽具有一定咸味,胰蛋白酶的最适pH 8.0,反应结束后加入少量酸即可调至中性,可降低钠的使用量。天然燕窝可在自然界长期存在而不被微生物降解,其可能原因是微生物分泌的酶难以有效降解燕窝中的黏蛋白。胰蛋白酶和胃蛋白等动物来源的酶与微生物分泌的酶存在差异,图3表明这些酶对燕窝中蛋白的降解效率高于微生物分泌的酶。实验采用胰蛋白酶作为生物催化剂,进一步考察了酶解后低聚肽粉的分子量范围、氨基酸组成以及生物活性等。
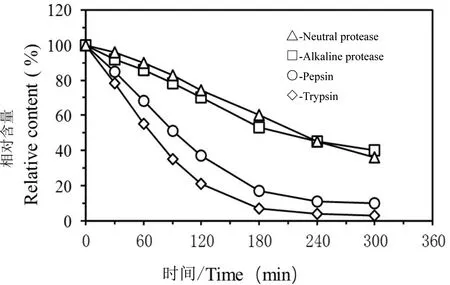
图3 酶解过程中燕窝降解曲线Figure 3 Degradation process of bird′s nest during enzymatic processing
2.2 燕窝酶解产物分析
对毛燕窝和燕窝低聚肽的氨基酸组成进行了分析(表1),毛燕窝18种氨基酸的含量为45.6%,经过预处理和酶解后氨基酸含量提高到50.1%。虽然燕窝清洗过程会导致少量可溶性蛋白组分的流失,但也会导致燕窝中无机盐含量大幅度降低;此外毛燕窝中还存在少量的羽毛和木屑等组分,酶解过程中这些组分难以被降解,酶解产物经喷雾干燥后总氨基酸含量会有所提高。
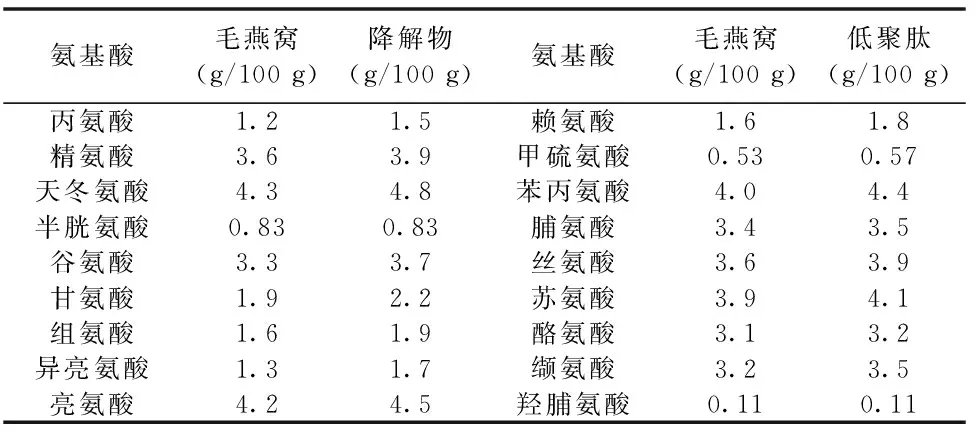
表1 燕窝及其低聚肽氨基酸组成分析结果Table 1 Amino acid compostion of bird′s nest and tryptic digest
氨基酸组成分析结果中含量较高的依次为天冬氨酸(含天冬酰胺)、亮氨酸、苯丙氨酸、苏氨酸、精氨酸和丝氨酸等。燕窝中含有大量的唾液黏蛋白,唾液黏蛋白属于糖蛋白,该类蛋白质中N-连接的糖基化位点主要发生在天冬酰胺,O-连接的糖基化位点主要发生在丝氨酸和苏氨酸[19]。毛燕窝中氨基酸组成分析结果中天冬氨酸(含天冬酰胺)、丝氨酸和苏氨酸的含量分别高达4.3%、3.6%和3.9%,唾液黏蛋白属高糖基化蛋白,尤其是N-连接的糖链含量较高,氨基酸组成分析结果与唾液黏蛋白的结构性质较为对应。毛燕窝中甲硫氨酸的含量极低,唾液黏蛋白中蛋氨酸含量较低,进一步证明了燕窝提取物中含有大量唾液黏蛋白。
雨燕科动物中识别出的蛋白质数量有限,实验利用液质联用与多肽检测相结合的技术从燕窝蛋白的酶解产物中检索出多肽FVSNTTLK,由于目前蛋白质数据库中雨燕的蛋白质较少,实验采用序列检索方法检索了含有该序列的其他动物来源的蛋白质,检索结果表明数据库蛋白质A6P6W2_COTJA(鹌鹑)、F1NG99-CHICK(鸡)、G1NAI9-MELGA(火鸡)、H0ZEE4-TAEGU(雀)中均含有序列FVSNTTLK等,实验采用相同的分析方法从燕窝中识别出20种不同类型的蛋白质,识别结果见表2。实验采用飞行时间质谱分析了酶解后低聚肽的分子量(图4)。经过MALDI-TOF分析得到的燕窝蛋白的分子量与文献中报道的燕窝分子量约为60 ku一致[20]。酶解后的燕窝分子量较低,丰度较高的低聚肽的质荷比主要集中在1~6 ku,其中2~4 ku范围内较为集中,在MADLI-TOF中低聚肽主要以单电荷形式存在,与基于凝胶过滤色谱的分子量范围检测结果吻合。
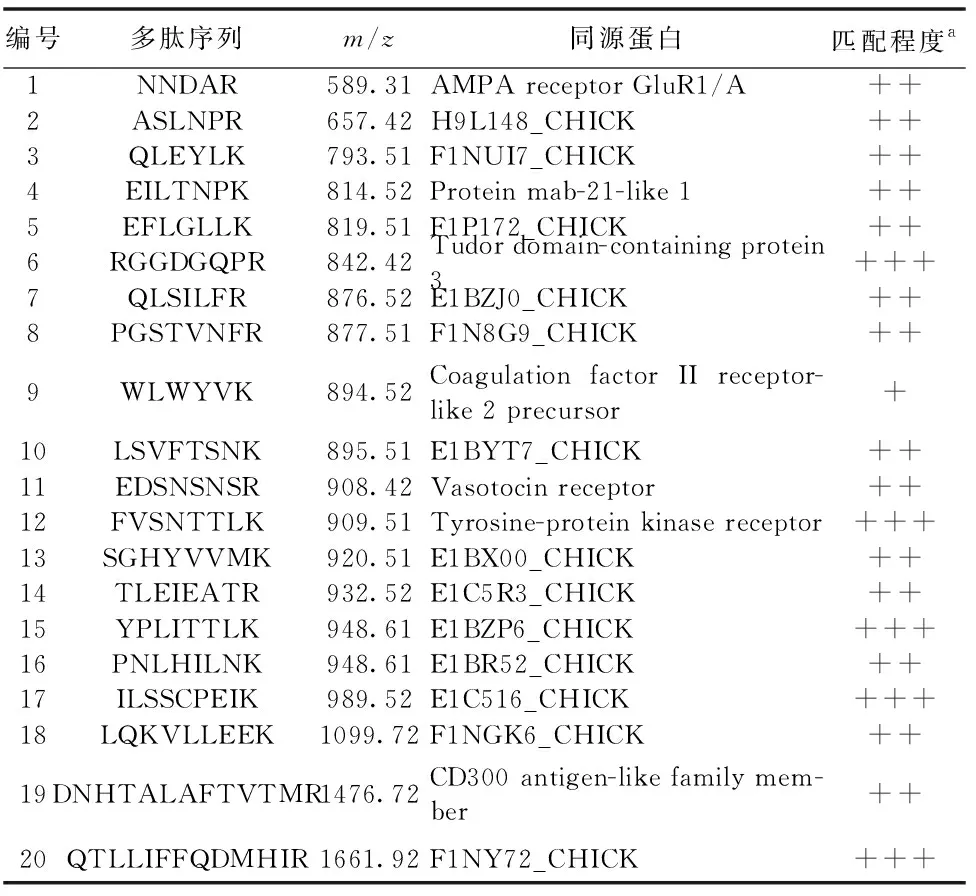
表2 燕窝中识别出的不同类型寡肽Table 2 Different kinds of peptides identified from bird′s nest
注:a为匹配程度+<++<+++
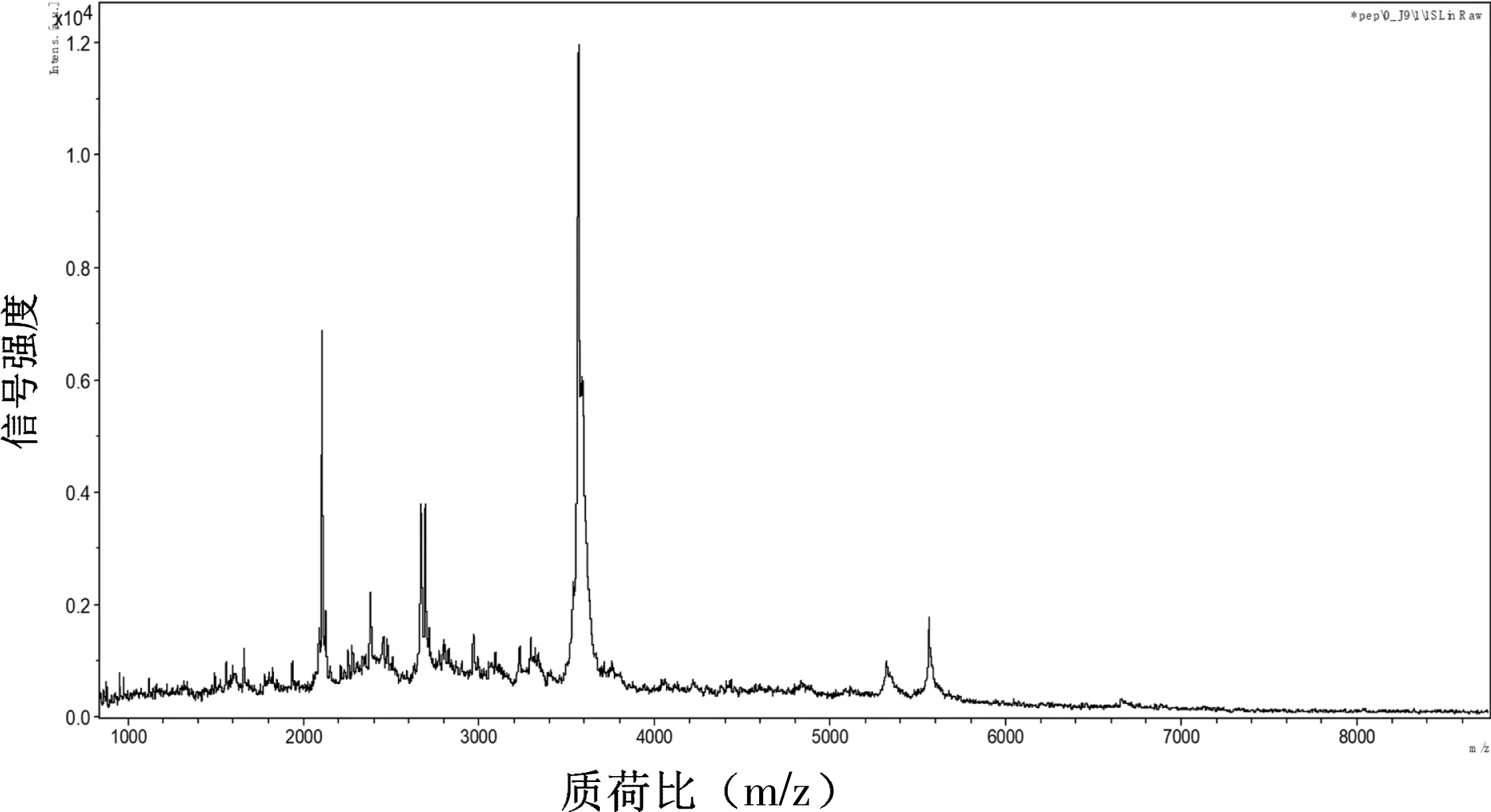
图4 燕窝低聚肽的飞行时间质谱图Figure 4 Time of flight mass spectra of tryptic digest of bird′s nest
燕窝中主要功效成分是唾液酸,实验测定了毛燕窝和燕窝低聚肽中唾液酸的含量,其中毛燕窝中唾液酸的含量为11.6%,经过酶解处理后含量升至14.3%。由于毛燕窝中存在一定量的毛发、木屑等杂物,含水量约10.0%,酶解处理后的溶液经过过滤后会除去不溶物以及少量的无机盐,喷雾干燥后的低聚肽含水量降低5.0%,因此唾液酸的含量有所上升。
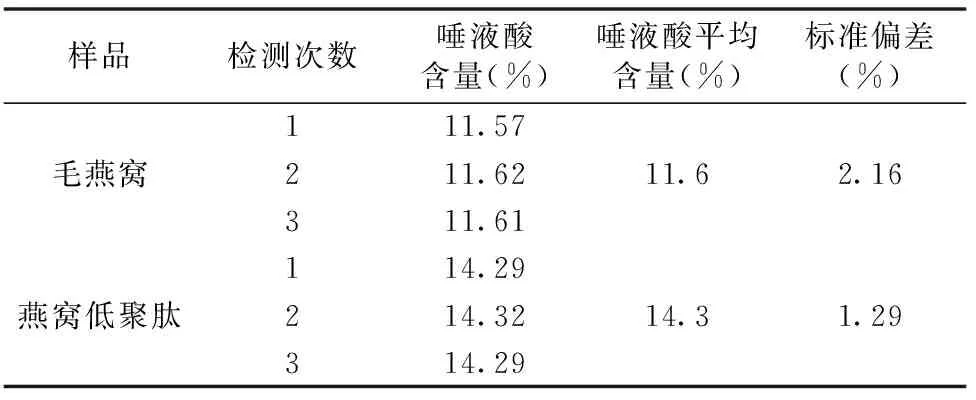
表3 燕窝及其低聚肽唾液酸含量分析结果Table 3 Sialic acid contents in bird′s nest and oligopeptides
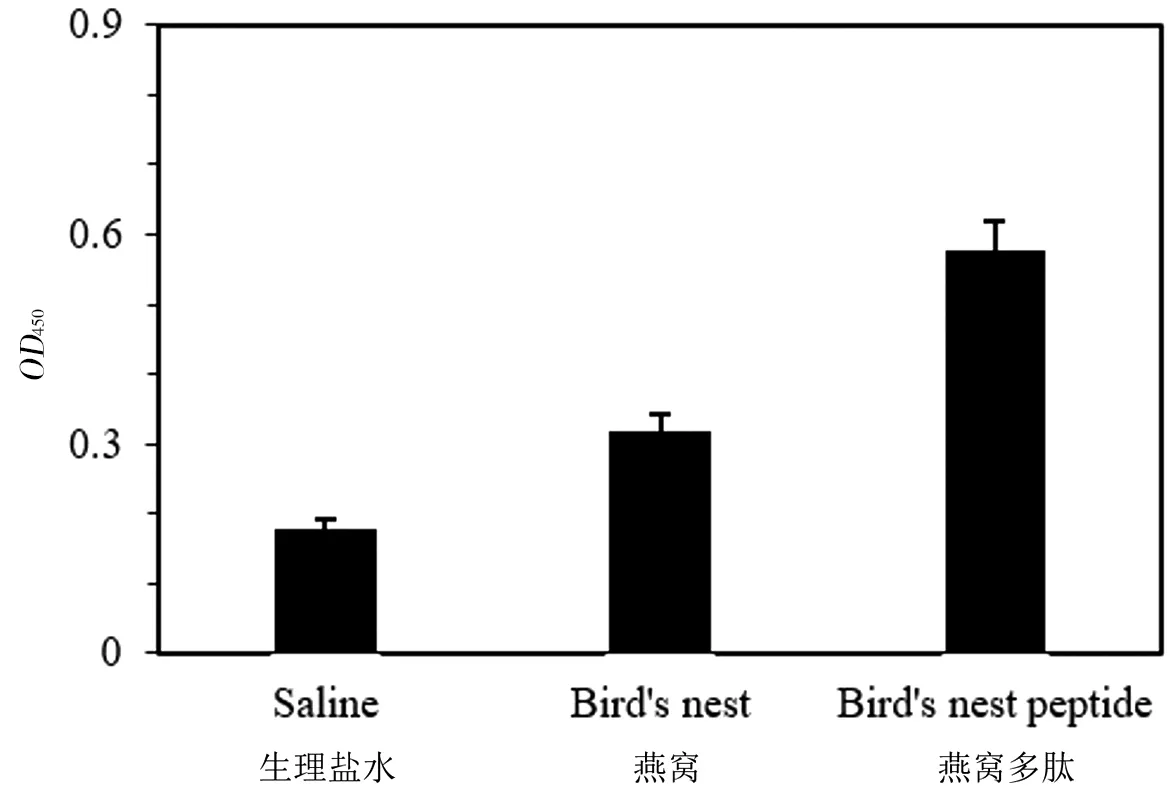
图5燕窝及低聚肽增强ConA诱导T细胞增殖效果
Figure 5 Effect of bird′s nest and its digest mixture on proliferation of T-cell
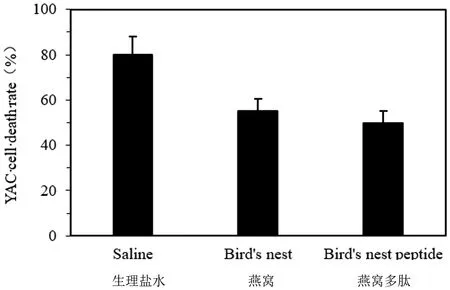
图6 燕窝及低聚肽增强抑制NK细胞活性效果Figure 6 Effect of bird′s nest and its digest mixture inhibition of NK cell activity
2.3 酶解产物生物活性分析
实验分为两组,实验组分别喂食燕窝、燕窝多肽,对照组喂食生理盐水,每组5只小鼠,喂食14 d后,分别取小鼠脾脏,研磨后检测样品对T细胞增殖能力和抑制NK细胞活性的影响,细胞测定重复5次,每组的检测结果取平均值,检测结果见图5和图6。结果表明,口服无明显毒副作用的大剂量燕窝和燕窝肽显著增强淋巴细胞反应性。Spleen cell+ConA培养48 h后CCK8细胞检测增殖活性,结果表明燕窝多肽组与对照组及燕窝组相比,增殖活性显著增高(P<0.05),说明燕窝低聚肽能使ConA诱导T细胞增殖并且增殖效果高于燕窝。将Spleen cell+YAC-1 cell培养4 h后取上清检测溶液中乳酸脱氢酶释量,结果表明对照组YAC细胞死亡率明显高于实验组,即实验组对NK细胞活性的抑制效果显著强于对照组(P<0.05),而实验组中燕窝和燕窝多肽组之间对NK细胞活性的抑制效果无明显差异(P>0.05)。体外实验结果表明在刺激淋巴细胞增殖方面燕窝和燕窝低聚肽显著强于对照组,其中燕窝低聚肽的效果最强;在抑制NK细胞活性方面,实验组抑制效果强于对照组,而实验组之间无显著差异。这表明经过酶解处理的燕窝低聚肽能够显著提高免疫细胞的免疫活性。
3 结论
本研究首先考察了酶解时间对燕窝酶解效果的影响。结果表明,燕窝经60.0℃热变性处理后可通过胰蛋白酶和胃蛋白酶有效降解,酶解处理4 h燕窝降解率分别达到96.0%和91.0%,碱性蛋白酶和中性蛋白酶可部分降解燕窝,4 h后残留量分别为40.0%和36.0%。因此,胰蛋白酶可用于燕窝低聚肽制备的制备,而现有文献中研究燕窝低聚肽酶解条件的文献鲜有报道。
实验对燕窝产物的氨基酸组成、分子量及生物活性进行了分析。结果表明,燕窝酶解产物经喷雾干燥后总氨基酸含量有所提高,并进一步证明了燕窝提取物中含有大量唾液黏蛋白。分子量分析结果表明燕窝蛋白与文献报道的蛋白分子量较为一致。酶解后燕窝低聚肽分子量主要集中在2~4 ku。活性分析结果表明,燕窝低聚肽对T细胞的增殖效果显著高于燕窝并且可显著抑制NK细胞的活性,证明经过酶解处理的燕窝低聚肽可显著提高燕窝对免疫的提升能力。

