IFNLR1的研究进展
王伟倩,高 雪,袁永一,徐金操
(1.中国人民解放军火箭军总医院 耳鼻咽喉头颈外科,北京 100088;2.中国人民解放军总医院 耳鼻咽喉头颈外科,北京 100853)
IFNLR1(interferon lambda receptor 1),也被称为IFNLR、LICR2、CRF2/12、IL28RA和IL-28R1,位于1p36.11,共33 120个碱基对,包含7个外显子,其编码的蛋白为跨膜蛋白,属于Ⅱ型细胞因子受体家族,可与Ⅲ型干扰素(IFNλs)特异性结合参与信号转导,诱导抗病毒、抗肿瘤的功能。自Sheppard[1]和Kotenko[2]两个团队发现IFNLR1蛋白以来,关于IFNLR1的多方面的研究已逐层展开。近年来研究发现IFNLR1表达的组织特异性,使Ⅲ型干扰素的功能发挥更有针对性,相比Ⅰ型干扰素能够在同样抗病毒效能的前提下有效减轻副反应,在未来有望替代Ⅰ型干扰素,实现重要的临床价值。
1 序列和结构
IFNLR1位置上与IL22RA1邻近,二者相距10 kb左右,转录方向均朝向端粒。根据转录本的不同,IFNLR1编码蛋白对应了520个氨基酸,前20位氨基酸构成了信号肽,第21~228位氨基酸构成了蛋白质的胞外域,第250~520位氨基酸构成了蛋白质的胞内域,中间以21个氨基酸(第229~249位)构成了蛋白质的跨膜区(http://www.uniprot.org/uniprot/Q8IU57#subcellular_location)。其他亚型在亚型1的基础上存在不同程度的氨基酸的缺失。现已发现177种生物体含有人IFNLR1的同源序列,且此序列在人、黑猩猩、猕猴、狗、牛、鼠中相对保守。在DNA水平,人IFNLR1与黑猩猩的序列一致性达99.2%,与小鼠的一致性达72.8%。在蛋白质水平,人IFNLR1与黑猩猩的序列一致性达98.7%,与小鼠的达60.9%(https://www.ncbi.nlm.nih.gov/homologene?cmd=Retrieve&dopt=AlignmentScores&list_uids=52086)。
1.1 胞外部分
IFNLR1的胞外部分,涵盖了第21~228位氨基酸。IFNLR1与IL10RB及胞外配体IFNλs按照1∶1∶1的比例结合后才能激发相应的生物活性,IFNLR1的胞外结构特点决定了其与IFNλs结合的特异性和高亲和性。由于IL10RB与IFNλs结合的亲和性较低,到目前为止尚不能在自然状态下有效提取并建立IFNLR1/IFNλs/IL10RB三聚体复合体模型。Miknis等[3]通过对大肠杆菌表达的IFNλ1和果蝇S2细胞表达的IFNλ1、IFNLR1的X射线晶体结构研究,首次展示了IFNLR1胞外部分的晶体结构,并阐释了二者配体-受体识别和结合的机制。
1.1.1 IFNLR1胞外结构
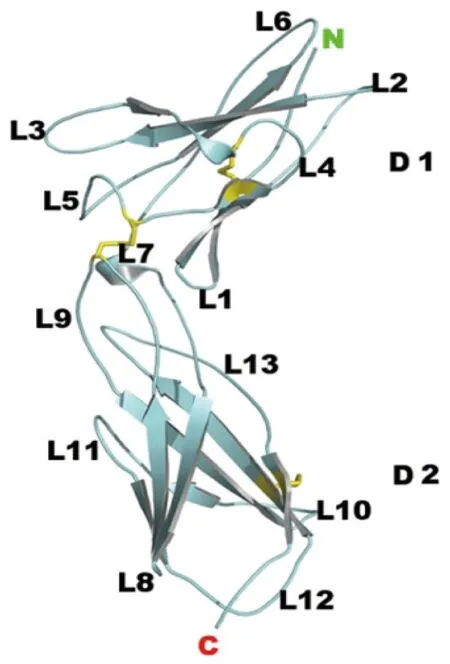
D1、D2分别代表两个结构域;蓝色带状箭头代表β-折叠股;连接在β-折叠股间的蓝色不规则曲线代表连接的环区;黄色短棒代表二硫键;N代表N-端,C代表C-端;L1-13分别代表1-13环区
图1 IFNLR1的胞外域[3]
Figure 1 Extracellular domains of IFNLR1[3]
IFNLR1的胞外部分(见图1[3])包括D1和D2两个β-夹心结构域,每个β-夹心结构域都是由两个β-折叠叠加形成,折叠间以环相接。每个β-折叠由3~4个折叠股构成。D1、D2这两个结构域间由一个环L7连接,在环L7内的中央有一个短的扭转螺旋。类似D1、D2的这样的结构域在其他造血细胞因子(包括造血生长因子和白介素)受体中也存在,称为Ⅲ型纤维连接蛋白域。D1和D2两结构域连接处形成的拐角角度为112°,比报道的IL22RA1的相应的域间夹角小,但与IL10RA的却非常相似,配体IFNλ1结合在拐角的尖端。环L3、L5、L7、L9、L13参与了与配体IFNλ1的结合。
IFNLR1中氨基酸的修饰主要发生在胞外部分,包括糖基化修饰和二硫键的形成。糖基化修饰发生在位于29位、36位、142位、169位的Asn,Asn29和Asn36都被一分子的N-乙酰葡萄糖苷(N-acetylglucosamine,NAG)修饰,Asn142则是被NAG-NAG-甘露糖修饰。二硫键的形成分别发生在Cys74-Cys82、Cys86-Cys150、Cys195-Cys217之间。Cys86-Cys150之间形成的是两结构域间的二硫键,是IFNLR1特有的结构特点,域间二硫键的存在可以将D1和D2两结构域连在一起,限制了域间的活动,也可能因此影响了IFNLR1/IFNλs/IL10RB三元复合体形成时构象的变化,从而避免IFNs、ILs通过IFNLR1/IL10RB受体复合物进行信号传导,确保了配体受体结合的特异性。
1.1.2 IFNλ1/IFNLR1复合物
IFNλ1/IFNLR1复合物是由一分子的IFNλ1单体与一分子的IFNLR1结合而成。IFNλ1由A-F 6个螺旋构成,A、C、D、F形成了一个经典的上-上-下-下的四螺旋束。IFNλ1与IFNλ2、IFNλ3及IL10家族的成员在拓扑结构上相似。IFNλ1以其螺旋A、螺旋F与IFNLR1的域间区域以近乎垂直的角度结合,二者互补的表面结构构成了相互作用的界面,界面内包含配体的螺旋A、环AB、螺旋F和受体的域间区域,不包含二硫键。受体的域间区域由D1结构域内的环L3、L5、L7和D2结构域内的环L9、L13共同构成,其中的寡糖不参与受体配体结合的过程。参与到界面的氨基酸残基中,来自IFNλ1的有Pro25、Leu28、Lys32、Arg35、Asp36、Glu39、Trp47、Phe54、Phe152、Phe155、Arg156和Arg160,IFNLR1表面的包括Pro63、Thr64、Tyr93、Asn94、Lys95、Asp108、Leu120、Phe121、Pro153、Asp155、Thr203、Phe204和Ser205。此作用界面包装紧密,且高度疏水,测定IFNλ1与IFNLR1结合的Sc值提示二者的结合非常紧密,而这种紧密结合的作用力很大程度上来自于范德华力和疏水性,而不是氢键。IFNλ1与IFNLR1结合的最初作用力来自于氨基酸间互补的静电作用,而后又通过疏水作用力和非极性作用力得以强化。
1.1.3 IFNLR1与其他结构的对比
IFNLR1与IL10RA和IL10RB结构上高度相似,都包含两个Ⅲ型纤维连接蛋白域,中间以环连接。不同的是,在IFNLR1的环L5的对应区域,IL10RA多了一个短的α-螺旋,而此螺旋IL10RA和IFNLR1都没有。IL10RB和IFNLR1在结构上的区别主要在于IL10RB的C-端多了一个α-螺旋,在两个纤维连接蛋白域之间多了一个小β-折叠和一个短α-螺旋,且在IFNLR1的某个环区的对应位置,IL10RB又出现了一个短的α-螺旋。IL10RB域间的α-螺旋和β-折叠可能导致了与IFNλ1结合时的低亲和力。
以各α碳原子为标准,将IFNLR1与IL10RA、IL22RA、IL-22BP进行比对时发现,各受体间存在不同程度的位移。与IL10RB比较时,还发现IL10RB的表面存在多个裂隙,进一步解释了IL10RB可与多种细胞因子结合的独特适应性。
1.2 胞内部分
IFNLR1的胞内部分,涵盖了第250~520个氨基酸。对于IFNLR1胞内部分,尚无有关其完整结构的报道,目前相关研究的焦点主要集中在IFNLR1与Jak1激酶结合的部分。在Ⅱ型细胞因子受体家族中,所有相关信号的转导都是由二聚化受体复合体介导的。二聚体受体复合体都是以一条长胞内域的受体链搭配另一条短胞内域的受体链而形成的。对于IFNLR1/IL10RB受体复合体,IFNLR1链拥有长的胞内域,可与Jak1偶联,具体偶联部位位于Jak1的FERM-SH2域和IFNLR1胞内部分的box1基序[4-6]。
1991年,Murakami等人描述了“box1”和“box2”的序列与其保守性的特点,后来证明box1和box2在介导受体和Jak家族的偶联中起了重要作用。Ferrao[4]证实在IFNLR1中的box1是与人Jak1的FERM-SH2域结合的主要位点,二者结合的亲和力高,相反box2与Jak1结合的亲和力很低,但box2的存在能够有效降低结合后的解离率,使IFNLR1与Jak1结合的效能增加17倍。
对于所有Ⅱ型细胞因子受体,胞内部分都有“box1”和“box2”两段基序。box1的基序是近膜区的一段富含脯氨酸的序列,box2是跟随其后的一段疏水序列,二者之间通常是以10~40个氨基酸残基相隔。对于IFNLR1,box1为第250~270位的氨基酸残基构成的基序,box2为第270~299位氨基酸残基构成的基序。通过对人类Ⅱ型细胞因子受体家族成员的box1的多序列比对,发现各序列在以IFNLR1为标准的第264位的Pro和第267位的Leu高度保守,第269位的Phe保守性相对较高,三者共同形成了box1的一个“PxxLxF”的保守基序,该区域的突变可能影响Jak1与IFNLR1的偶联及之后的信号转导。
关于IFNLR1的胞内部分,还有报道称其可以与肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated factor 6,TRAF6)结合,抑制TRAF6诱导的NF-κB 的活化,并可以显著增强IFNLR1的稳定性[7]。
2 表达
人IFNLR1的表达具有组织特异性,这点与Ⅰ型干扰素受体IFNAR的广泛表达模式不同。基于mRNA水平的数据显示,IFNLR1在消化道、免疫系统、皮肤、内分泌腺、男性器官中有相对多的表达,但在蛋白质水平的表达尚不明确(http://www.proteinatlas.org/ENSG00000185436-IFNLR1/tissue)。其表达产物所在的细胞结构主要是细胞膜和细胞质。IFNLR1所表达的细胞类型主要是人上皮细胞[8]、巨噬细胞、树突状细胞[9]等,同时在多种癌细胞系中有不同程度的表达。Duong等人[10]发现,IFNLR1在携带IFNL3次等位基因的慢性乙肝病毒感染患者中呈现高表达,但在不携带IFNL3次等位基因的HCV感染患者中表达量无明显改变,以此推断IFNLR1的表达与IFNL3的基因型有关。
小鼠Ifnlr1在细胞膜上表达,并同样担任细胞因子受体角色,目前已发现Ifnlr1在小鼠的消化系统、听觉系统、外分泌系统、皮肤系统、嗅觉系统、泌尿系统有表达,表达的主要细胞类型以粒细胞、单核细胞为主,在内耳的毛细胞也有表达(http://www.informatics.jax.org/marker/MGI:2429859)。基于GENE ONTOLOGY结果,斑马鱼ifnlr1参与细胞膜的构成,并具有细胞因子受体活性(https://zfin.org/action/marker/marker-go-view/ZDB-GENE-071120-5),目前英国剑桥大学的桑格研究院(Wellcome Trust Sanger Institute)已通过转录组分析明确斑马鱼ifnlr1从受精卵到仔鱼期都有不同程度的表达,其中以囊胚期为著。
3 功能
目前国际上对IFNLR1的功能的研究分为两个层面,一方面通过研究IFNLR1基因突变表型研究其功能,另一方面是将其与IFNλs结合起来研究。
3.1 IFNLR1与突变
在有关IFNLR1的SNPs的研究中发现,IFNLR1基因中g.32349 G>A的突变,可能与变应性鼻炎的易感性有关,但并不引起血清IgE含量的变化[11]。中国人群中IFNLR1基因中的两个SNP(rs10903035,rs11249006)与对HCV的易感性和病毒的自发性清除有关[12]。Jiménez发现rs10903035还与HIV/HCV共感染患者的胰岛素抵抗有关[13]。Laje发现rs10903034可能与白种人自杀意念的产生有关[14]。
3.2 IFNλs
IFNλs作为配体,其功能的发挥需要借助于IFNLR1与IL10RB结合形成的受体复合体。由于IFNLR1与配体IFNλs高亲和、特异性结合的特性,有关IFNLR1的功能,很大程度上需要与IFNλs结合起来共同研究[15]。
IFNλs,也称为Ⅲ型IFNs,是细胞因子IL-10超级家族的成员。IFNλs以往指的是-λ1、-λ2、-λ3 3个成员,近年来发现了新成员IFNλ4,IFNλ4仅在携带IFNL4-ΔG等位基因(rs368234815)的个体中表达,与HCV病毒的无效清除有关,但研究发现携带此等位基因的HCV患者其体内HCVRNA的基础量低。在HCV感染的肝癌细胞系中,在基于IFNLR1正常存在的前提下,病毒诱导的IFNλ4的表达能够阻止IFN-α的信号,从而减弱了IFN-α的疗效[16]。
3.2.1 IFNλs与机体免疫
目前对于IFNλs的功能认识尚不完善,最初的研究表明IFNλs具有与Ⅰ型干扰素相似的抗病毒的功能,近期Syedbasha等人已对感染性疾病中IFNλs的免疫功能做出了总结[17]。各种细胞培养和活体实验已证实了IFNλs有抗多种病毒的活性,如肝炎病毒HBV、HCV[18-19],多种呼吸道病毒[20-25](流感病毒A、B,呼吸道合胞病毒,人类偏肺病毒和SARS病毒),轮状病毒[26],单纯疱疹病毒[27-28]和巨细胞病毒[29-30]等。但其抗病毒的效能整体较Ⅰ型干扰素低,这可能与IFNLR1的表达量有关。IFNλs成员抗病毒活性的排序依次为IFNλ3>IFNλ1>IFNλ2;尽管IFNλ3和IFNλ2只有7个氨基酸的变异,IFNλ3的活性是IFNλ2的16倍[31]。IFNλs在抗病毒的同时还进行免疫调节,在IFNLR1的参与下可以激发抗病毒状态,降低对病毒的易感性,并对胃肠道低水平持续性的病毒感染起到局部调控作用,避免了全身的应答反应[32]。一些细胞培养和活体实验还发现IFNλs与某些细菌感染有关。IFNλs还与哮喘、自身免疫性关节炎、系统性红斑狼疮等一些免疫系统疾病相关[33-35]。
有关上述功能的活体实验,主要建立在以小鼠为动物模型的基础上,这是基于人类IFNLR1基因和小鼠Ifnlr1基因的同源性及较高的序列一致性。Mordstein[36]和Ank[37]等人构建了Ifnlr1(-/-)的小鼠模型Ifnlr1tm1Palu,对Ifnlr1在活体内的表达及功能研究提供了更深入的支持。Ifnlr1tm1Palu小鼠模型的构建方法是在Bruce4小鼠胚胎干细胞中将包括7个编码外显子、6个内含子以及3′非翻译区的前219个碱基在内的Ifnlr1全部序列以IRES-LacZ/MC1-Neo基因盒替代,最后以实时荧光定量RT-PCR加以确认。
值得一提的是,Lazear[38]以西尼罗河病毒(WNV)感染Ifnlr1(-/-)和野生型小鼠,发现Ifnlr1(-/-)小鼠的脑和脊髓中WNV可较早发生复制和播散,此现象与Ifnlr1(-/-)小鼠的血脑屏障的渗透性增高有关,而以IFNλ2处理后的野生型小鼠血脑屏障的渗透性减弱。体外血脑屏障模型显示,在大脑的微血管内皮细胞中,IFNλs通过Ifnlr1提高了跨内皮细胞的电阻,同时调节了紧密连接蛋白的位置,从而减弱了病毒的跨屏障运动。Douam等[39]发现IFNλs介导的信号转导参与维持血脑屏障的完整性,对阻止黄热病病毒跨屏障至关重要。
3.2.2 IFNλs与肿瘤
在IFNλs与肿瘤的相关研究中,已发现在大肠癌HCT116细胞系[40]、胶质母细胞瘤LN319细胞系[41]、神经内分泌瘤BON1细胞系[42]、肺癌HCC827细胞系[43]等多种细胞系中IFNλs发挥了抑制细胞增殖的功能。在某种特定的食管癌细胞系中,发现IFNλ1能够通过抑制细胞分裂的G1期抑制肿瘤增长[44]。在小鼠肿瘤模型中,IFNλs能够抑制MCA205纤维肉瘤细胞的增殖[45],延迟或者抑制B16黑色素瘤细胞[46]和BNL肝癌细胞[47]的生长。相关研究有待进一步深入。
4 信号通路
IFNLR1所参与的信号通路中,最经典的是Jak-STAT通路[48](见图2)。IFNLR1作为受体的一条链,与IL10RB一起共同与配体IFNλs进行识别并结合,两条受体链发生二聚化,此时分别偶联在IFNLR1胞内域和IL10RB胞内域上的Jak1激酶和Tyk2激酶相互接近,并通过交互的酪氨酸磷酸化而活化。活化后的Jak1和Tyk2激酶催化STATs(STAT1-5)发生磷酸化修饰,而后修饰后的STAT1单体和STAT2单体结合形成异源二聚体,并易位到细胞核内,与DNA的结合蛋白IRF9共同形成三元复合物——干扰素刺激基因因子3(IFN-stimulated gene factor 3,ISGF3),ISGF3与ISRE(IFN-stimulated response element)结合,激活干扰素刺激基因(IFN-stimulated genes,ISGs)转录,ISGs转录后可以上调细胞表面Ⅰ型MHC抗原的表达,并发挥免疫调控、抗病毒、抗增殖及促凋亡作用。
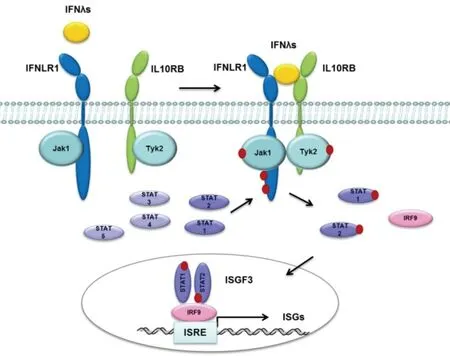
红色实心圆点代表酪氨酸磷酸化,在激活的STATs中,STAT1与STAT2形成异二聚体,并与IRF9结合形成ISGF3,ISGF3与ISRE结合诱导ISGs转录
图2 IFNλs激活Jak-STAT信号通路
Figure 2 IFNλs activates Jak-STAT signaling pathway
STAT1、STAT2的磷酸化修饰在上述信号通路中起到了至关重要的作用。只有STAT2的磷酸化修饰依赖IFNLR1胞内C-末端酪氨酸残基。活化后的Jak1催化IFNLR1上的第343位和第517位的酪氨酸残基发生磷酸化修饰,磷酸化修饰的酪氨酸位点与周围的氨基酸序列形成“停泊位点”,同时含有-SH2结构域的STAT2被招募到“停泊位点”,Jak1对结合在受体“停泊位点”STAT2进行磷酸化修饰。由于IL10RB的胞内部分很短,只能起到结合并活化Tyk2的作用,而不能为STAT提供“停泊位点”,因此认为它对于STAT2的磷酸化修饰并未起重要作用。研究发现,当IFNLR1的第343位和517位的酪氨酸突变为苯丙氨酸时,IFNλs抗病毒和抗增殖的活性均消失,这表明与以上两个酪氨酸相关的转录因子STAT2的激活,与抗病毒和抗增殖有关。这与Ⅰ型干扰素信号转导中STAT2所起的作用一致。在只有STAT1、3、4、5参与的情况下,哪怕它们同时存在,都不足以起到调节抗病毒、抗增殖的作用[49]。
近年来一些研究表明,Jak2也参与了IFNλs所激活的Jak-STAT通路,并且对其中STAT1的磷酸化修饰至关重要[50-51],而在同样激活此通路的Ⅰ型干扰素的信号级联中未发现Jak2的参与。
除了最经典的Jak-STAT通路外,参与IFNλs信号转导的还有ERK-1/2通路,SAPK/JNK通路,P38激酶通路,PI3K-AKT通路[29,52-53],但这些旁路只在特定的细胞类型或者癌细胞中存在,其详细机制有待进一步研究。
5 总结
Ⅰ型、Ⅱ型干扰素在临床上最早是应用于抗病毒的治疗,伴随临床应用而表现出了抑制细胞增殖分化、抑制致癌基因的表达及激活T淋巴细胞、自然杀伤细胞和巨噬细胞等作用,现也应用于恶性肿瘤的临床治疗,但由于其半衰期短、系统性毒副作用强,患者顺应性差等缺点限制了其在临床上的应用,IFNλs基于其受体IFNLR1表达的特异性,为干扰素的靶向治疗提供了新方向。本文回顾了自2003年被发现以来,研究人员对IFNLR1相关各方面的研究进展。
IFNLR1作为异源二聚体受体复合体中与IFNλs特异性结合的一部分,与IFNλs一起共同发挥抗病毒、免疫调节、抗肿瘤的生物功能。参与调控的信号通路以Jak-STAT通路为主,其他信号通路有待进一步研究,可能对发掘IFNLR1新的功能提供方向。已发现的IFNLR1基因突变与相关疾病的易感性有关,其机制也有待进一步研究。未来针对这些问题的深入探索,有望使我们更加全面地了解IFNLR1。

