镰形棘豆总黄酮对胃癌细胞凋亡及TLR4/MyD88/NF-κB通路的影响
哈红萍, 安旭光
(青海大学医学院, 西宁 810016)
在所有癌症中,胃癌发病率居第5位,但病死率居第3位;每年超过70%的胃癌新发病例发生在发展中国家,约50%的病例发生在亚洲东部,主要集中在中国[1,2]。目前,胃癌的治疗方法包括手术、化疗、生物免疫和中医药治疗。无论是化疗、手术,在发挥疗效的同时都有明显不良反应。近几年来,中医药治疗晚期胃癌的报道屡见不鲜,在改善化疗的不良反应及耐药性方面效果显著。已有研究发现,从藏药镰形棘豆中提取的镰形棘豆总黄酮(FOF)具有抑菌、抗氧化、抗炎、抗肿瘤的效果[3~6]。在抗肿瘤方面,目前研究主要集中在FOF对肝癌的增殖、凋亡、转移、侵袭等影响[6~8]。但是,还未有FOF对胃癌作用效果的报道。2017年1月~2018年4月,我们观察了FOF对胃癌细胞凋亡及凋亡蛋白表的影响,并通过分析Toll样受体4(TLR4)/MyD88/NF-κB通路蛋白变化探讨其抗肿瘤的分子机制,为FOF抗胃癌应用提供一定的理论基础。
1 材料与方法
1.1 主要材料 胃癌细胞株SGC7901、MKN-49P、AGS、MKN45、KATOⅢ均购自中国科学院典型培养物保藏委员会细胞库,FOF由甘肃省中医药研究院中药研究所提供。TLR4激活剂脂多糖(LPS,Sigma公司),TLR4抑制剂Eritoran(Eisai公司);MTT、DMSO、DMEM高糖培养基(Solarbio公司),FBS(四季青公司)、RIPA裂解液(Beyotime公司)、SDS-PAGE凝胶试剂盒(Beyotime公司);细胞凋亡相关蛋白(Bax、Bcl-2、Survivin)、TLR4/MyD88/NF-κB通路相关蛋白(TLR4、p-TLR4、MyD88、p-MyD88、p65、p-p65)所用一抗均为兔单克隆抗体(Abcam公司),山羊抗兔二抗(Beyotime公司)。
1.2 实验方法
1.2.1 胃癌细胞选取与FOF作用浓度、时间的确定 采用MMT法。将所有胃癌细胞加入含10% FBS的高糖型DMEM培养基,在37 ℃、5% CO2培养箱中培养。当融合度达80%时,以1∶3传代。 取对数生长期细胞消化成单细胞悬液,调整细胞密度为1.5×105/mL;以每孔100 μL加入到96孔板中,37 ℃、5% CO2细胞培养箱培养24 h;以每孔5、10、20、40、80 μg/mL的终浓度加入FOF,每组设6个平行孔,加入相同体积的溶媒作为空白对照;处理48 h后,每孔加入20 μL MTT溶液(5 mg/mL),继续培养4 h;弃去上清,每孔加入150 μL DMSO溶解MTT,于490 nm处检测OD值,计算抑制率。结果发现,FOF在浓度10~40 μg/mL时对胃癌细胞均表现出剂量依赖的细胞毒性。SGC7901、MKN-49P、AGS、MKN45、KATOⅢ细胞在作用48 h的IC50分别为16.98、40.60、49.81、31.26、41.47 μg/mL,可见FOF对SGC7901细胞在48 h下IC50最小。因此,本研究将选取SGC7901细胞作为受试细胞,FOF作用浓度为10~40 μg/mL、作用时间为48 h。
1.2.2 SGC7901细胞分组与干预处理 将对数生长期的SGC7901细胞分为6组,LPS组加入2 μg/mL的TLR4激活剂LPS,ER+LPS组先加入100 nmol/L TLR4抑制剂Eritoran处理2 h后再加入 2 μg/mL LPS,LFOF、MFOF、HFOF+LPS组先分别加入10、20、40 μg/mL FOF处理2 h后再加入2 μg/mL LPS,空白组加入等量溶媒,各组均处理48 h。
1.2.3 SGC7901细胞凋亡情况观察 采用流式细胞术。收集1.2.2各组细胞,预冷PBS洗涤,用1×Binding Buffer以1×106/mL密度重悬细胞;取100 μL加入离心管中,再加入AnnexinⅤ-FITC和PI各5 μL;轻轻涡旋混匀后,25 ℃避光孵育15 min;然后加入400 μL 的1×Binding Buffer,在1 h内用流式细胞仪检测凋亡细胞,读取细胞凋亡率。
1.2.4 细胞中凋亡相关蛋白、TLR4/MyD88/NF-κB通路相关蛋白检测 采用Western bloting法。收集1.2.2各组细胞,加入RIPA裂解液;置于冰上研碎至匀浆后,4 ℃放置30 min;以13 000 r/min离心10 min,取一部分上清,BCA试剂盒检测蛋白浓度;另一部分上清加入4×上样缓冲液,煮沸变性后,加到4%浓缩胶浓缩,10%分离胶分离;再经转膜、封闭,4 ℃孵育一抗,室温孵育二抗,ECL发光液显色、X线医用胶片显影、定影等步骤,最后进行拍照分析。以目的蛋白与内参蛋白条带灰度值比值作为目的蛋白的相对表达量。
1.2.5 p65进核情况观察 采用细胞免疫荧光法。收集1.2.2各组细胞,以4%多聚甲醛固定;Triton×100透膜、封闭,一抗4 ℃孵育过夜;洗涤后,37 ℃孵育二抗30 min;洗涤后,采用荧光显微镜拍照。利用Image Proplus软件通过分析光密度(OD)值量化p65进核量。
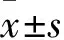
2 结果
2.1 FOF对SGC7901细胞凋亡的影响 LPS组细胞凋亡率为7.53%±0.92%,低于空白组的11.3%±1.11%(P<0.05);ER+LPS组、LFOF+LPS组、MFOF+LPS组和HFOF+LPS组细胞凋亡率分别为64.37%±11.78%、33.67%±4.56%、42.78%±3.98%、65.78%±9.78%,ER+LPS组、MFOF+LPS组和HFOF+LPS组细胞凋亡率均高于LPS组(P均<0.05)。
2.2 FOF对SGC7901细胞Bax、Bcl-2、Survivin蛋白表达的影响 与空白组比较,LPS组细胞Bax蛋白表达降低(P<0.05),Bcl-2、Survivin蛋白表达均升高(P均<0.05);与LPS组比较,ER+LPS组、MFOF+LPS组和HFOF+LPS组细胞Bax蛋白表达均升高(P均<0.05),Bcl-2、Survivin蛋白表达均降低(P均<0.05)。见表1。
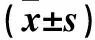
表1 各组SGC7901细胞Bax、Bcl-2、Survivin蛋白表达比较
注:与空白组比较,*P<0.05;与LPS组比较,#P<0.05。
2.3 FOF对SGC7901细胞中TLR4、p-TLR4、MyD88、p-MyD88、p65、p-p65蛋白表达的影响 与空白组比较,LPS组细胞p-TLR4、p-MyD88、p-p65蛋白表达均升高(P均<0.05);与LPS组比较,ER+LPS组、MFOF+LPS组和HFOF+LPS组细胞p-TLR4、p-MyD88、p-p65蛋白表达均降低(P均<0.05)。各组间TLR4、MyD88、p65蛋白表达比较,差异均无统计学意义。见表2。
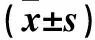
表2 各组SGC7901细胞TLR4、p-TLR4、MyD88、p-MyD88、p65、p-p65蛋白表达比较
注:与空白组比较,*P<0.05;与LPS组比较,#P<0.05。
2.4 FOF对SGC7901细胞中p65进核的影响 LPS组细胞p65进核量为1.21±0.21,高于空白组的0.53±0.05(P<0.05);ER+LPS组、LFOF+LPS组、MFOF+LPS组和HFOF+LPS组p65进核量分别为0.63±0.07、1.19±0.14、0.74±0.06、0.51±0.04,ER+LPS组、MFOF+LPS组和HFOF+LPS组p65进核量均低于LPS组(P均<0.05)。
3 讨论
本研究通过MTT实验发现,在多个胃癌细胞系中,FOF对SGC7901细胞增殖表现出相对较好的抑制作用。药物对肿瘤细胞的增殖抑制,主要是通过阻滞细胞周期、诱导细胞凋亡实现的。细胞凋亡是细胞内抗凋亡蛋白与促凋亡蛋白共同决定的[9,10]。正常细胞中抗凋亡蛋白与促凋亡蛋白处于动态平衡,时刻对胞内外刺激做出反应,并决策出对组织最有利的细胞结局。肿瘤细胞作为“组织背叛者”,其对胞内外刺激的应对已不再以对组织最有利为决策标准,而以“自私者”的身份进行决策决定细胞结局。这种特征尤其表现在肿瘤细胞内凋亡系统的异常使细胞增殖不受机体控制,导致细胞积累大量错误突变,以此改变细胞遗传信息,使癌症逐步获得在体内不受约束的恶化特征,最终发生转移,导致宿主死亡。因此,导致肿瘤细胞凋亡,抑制肿瘤生长是药物治疗癌症最重要的目的。
在癌症获得无限增殖潜能的过程中,抗凋亡蛋白高表达和促凋亡蛋白低表达扮演了重要促进作用,这种失衡在所有癌症中均可被检测到[11]。Bax和Bcl-2作为线粒体凋亡途径中的重要蛋白,通过改变细胞线粒体通透性促进或抑制细胞凋亡,其中Bax促进凋亡、Bcl-2抑制凋亡[12, 13]。Survivin蛋白作为肿瘤特异性蛋白[14],通过直接抑制凋亡终末效应酶Caspase-3和Caspase-7的活性来阻断各种刺激诱导的细胞凋亡过程[15];同时,其与周期蛋白激酶CDK4、CDK2相互作用阻断凋亡信号转导通路[14]。
凋亡是细胞结局,抗凋亡蛋白、促凋亡蛋白是直接导致该结局发生的蛋白,但是控制该结局是否发生依赖于细胞内复杂的信号转导网络,通过信号通路最终调控抗凋亡与促凋亡之间的平衡,以决定该细胞是否凋亡。已有研究发现,TLR4/MyD88/NF-κB信号通路是介导肿瘤细胞凋亡中重要的凋亡调控机制。TLR4/MyD88/NF-κB可促进卵巢上皮性肿瘤细胞增殖,抑制凋亡[16]。另外,胡建芳等[17]研究发现,TLR4、NF-κB、IFN-γ 基因表达量随子宫颈病变的进展呈上升趋势,TLR4及其MyD88/NF-κB信号通路参与并可能促进宫颈癌的发生和发展。针对TLR4/MyD88/NF-κB信号通路在肿瘤组织中异常激活,提高肿瘤抗凋亡能力,诱导肿瘤细胞增殖的重要作用。在基础研究中已发现并开发出多种通过阻断TLR4信号通路抑制肿瘤生长、诱导肿瘤凋亡的试剂,如TLR4的小干扰 RNA[18]、TLR4/MyD88/NF-κB通路抑制剂[19]、TLR4抑制剂Eritoran[20]。
本研究发现,通过LPS诱导激活TLR4通路后SGC7901细胞凋亡比例显著下降,同时在分子水平上Bax表达降低,Bcl-2、Survivin表达上升。这提示在SGC7901细胞中TLR4的激活可提高细胞抗凋亡能力,促进细胞增殖。进一步发现,在SGC7901细胞中LPS诱导p-TLR4、p-MyD88、p-p65蛋白表达升高,p65大量进核,提示LPS可通过激活TLR4/MyD88/NF-κB信号通路促进SGC7901细胞增殖。但是给予Eritoran处理后,LPS的这种诱导作用不仅被抑制,而且诱导SGC7901细胞的凋亡;同时在分子水平上与LPS组相比,ER+LPS组Bax、p53蛋白表达升高,而Bcl-2、Survivin蛋白表达降低。这提示Eritoran可竞争性地与TLR4结合,抑制LPS与TLR4的结合激活,进而抑制TLR4/MyD88/NF-κB信号通路活性,诱导SGC7901细胞凋亡。FOF是否也可通过抑制TLR4/MyD88/NF-κB信号通路,诱导SGC7901细胞凋亡。本研究发现,FOF不仅逆转由LPS诱导的抗凋亡作用,诱导SGC7901细胞凋亡;而且,在分子水平上降低了由LPS诱导产生的TLR4、MyD88、p65分子的高磷酸化水平,同时抑制LPS诱导的p65大量进核。因此,FOF可通过抑制TLR4/MyD88/NF-κB信号通路的激活,诱导SGC7901细胞凋亡。
综上所述,LPS可诱导激活SGC7901细胞TLR4/MyD88/NF-κB信号通路,提高该细胞抗凋亡能力。FOF可通过抑制TLR4/MyD88/NF-κB信号通路的激活,逆转LPS诱导的抗凋亡能力的增加,从而诱导SGC7901细胞凋亡。

