腺病毒介导hBDNF基因修饰骨髓间充质干细胞静脉移植对大鼠脊髓损伤后OMgp表达的影响及意义
陈荣生 王长昇 张立群 许卫红
(福建医科大学附属第一医院脊柱外科,福建 福州 350005)
脊髓损伤(SCI)是一种严重的中枢神经系统创伤性疾病,可造成永久性、毁灭性的神经功能缺损和残疾。骨髓间充质干细胞(BMSCs)是来源于骨髓支持结构的一种多能干细胞,可在体外定向分化为神经元及胶质细胞,用于SCI的移植治疗〔1〕,但在神经营养因子与轴突生长抑制因子相互拮抗的局部环境中,神经再生十分有限〔2〕。脑源性神经营养因子(hBDNF)在SCI发生时表达上调,可促进SCI中轴突的再生及感觉功能的恢复〔3,4〕。少突胶质细胞髓鞘糖蛋白(OMgp)是中枢神经系统(CNS)髓鞘中重要的轴突生长抑制因子〔5〕,但目前其在BMSCs治疗中的意义尚不明确。本研究通过静脉移植腺病毒上调hBDNF的BMSCs治疗大鼠SCI模型,观察其疗效及对OMgp表达的影响。
1 材料与方法
1.1实验动物及细胞 雄性SD大鼠(上海斯莱克实验动物中心)构建SCI模型,体重(250±20)g。人肾上皮细胞系HEK293细胞(上海酶研生物科技有限公司)。
1.2实验试剂 DMEM培养基、胎牛血清及胰蛋白酶(美国Gibco公司),脂质体Lipofectamine2000(美国Thermo公司),聚氰基丙烯酸正丁酯(BCA)蛋白浓度测定试剂盒(上海碧云天生物公司),聚偏氟乙烯(PVDF)膜(美国Millipore公司),蛋白抽提试剂盒(北京康为世纪生物科技有限公司),电化学发光(ECL)发光液(美国Thermo公司),hBDNF、OMgp及β-actin抗体(美国Abcam公司),山羊抗兔免疫球蛋白(Ig)G(北京中杉公司),聚丙烯酰胺,SDS及过硫氨酸等(美国Arfleresco公司),其余试剂均为国产分析纯。
1.3实验仪器 3111型CO2细胞培养箱(美国Thermo公司),ECO1.5紫外超净工作台(美国Thermo公司),Allegra TM64R高速冷冻离心机(美国Beckman公司),低温冰箱(德国Bosch公司),电泳仪、电泳槽、转印夹及GelDoc XR凝胶成像仪(美国Bio-Rad公司),IX70型荧光倒置相差显微镜(日本Olympus公司),DV530紫外分光光度仪(美国Beckman公司),微量移液器(法国JSON公司),T100细胞计数仪(美国Bio-Rad公司),RM6280多道生理信号采集处理系统(成都仪器厂)。
1.4hBDNF基因修饰大鼠BMSCs的获取及鉴定 提取、分离、培养、扩增并鉴定BMSCs,以hBDNF基因为目的基因,以增强型绿色荧光蛋白(EGFP)基因为标志基因的5型复制缺陷型重组腺病毒载体(Ad5-hBDNF-EGFP)的构建及鉴定,具体操作流程见参考文献〔6〕,利用脂质体Lipofectamine2000介导骨架质粒pBHGlox-E1-3Cre和穿梭质粒pDC316-hBDNF-mCMV-EGFP或EGFP空白载体转入HEK293细胞中,并收集病毒悬液。取两组病毒悬液分别以200 MOI浓度感染BMSCs细胞,感染3 d后观察荧光强度并进行后续实验。
1.5SCI大鼠模型的构建及分组 将18只SD大鼠随机分为hBDNF-EGFP-BMSCs静脉移植组(A组)、空白载体-EGFP-BMSCs静脉移植组(B组)及损伤对照组(C组),均采用改良Allen重物打击法制作T10节段脊髓损伤模型,具体操作方法见参考文献〔7〕。建模完成3 d后,将hBDNF-EGFP-BMSCs及空白载体-EGFP-BMSCs两组细胞0.25%胰蛋白酶消化,10%胎牛血清+DMEM重悬终止消化,室温1 000 r/min离心5 min,1 ml磷酸盐缓冲液(PBS)洗细胞3次,进行细胞计数,调整细胞浓度为1 × 106个/ml,A、B、C组分别经大鼠尾静脉注射移植 hBDNF-EGFP-BMSCs、空白载体-EGFP-BMSCs细胞悬液及0.1 mol/L PBS各1 ml。
1.6Western印迹检测细胞或组织中蛋白表达 细胞总蛋白的收集:将hBDNF-EGFP-BMSCs及空白载体-EGFP-BMSCs细胞培养于25 cm2培养瓶中,待细胞融合度>80%时,0.25%胰蛋白酶消化,10%胎牛血清+DMEM重悬终止消化,4℃ 1 000 r/min离心5 min,1 ml PBS洗细胞3次,200 μl蛋白裂解液及蛋白酶抑制剂4℃处理细胞1 h,4℃,15 000 r/min离心10 min,取细胞上清液。组织总蛋白的收集:取静脉移植5 w后大鼠损伤区脊髓40 mg,在液氮中研磨成粉末,200 μl蛋白裂解液及蛋白酶抑制剂4℃处理细胞1 h,4℃,15 000 r/min离心10 min,收集上清液。BCA蛋白浓度测定试剂盒检测总蛋白浓度,取50 μg总蛋白进行10%聚丙烯酰胺凝胶电泳,100 V稳压跑至分离胶底部,将PVDF膜及凝胶固定于转印夹中,200 mA转膜2 h,剪取目的条带,5%脱脂牛奶封闭2 h,将膜与hBDNF(孵育浓度1∶500)、OMgp(孵育浓度1∶500)及β-actin(孵育浓度1∶1 000)抗体4℃脱色摇床孵育过夜,PBS-T洗涤3次,每次10 min,二抗(孵育浓度1∶500)室温孵育1 h,PBS-T洗涤3次,每次10 min,ECL发光液孵育1 min,GelDoc XR凝胶成像仪进行曝光显影,目的条带灰度扫描值与内参基因灰度值比值表示hBDNF及OMgp的相对表达量。
1.7大鼠后肢运动功能检测 在大鼠静脉移植后24 h、1、3及5 w,依据参考文献〔8〕中提出的大鼠SCI后功能评判标准〔脊髓损伤的行为学(BBB)评分〕评价大鼠后肢运动功能的恢复情况,评判时将大鼠置于直径1 m的平面光滑场地自由活动,观察并记录大鼠在5 min内前后肢运动情况,并进行评分。
1.8大鼠皮层体感诱发电位(CSEP)的检测 在大鼠静脉移植后24 h、1、3及5 w,10%水合氯醛腹腔麻醉,牙科钻于冠状线旁下3 mm处开一直径为3 mm的圆孔暴露硬脑膜,stoelting脑立体定位仪固定大鼠头部,将银球微电极经圆孔接触硬脑膜,银针参考电极置于切开皮肤边缘,刺激电极安放于手术区对侧坐骨神经行径上,行电脉冲刺激,刺激参数:强度7.5 V,频率50 Hz,波宽0.2 ms的单方波,平均叠加100次;分析参数:时间常数0.02 s,灵敏度200 μV,滤波频率100 Hz。RM6280多道生理信号采集处理系统行CSEP检测。
1.9统计学方法 应用SPSS16.0进行t检验、方差分析及SNK-q检验。
2 结 果
2.1hBDNF-EGFP-BMSCs及空白载体-EGFP-BMSCs细胞hBDNF及荧光表达情况 hBDNF-EGFP-BMSCs细胞中hBDNF相对表达量(0.516±0.072)显著高于空白载体-EGFP-BMSCs细胞(0.149±0.030,t=8.150,P<0.001),两组细胞均表达较明显的绿色荧光,见图1,图2。
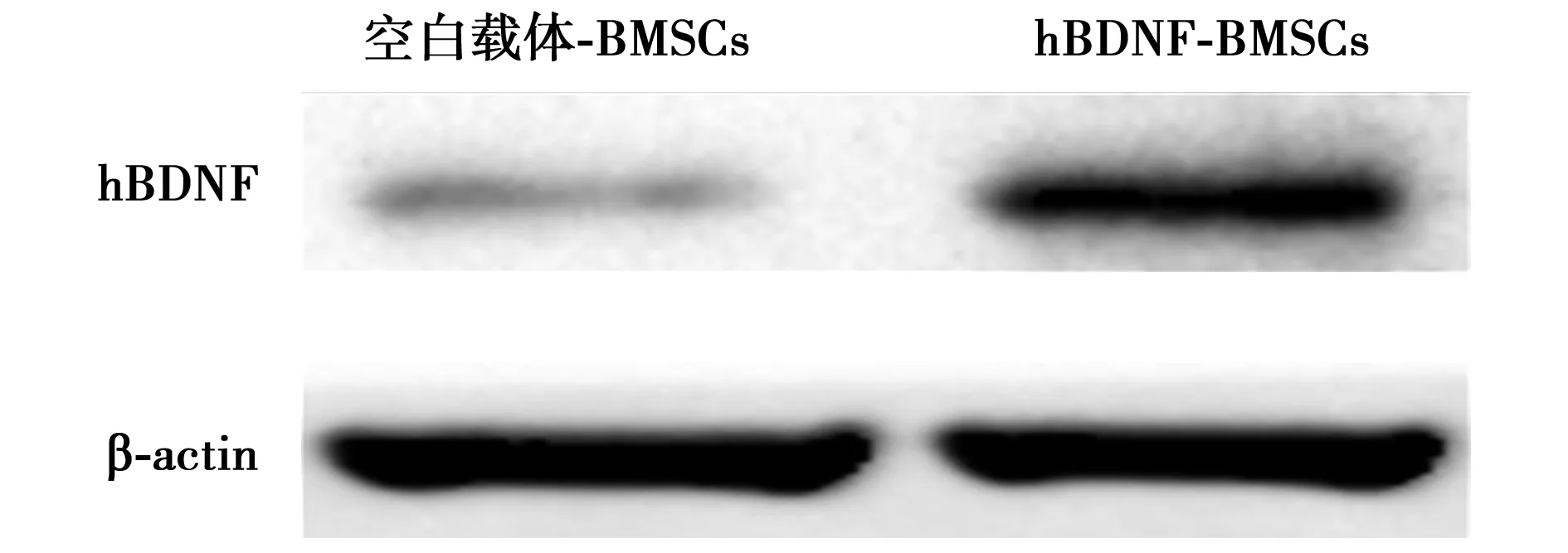
图1 hBDNF-EGFP-BMSCs及空白载体-EGFP-BMSCs 细胞hBDNF表达情况

图2 hBDNF-EGFP-BMSCs及空白载体-EGFP-BMSCs 细胞荧光表达情况(×63)
2.2各组不同时期BBB评分比较 3组第3、5周BBB评分差异有统计学意义(F=15.81,17.85;P=0.004 1,0.003 0),A、B组第3、5周时BBB评分显著高于C组(q=7.767,5.336;均P<0.05),第5周A组显著高于B组(q=3.712,P<0.05),见表1。

表1 各组不同时期BBB评分比较分,n=6)
与C组比较:1)P<0.05;与B组比较:2)P<0.05;下表同
2.3各组第5周CSEP潜伏期值及峰值比较 3组第5周CSEP潜伏期比较差异有统计学意义(F=21.95,P=0.001 7),A、B组显著短于C组(q=9.366,4.901,均P<0.05),且A组显著少于B组(q=4.465,P<0.05);3组第5周峰值差异有统计学意义(F=53.32,P=0.000 2),A、B组显著高于C组(q=14.580,6.525;均P<0.05),且A组显著高于B组(q=8.052,P<0.05),见表2。

表2 各组第5周CSEP潜伏期及峰值比较分,n=6)
2.4各组第5周损伤区脊髓组织hBDNF及OMgp表达 3组第5周损伤区脊髓组织hBNF、OMgp表达差异有统计学意义(F=23.52,81.25;P=0.001 4,P<0.000 1)。A组hBDNF表达显著高于B组及C组(q=8.125,8.650,P<0.05);A组OMgp表达显著低于B组及C组(q=8.183,18.000,均P<0.05),且B组显著低于C组(q=9.820,P<0.05),见图3,表3。
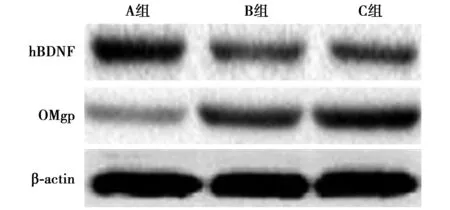
图3 大鼠第5周损伤区脊髓组织hBDNF及 OMgp表达
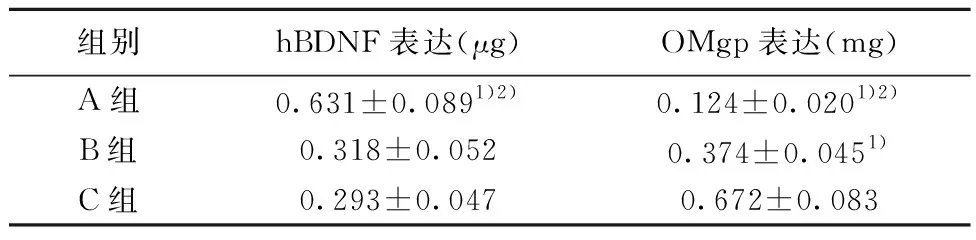
组别hBDNF表达(μg)OMgp表达(mg)A组0.631±0.0891)2)0.124±0.0201)2)B组0.318±0.0520.374±0.0451)C组0.293±0.0470.672±0.083
3 讨 论
目前SCI的治疗主要目标是减少继发性损伤,改善SCI局部微环境,挽救受损的脊髓神经元;利用各种手段和方法促进神经再生和整合,实现脊髓结构性恢复与功能重建。SCI局部微环境是影响受损神经轴突的再生及功能恢复的重要因素,故目前促进脊髓功能恢复的主要策略包括:①利用神经营养因子促进轴突的存活与再生;②应用下游信号分子促进轴突的再生;③降低神经突触抑制性分子表达;④BMSCs移植。BMSCs是来源于骨髓支持结构的一种具有多向分化潜能的多能干细胞,具有取材方便,培养简单,无免疫排斥反应等优势,因此是SCI细胞替代治疗的理想载体〔9,10〕。行BMSCs移植治疗后,SCI局部及移植的细胞可以分泌多种神经营养因子,但同时又产生抑制轴突生长的因子,两种因子的相互对抗,导致了有限的神经再生〔11〕。要进一步促进神经再生,需要额外补充有促进作用的神经营养因子。基因治疗可将神经营养因子基因导入体内,通过在局部长期产生神经营养因子提高局部浓度,促进SCI的恢复。hBDNF是一种重要的感觉和运动神经元营养因子,不仅在脊髓的发育过程及维持脊髓正常生理结构和功能中起重要作用,而且在脊髓原发性及继发性损伤的恢复中也发挥重要作用,是脊髓运动神经元强有力的生存因子,可促进SCI中轴突的再生及感觉功能的恢复〔12,13〕。
本研究结果提示BMSCs移植对于SCI大鼠神经功能修复具有明显的促进作用,hBDNF的修饰可在BMSCs基础上进一步促进SCI大鼠神经功能修复,其机制可能与增强神经元生存及促进轴突的再生有关。另外,BMSCs可有效促进大鼠神经电生理的恢复,且经过hBDNF修饰可上调该作用,进一步说明了hBDNF对神经修复的促进作用。OMgp是中枢神经系统白质内多肽合成的特异性糖蛋白,大约只占髓磷脂蛋白0.05%,位于髓鞘及少突胶质细胞的外表面〔14〕,作为中枢神经系统(CNS)髓鞘中的一种重要轴突抑制成分,已经被证明能够抑制轴突生长,导致生长锥的塌陷〔15〕。本研究结果提示BMSCs本身可能存在某种机制抑制OMgp表达,且hBDNF可协同该机制对OMgp表达的抑制,进而促进神经元生存及轴突再生。综上所述,经hBDNF修饰的BMSCs可通过抑制OMgp的表达促进SCI大鼠神经功能的恢复,是有效的治疗手段。

