银川地区规模化奶牛养殖场粪污可培养细菌种群分布多样性研究
张 雯,马臣杰,李 武,曾 瑾,邓光存①,吴晓玲②
(1.西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021;2.宁夏大学生命科学学院,宁夏 银川 750021)
宁夏回族自治区地处我国西北内陆农牧交错区,是农业部“全国奶牛优势区域布局规划”的重点区域[1]。截至2016年底,宁夏奶牛存栏量已达57.6万头,每年奶牛养殖业排放的粪污高达350万t[2],大量粪污堆积已经成为威胁健康养殖和公共卫生安全的重大隐患之一。已有研究表明,奶牛粪便中的有机物、重金属元素可溶于废水或雨水,并随之渗入土壤污染地下水[3];同时奶牛粪便会产生大量含甲烷、氨、硫化物等有害物质的气体,污染周边空气,对人和奶牛的呼吸道造成危害[4];更严重的是奶牛粪便携带的多种寄生虫和病原菌会对人和奶牛的健康造成威胁。据世界卫生组织报道,由动物传染给人的疾病有90余种[5],包括细菌感染所导致的疾病[6-7]。SINTON等[8]发现一些食品中病原菌的污染与畜禽排泄物有关,这些病原菌通过粪便还田施入土壤,可在环境中长时间存活,并通过种植的作物最终影响到人类健康[9]。如果对养殖场粪污不采取有效处理措施,粪污将会对水、土、气等造成严重生物性污染,对人类和生态环境造成极大危害[10]。因此,深入研究奶牛养殖场粪便可培养细菌种类及多样性可为奶牛粪便无害化处理和资源化利用提供重要基础数据。
宁夏回族自治区目前对奶牛粪便的利用途径主要有两种:一是作为有机肥料;二是晾干后返回养殖场做为场区垫料。这两种处理方式都没有经过相应的无害化处理,且由于缺少对研究区奶牛粪便中细菌种群分布及耐药性的相关研究,导致无法对这两种粪便利用方式进行有效、准确的风险评估。因此,采用梅里埃全自动微生物鉴定及药敏系统和16S rDNA全长测序方法对银川地区规模化奶牛养殖场粪污及周边土壤中可培养细菌种群分布及多样性进行系统研究,为奶牛养殖业对环境及公共卫生安全影响的风险评估提供有效数据。
1 材料与方法
1.1 样品采集
样品采自宁夏回族自治区银川市3家规模化奶牛养殖场,包括108份新鲜粪便(牛体排出还带有体温的新鲜粪便)、81份堆积粪便(堆积3个月以上的粪便及垫料混合物)、68份土壤(养殖场周边未接触粪便的环境土壤)和18份污水(冲洗牛体及圈舍的排放水),共275份。样品采集之后装入自封袋中并编号,保存于冰盒,在4 h内送至实验室后立即将样品混匀、稀释并涂布接种。
1.2 主要试剂与仪器
伊红美蓝琼脂培养基、麦康凯琼脂培养基、甘露醇氯化钠琼脂培养基、蜡样芽孢杆菌选择性琼脂培养基和SS琼脂培养基均购于青岛高科园海博生物技术有限公司,营养琼脂培养基、胰蛋白大豆琼脂培养基和TODD-HEWITT BROTH培养基均购于英国OXCID公司,血琼脂平板培养基购于北京陆桥生物科技有限公司,全自动微生物鉴定及药敏系统(VITEK©2 Compact)、比浊仪(DensiCHEK plus)以及VITEK2革兰氏阴性(21341)、VITEK2革兰氏阳性(21342)和BCL芽孢细菌鉴定卡(21345)均来自法国生物梅里埃公司,高压灭菌锅来自德国AUTOCLAVE有限公司;生物光学显微镜购于北京普瑞赛司仪器有限公司。
1.3 样品悬液的制备
将采集的新鲜粪便样品以至少6个为1组进行混样,其他3种样品(堆积粪便、土壤和污水)根据每个养殖场采样数量以至少3个为1组进行混样。混样时每份样品称取5.0 g,取混合后的样品5.0 g加入45 mL无菌生理盐水制成10-1梯度稀释液,置于漩涡振荡仪上振荡(800 r·min-1,1 min)混匀,取1 mL悬液与无菌生理盐水倍比稀释制成10-2和10-3梯度稀释液。
1.4 可培养细菌的分离及纯化
取100 μL的10-3梯度稀释液,用无菌涂布棒均匀涂布于培养基上。涂布后将平板倒置于37 ℃条件下恒温培养箱中培养24 h,记录菌落特征及数量,并采用平板划线法,对分离到的菌株进行纯化,每株细菌纯化3~4代,得到纯分离株。
1.5 分离株的鉴定
通过对不同分离培养基的初培养菌落形态进行鉴定[11],初步确定细菌种类(表1)。采用平板划线法,挑取新鲜单个菌落接种于胰蛋白大豆琼脂培养基,37 ℃条件下恒温培养箱中培养24 h后,选取生长良好、性状稳定的单个菌落进行革兰染色并镜检(莱卡显微系统 DM2500,100X oil)。对于镜检时形态一致、革兰染色结果明确的分离株使用相对应的检测卡并采用全自动微生物鉴定及药敏系统进行鉴定;对革兰染色镜检结果不明确和全自动微生物鉴定及药敏系统未鉴定出的菌株选取符合测序要求的进行16S rDNA全长测序,通过对测序结果的BLAST序列进行比对,获得其种属信息。16S rDNA全长测序、拼接由广州赛哲生物科技股份有限公司完成。
表1鉴别培养基用途及典型菌落特征
Table1Differentialmediauseandtypicalcolonycharacteristics

培养基类型 用途 典型菌株 菌落特征伊红美蓝琼脂培养基分离肠道致病菌,特别大肠埃希菌有金属光泽,黑色菌落是大肠杆菌产气肠杆菌无光泽,粉红色菌落金黄色葡萄球菌抑制鼠伤寒沙门菌无色菌落麦康凯琼脂培养基肠道致病菌选择性分离大肠埃希菌桃红色菌落,周围有胆酸盐沉淀环培养鼠伤寒沙门菌无色半透明菌落金黄色葡萄球菌抑制或部分抑制福氏志贺菌无色半透明菌落粪肠球菌抑制甘露醇氯化钠琼脂培金黄色葡萄球菌选择性金黄色葡萄球菌黄色菌落,周围有黄色环养基分离培养大肠埃希菌抑制蜡样芽孢杆菌选择性蜡样芽孢杆菌选择性分蜡样芽孢杆菌菌落为微粉红色,周围有淡红色沉淀环琼脂培养基离培养大肠埃希菌抑制枯草芽孢杆菌黄色菌落,无沉淀环SS琼脂培养基沙门菌、志贺菌选肠炎沙门菌黑色中心菌落择性分离培养福氏志贺菌无色菌落,无黑心鼠伤寒沙门菌黑色中心菌落大肠埃希菌桃红色菌落金黄色葡萄球菌抑制TODD-HEWITT BROTH链球菌选择性分离培养溶血性链球菌白色小菌落培养基粪链球菌白色小菌落金黄色葡萄球菌乳白色大菌落化脓性链球菌白色小菌落血琼脂平板培养基观察溶血反应甲型溶血性链球菌α溶血:又称草绿色溶血,菌落周围培养基出现1^2 mm的草绿色环乙型溶血性链球菌β溶血:菌落周围形成宽大(2^4 mm)、界限分明、完全透明的溶血环
2 结果与分析
2.1 奶牛养殖场可培养细菌分离及鉴定
通过对收集样品进行分离培养,共获得429株分离株,对其中383株镜检时形态一致、革兰染色结果明确的分离株使用相对应的检测卡进行鉴定,263株菌株可以确定种属,鉴定率为68.67%;120株无鉴定结果,占鉴定菌株的31.33%。对符合测序要求的102株菌株进行16S rDNA全长测序,鉴定出其中95株。两种方法共鉴定358株细菌分离株(表2),表明银川地区规模化奶牛养殖场新鲜粪便、堆积粪便、污水和环境土壤样品中可培养细菌种类较丰富。
2.2 奶牛养殖场可培养细菌种群分布多样性分析
可培养细菌种群多样性分析结果表明,358株分离株分布于4个门、6个纲、15个目、23个科、39个属和102个种,4种样品在科以上水平上分布差异较小,而在属、种水平上4种样品的细菌种群分布差异较大(表3)。
表2养殖场环境分离株鉴定情况
Table2Farmsenvironmentalisolatesidentified

样品种类分离株数量鉴定株数量全自动微生物鉴定及药敏系统16S rDNA测序合计鉴定率/%新鲜粪便1661124215492.77堆积粪便8444186273.81土壤9661228386.46污水8346135971.08合计4292639535883.45
表3养殖场环境分离株种群分布多样性
Table3Diversityofisolatesindairyfarms′samples
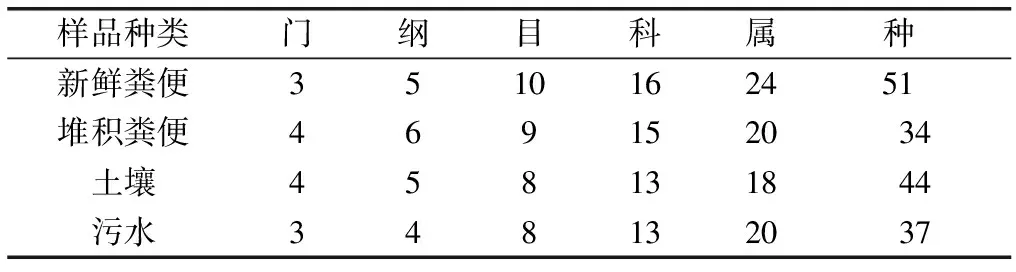
样品种类门纲目科属种 新鲜粪便3510162451 堆积粪便469152034土壤458131844污水348132037
4种样品在不同水平上的Venn图见图1。

F表示新鲜粪便样品;M表示堆积粪便样品;S表示土壤样品;W表示污水样品。图1 4种样品在不同分类水平上的Venn图
由图1可知,在科分类水平上,气球菌科(Aerococcaceae)和消化球菌科(Peptococcaceae)为新鲜粪便与堆积粪便样品的共有科,慢生根瘤菌科(Bradyrhizobiaceae)和黄杆菌科(Flavobacteriaceae)为堆积粪便与土壤样品的共有科;假单胞菌科(Pseudomonadaceae)为土壤与污水样品的共有科。在属分类水平上,气球菌属(Aerococcusspp.)、孪生菌属(Gemellaspp.)、差异球菌属(Alloiococcusspp.)、变形杆菌属(Proteusspp.)出现在新鲜粪便与堆积粪便样品中;慢生根瘤菌属(Bradyrhizobiumspp.)和东海菌属(Donghaeanaspp.)为堆积粪便与土壤样品的共有属;假单胞菌属(Pseudomonasspp.)为土壤与污水样品的共有属。进一步在种分类水平上分析,嗜根考克菌(Kocuriarhizophila)、浅绿气球菌(Aerococcusviridans)、嗜艾氏杆菌(Bacilluseiseniae)、耳炎差异球菌(Alloiococcusotitis)和大肠埃希菌O157:H7(EscherichiacoliO157:H7)分离自新鲜粪便和堆积粪便样品中;溶血葡萄球菌(Staphylococcushaemolyticus)、木糖葡萄球菌(Staphylococcusxylosus)、放射根瘤菌(Rhizobiumradiobacter)、脑膜炎败血伊丽莎白菌(Elizabethkingiameningosepticum)为堆积粪便与土壤样品的共有种;腐生葡萄球菌(Staphylococcussaprophyticus)、芽孢杆菌(Bacillusoceanisediminis)、施氏假单胞菌(Pseudomonasstutzeri)、荧光假单胞菌(Pseudomonasfluorescens)为土壤与污水样品的共有种;在新鲜粪便与土壤样品中,分离出海氏肠球菌(Enterococcushirae)、苛养颗粒链菌(Granulicatellaelegans)、人葡萄球菌(Staphylococcushominisssp.hominis)和表皮葡萄球菌(Staphylococcusepidermidis)等8种共有种。4种样品在各分类阶元均分离出同种属的分离株,表明样品中细菌种群分布具有相似性。
新鲜粪便与堆积粪便样品共有菌种数量在各分类阶元中均高于新鲜粪便与土壤样品或与污水样品,说明堆积粪便保留了大部分来自新鲜粪便的群落,同时还受土壤细菌种群的影响,使两者群落结构具有相似性;污水样品中可培养细菌种群分布与新鲜粪便、堆积粪便和土壤样品都存在较高的相似性,这主要是由于污水的流动性导致大量细菌富集所致。通过对4种样品细菌分离株在不同分类阶元中分布的差异分析,表明各样本具有丰富的细菌种群结构。由于受到人为或自然的影响,细菌会在环境中发生迁移,增加了不同环境样本的种群多样性,同时也增加了病原菌的传播风险。
样品中可培养细菌组成和相对丰度见图2。由图2可知,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)是优势微生物门,覆盖了90%以上的菌种;微球菌科(Micrococcaceae)、肠球菌科(Enterococcaceae)、链球菌科(Streptococcaceae)、肉杆菌科(Carnobacteriaceae)、葡萄球菌科(Staphylococcaceae)、芽孢杆菌科(Bacillaceae)、鞘脂单胞菌科(Sphingomonadaceae)和肠杆菌科(Enterobacteriaceae)8个科是优势科,占总类群的84.40%;考克菌属(Kocuriaspp.)、肠球菌属(Enterococcusspp.)、链球菌属(Streptococcusspp.)、德库菌属(Desemziaspp.)、葡萄球菌属(Staphylococcusspp.)、芽孢杆菌属(Bacillusspp.)、鞘脂单胞菌属(Sphingomonasspp.)和泛菌属(Pantoeaspp.)为优势属,占总类群的66.30%。随分类阶元的降低,样本间共有菌属的相对丰度降低,而细菌群落多样性增加。
由图3可知,不同样品优势细菌种群组成较一致,葡萄球菌属作为4种样品的共同优势菌属,分别占新鲜粪便、堆积粪便、土壤和污水样品中可培养细菌种类的30.97%、30.65%、28.92%和11.86%;其次是芽孢杆菌属,分别占15.48%、16.13%、12.05%和5.08%。但是由于样品自身的特性,群落组成也表现出明显差异。例如,在污水样品中,考克菌属所占比例和葡萄球菌属相同,为11.86%,但在其他3种样品中考克菌属所占比例远低于葡萄球菌属。部分细菌种群是各样品所独有的,例如新鲜粪便样品中独有加德纳菌属(Gardnerellaspp.)0.65%、新生微球菌属(Newbornmicrococcusspp.)0.65%、棒杆菌属(Corynebacteriumspp.)0.65%、动性球菌属(Planococcusspp.)0.65%、玫瑰单胞菌属(Roseomonasspp.)0.65%和布丘菌属(Buttiauxellaspp.)0.65%;堆积粪便样品中独有短芽孢杆菌属(Brevibacillusspp.)1.61%和弧菌属(Vibriospp.)1.61%;土壤样品中独有微球菌属(Micrococcusspp.)1.20%、肉杆菌属(Carnobacteriumspp.)1.20%和海洋假单胞菌属(Marinepseudomonasspp.)2.41%;污水样品中独有库特菌属(Kurthiaspp.)1.69%、克雷伯菌属(Klebsiellaspp.)3.39%、预研菌属(Yokenellaspp.)1.69%、气单胞菌属(Aeromonasspp.)8.47%和希瓦菌属(Shewanellaspp.)5.08%。这种差异不仅展示了各种样品的独特性,也说明粪便堆积过程会使一些细菌种群丰度增加,并且在堆积过程中,细菌会与周围环境发生迁移,增加细菌性疾病传播的风险。

F表示新鲜粪便样品;M表示堆积粪便样品;S表示土壤样品;W表示污水样品。图2 奶牛养殖场可培养细菌在门、科和属水平上的组成和相对丰度
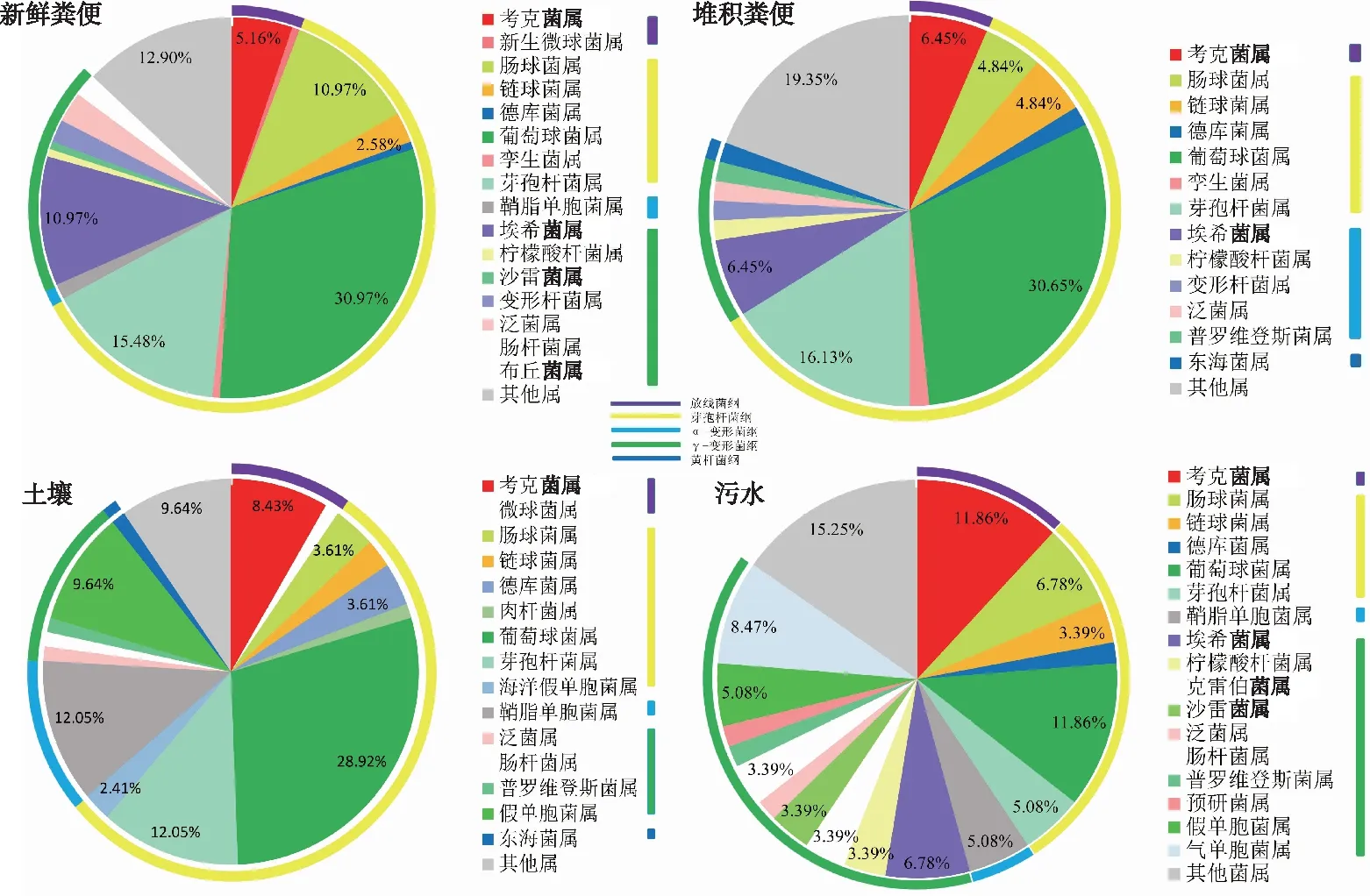
图3 样品中可培养微生物在纲、属水平的分布
2.3 奶牛养殖场可培养细菌中条件致病菌分布
健康的人或动物体表及与外界相通的腔道等部位存在多种细菌种群,当机体免疫力处于正常状态时,这些菌群对机体无害甚至是有益的;但是当机体抵抗力降低时,这些细菌可能侵入机体其他部位从而引起感染,这类细菌称为条件致病菌(机会致病菌)[12]。基于《一二三类动物疫病释义》[13]和《动物病原微生物分类名录》(原农业部第53号令)对条件致病菌的定义及归类,对4种样品中可培养细菌分离株进行比对分析,部分结果见表4。在358株分离株中,条件致病菌约占88.55%(317/358),在种水平上主要为[14-15]金黄色葡萄球菌(Staphylococcusaureus)和大肠埃希菌[16],在属水平上主要为链球菌属、肠球菌属、不动杆菌属(Acinetobacterspp.)、假单胞菌属(Pseudomonasspp.)和鞘脂单胞菌属等。在新鲜粪便样品中金黄色葡萄球菌占4.84%,大肠埃希菌占6.54%;在堆积粪便样品中金黄色葡萄球菌占2.58%,大肠埃希菌占16.77%,炭疽杆菌(Bacillusanthracis)占1.61%;在土壤样品中金黄色葡萄球菌占3.61%;在污水样品中大肠埃希菌占5.08%。这表明奶牛养殖场粪污中含有大量条件致病菌,这些条件致病菌将对人和动物的健康以及对环境造成严重威胁[17],是人类公共卫生安全的潜在风险源。
表4奶牛养殖场环境样品中部分条件致病菌种属信息
Table4Conditionalpathogenicbacteriainenvironmentalsamplesofdairyfarms

分类阶元 病原菌革兰阴阳性疾病F/M/S/W样品数量/株 种水平金黄色葡萄球菌(Staphylococcus aureus)Gram +葡萄球菌病4/3/3/0炭疽杆菌(Bacillus anthracis)Gram +炭疽病0/1/0/0大肠杆菌(包括O157:H7)[Escherichia coli(include O157:H7)]Gram -溶血性尿毒症综合征、血栓性血小板减少性紫癜、出血性结肠炎26/4/0/3 属水平不动杆菌属(Acinetobacter spp.)Gram -皮肤和伤口感染、菌血症、脑膜炎、肠胃炎2/0/4/5链球菌属(Streptococcus spp.)Gram +红眼病、脑膜炎、细菌性肺炎、心内膜炎、红斑、坏死性筋膜炎4/3/2/2鞘氨醇单胞菌属(Sphingomonas spp.)Gram -呼吸道感染、临床感染2/1/10/3肠球菌属(Enterococcus spp.)Gram +尿路感染、菌血症、细菌性心内膜炎、憩室炎和脑膜炎17/3/3/4假单胞菌属(Pseudomonas spp.)Gram -皮肤和皮下组织感染、呼吸道感染、尿道感染、影响免疫系统受损的患者0/0/8/3
Gram -为革兰阴性菌;Gram +为革兰阳性菌。F表示新鲜粪便样品;M表示堆积粪便样品;S表示土壤样品;W表示污水样品。
3 讨论
规模化养殖是目前奶牛养殖产业发展的主要方式之一,而养殖场中可培养细菌种群直接影响着奶牛养殖业能否健康有序发展。因此,养殖场中可培养细菌种群分布及多样性一直是广受关注的热点问题。目前有关奶牛肠道微生物研究较多[18],但是针对奶牛粪便及奶牛养殖场环境土壤及粪污中可培养细菌多样性的研究却鲜有报道。基于细菌种属间典型生理生化反应谱差异和16s rDNA序列多态性,采用全自动微生物鉴定及药敏系统和16S rRNA测序方法[19-22],共鉴定了358株分离株,分布于4个门、6个纲、15个目、23个科、39个属和102个种,表明银川地区规模化奶牛养殖场的粪污及土壤样品中可培养细菌种群丰富且多样,其中条件致病菌占88.55%(317/358),表明奶牛养殖场粪污是潜在的病原菌传播源[23]。
分析结果发现厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)是奶牛粪便、污水和环境土壤样品中可培养细菌的优势菌门,占分离株总数的近90%,这与相关研究结果[24-25]一致。其中,堆积粪便样品的细菌种群组成与新鲜粪便相似,但是考克菌属(Kocuriaspp.)、链球菌属(Streptococcusspp.)、德库菌属(Desemziaspp.)、芽孢杆菌属(Bacillusspp.)和鞘脂单胞菌属(Sphingomonasspp.)在堆积粪便中的分离株数量比新鲜粪便多,其中包括部分条件致病菌,表明堆积的奶牛粪便有利于细菌,包括条件致病菌的富集或繁殖。污水样品中分离株数量虽然最低,但其分离株中98.31%(58/59)为条件致病菌。因此,污水随意排放造成的安全隐患不容忽视。相对于新鲜粪便和堆积粪便,土壤样品中可培养细菌种群多样性较高,拥有较多样化的种群结构,但部分种属在3者间均有分布,包括克氏库克菌(Kocuriakristinae)、托尔豪特链球菌(Streptococcusthoraltensis)、小牛葡萄球菌(Staphylococcusvitulinus)、金黄色葡萄球菌(Staphylococcusaureus)、地衣芽胞杆菌(Bacilluslicheniformis)和少动鞘氨醇单胞菌(Sphingomonaspaucimobilis)等,说明养殖场周边环境土壤的可培养细菌种群结构会受到粪污中细菌的影响。这表明细菌可在动物机体(新鲜粪便)、养殖场粪污(堆积粪便和污水)和养殖场环境(土壤)间进行迁移[26-27],甚至可能会迁移到水和空气环境中[28-29],更为严重的是这些细菌所携带的耐药基因也会随之在环境中传播[30-31]。由此可见,如果养殖场粪污不经有效处理就排放到环境中,将会增加细菌性传染病发生的概率从而严重威胁人与动物的健康。
对样品中分离的条件致病菌数量及种类分析发现,实验过程中分离出的病原菌,多是各地区报道过的与奶牛乳房炎相关的病原菌,如大肠杆菌(Escherichiacoli)、乳房链球菌(Streptococcusuberis)、金黄色葡萄球菌(Staphylococcusaureus)等[32-34]。有研究表明,牛奶中病原菌的主要来源与挤奶过程中奶牛粪便的污染直接相关[35]。因此如果奶牛养殖场粪污不经科学处理就直接排放或还田,将会对奶牛健康养殖造成影响,进而造成食源性污染,大大增加细菌性传染病发生风险,威胁人类健康[36-37]。系统研究奶牛养殖场粪污细菌群落分布及多样性,将会为奶牛养殖业健康有序发展提供理论依据。

