海水中舟形藻对Q235碳钢腐蚀行为的影响
, ,,,
(1. 中国科学院海洋研究所 中国科学院海洋环境腐蚀与生物污损重点实验室,青岛 266071; 2. 上海海洋大学 海洋生态与环境学院,上海 201306; 3. 青岛海洋科学与技术国家实验室 海洋腐蚀与防护开放工作室,青岛 266237)
微生物腐蚀是金属表面、非生物腐蚀产物(FeS,Fe(OH)3,Fe2O3等)与细菌细胞及其代谢物之间相互作用的结果[1-3]。在许多环境中,微生物倾向于黏附在固体表面上形成生物膜保护层[4],减少暴露于外部环境的固体表面。然而,这也可能导致局部腐蚀和基质材料如金属、聚合物和混凝土的劣化[5-7]。金属表面存在的微生物通常会导致电解质组分含量,pH和氧浓度发生局部变化[8]。CONGMIN等[9]研究发现不锈钢表面硫酸盐还原菌(SRB)及其代谢产物的相互作用不但加重了生物膜的腐蚀损伤程度,还加速了点蚀。
在海洋环境中,构筑物表面易附着大量底栖硅藻,此外,船体表面也会附着大量硅藻,并且它们在船舶行驶过程中不易去除,可能会影响船舶的正常行驶[10]。目前,关于微藻对金属材料污损附着影响的研究较少,因此有必要研究单一微藻在材料表面的附着及其对材料的污损影响。孙彩霞[11]通过改变阳极表面电阻来研究双眉藻和舟形藻对锌和锌铝镉合金2种牺牲阳极的影响,发现Zn阳极试样在含微藻培养液中的腐蚀速率大于在灭菌培养液中的;汪江伟等[12]研究了钙质层对Q235碳钢在含双眉藻的f/2培养基中腐蚀行为的影响。双眉藻及其胞外聚合物(EPS)易在碳钢表面附着形成生物膜阻碍了外界传质过程,但对O2扩散的阻碍效果不明显。LIU等[13]研究了Q235碳钢在小球藻存在条件下的腐蚀行为,结果表明试样在含小球藻环境中的平均腐蚀速率约为在不含小球藻环境中的4倍,且在含小球藻环境中,试样白天的腐蚀速率高于夜间的。
微藻的光合作用会发生电子转移,这些电子能够通过细胞外物质转移给与之接触的材料,从而影响材料的电化学性质[14-15]。在有光照的情况下,微藻是浸入水体中工程材料表面生物膜的主要贡献者。
舟形藻(Navicula)是一种底栖硅藻,在生长过程中能分泌具有多种生物活性的硫酸化多糖,是一种较有代表性的微藻[16-17]。本工作研究了舟形藻对Q235碳钢在海水环境中腐蚀行为的影响,探寻污损生物附着对基体腐蚀的作用机制,以期了解海洋生物污损机制,为对其进行有效治理提供借鉴。
1 试验
1.1 试样
试验材料为Q235碳钢,尺寸为10 mm×10 mm×10 mm,化学成分(质量分数/%)为:C 0.1,Mn 0.4,Si 0.12,S 0.02,P 0.05,余量为Fe。
电化学试验用试样的工作面积为1 cm2,将试样一端用铜导线焊接后,非工作面用环氧树脂封装在PVC管中,制作成工作电极。浸泡试验用试样的处理过程如下:用铜导线缠绕碳钢试样(用于悬挂),采用704硅胶密封裸露的导线部分,试样表面用砂纸(120~1 000号)逐级打磨至光滑,并用乙醇超声清洗,再用蒸馏水清洗干燥后放入干燥器中待用。所有需要暴露在培养基中的试样在使用前都需要放在紫外灯下灭菌30 min。
1.2 舟形藻的培养
舟形藻来源于中国科学院海洋研究所藻种库。舟形藻在生长初期(1~4 d),分裂迟缓,增长缓慢。约5 d后舟形藻在培养液中吸收充足养分并适应环境,不断进行二次分裂,增长迅速,呈现对数增长。随着培养液中的营养物质经过新陈代谢消耗殆尽,活性舟形藻在达到稳定生长后逐渐减少[18]。
将处在对数生长期的舟形藻溶液接种到含有培养基的250 mL三角烧瓶中,培养基为f/2培养基,(成分见表1),将舟形藻置于GXZ-280D型智能光照培养箱(宁波江南仪器厂)中培养,温度为23 ℃,光照强度为3000 lx,光照与黑暗时间之比为1∶1。
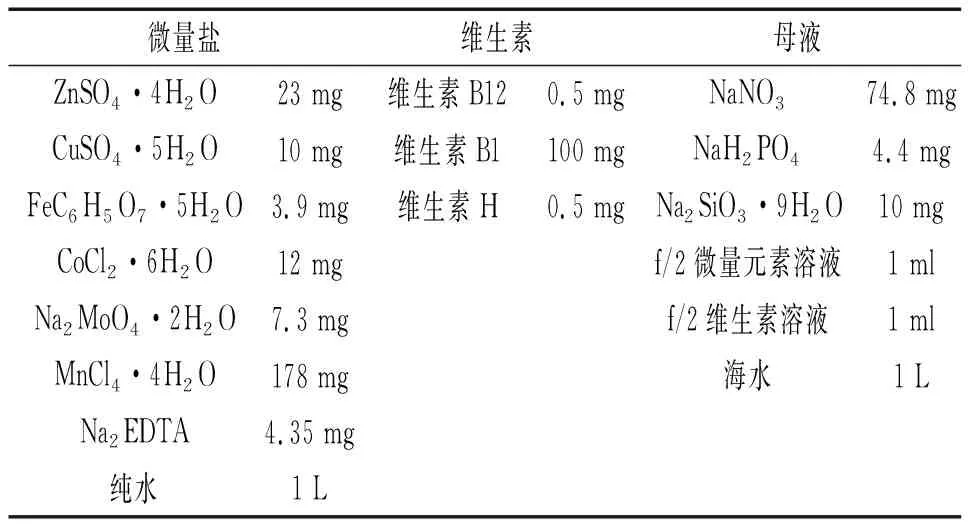
表1 f/2培养液的成分Tab. 1 Composition of f/2 culture medium
f/2培养液母液需要在灭菌锅内121 ℃灭菌30 min,微量元素和维生素用孔径为0.22 μm的滤膜过滤除去其他微生物。整个试验均在无菌的超净工作台上完成。
1.3 浸泡试验
取两个已灭菌的广口瓶分别倒入400 mL f/2培养液,其中一个加入40 mL处于生长期的藻液。把制备好的碳钢试样浸泡于培养基中,采用透气膜将瓶口封住。将两个广口瓶放置在光照培养箱中培养,15 d后把两个广口瓶中的试样分别从广口瓶中取出,用除锈剂对试样进行表面处理,干燥后,采用JSM-5600LV型扫描电子显微镜进行观察,加速电压为25 kV,并采用X射线能谱仪进行元素分析。
1.4 电化学试验
电化学试验在Gamry1000电化学工作站上完成,采用三电极体系,饱和甘汞电极(SCE)为参比电极,铂电极为辅助电极,试样为工作电极。电化学阻抗谱的测试频率是100 mHz~10 kHz,扰动信号幅值为10 mV,测试周期为15 d。使用ZSimpWin电化学分析软件对测试结果进行分析拟合。
2 结果与讨论
2.1 腐蚀形貌
由图1可见:在不含舟形藻的培养基中浸泡15 d后的试样(以下简称空白试样)表面发生的是均匀腐蚀;而在含有舟形藻培养液中浸泡15d后的试样(以下简称含藻试样)表面发生不均匀腐蚀,在局部出现了较严重的腐蚀坑。舟形藻参与形成生物膜后,会对Q235碳钢表面所处的局部环境产生影响,从而改变Q235碳钢的腐蚀过程[19-20],在f/2培养液中,舟形藻起初会在碳钢表面形成一层微生物膜,具有一定的保护作用,但由于Q235碳钢易腐蚀,腐蚀产物不断更新使得舟形藻附着困难,导致部分微生物膜脱落而未能起到保护作用。疏松多孔的生物膜有利于腐蚀性离子的侵入,从而加速Q235碳钢的腐蚀[13]。同时,舟形藻代谢产氧,由于溶液中O2含量的增加,氧去极化作用使生物膜抑制腐蚀的效果减弱[21]。由此,舟形藻的存在增强了材料表面的腐蚀。

(a) 不含舟形藻 (b) 含舟形藻 图1 Q235碳钢在不含和含舟形藻的f/2培养液中浸泡15 d后的腐蚀形貌Fig. 1 Corrosion morphology of Q235 carbon steel after soaking in f/2 medium without (a) and with (b) navicula for 15 days
2.2 腐蚀产物成分
由图2和表2可见:含藻试样表面的镁含量增加,镁是叶绿素(包括叶绿素a、叶绿素b和叶绿素c)吡咯环的中心原子[22],镁含量的增加说明附着在Q235碳钢表面的舟形藻衰亡释放出了细胞内的叶绿素;同时含藻试样表面还发现了钾(K)、钙(Ca)等元素,这可能是无机离子矿化和胞外聚合物络合作用的结果。舟形藻附着在材料表面可分泌胞外聚合物[13],EPS对金属阳离子有很强的络合能力,促进Q235碳钢的溶解和腐蚀[23-24],见式(1)

含藻试样表面的硅元素和磷元素减少,硅和磷是舟形藻生长所需的营养成分,能促进舟形藻的生长,舟形藻在生长过程中不断消耗硅和磷,材料表面的磷酸盐可产生磷酸铁等沉淀[25],见式(2)~(4)。
4H2O(2)
2H2O(3)

4Fe(OH)3(4)

(a) 不含舟形藻
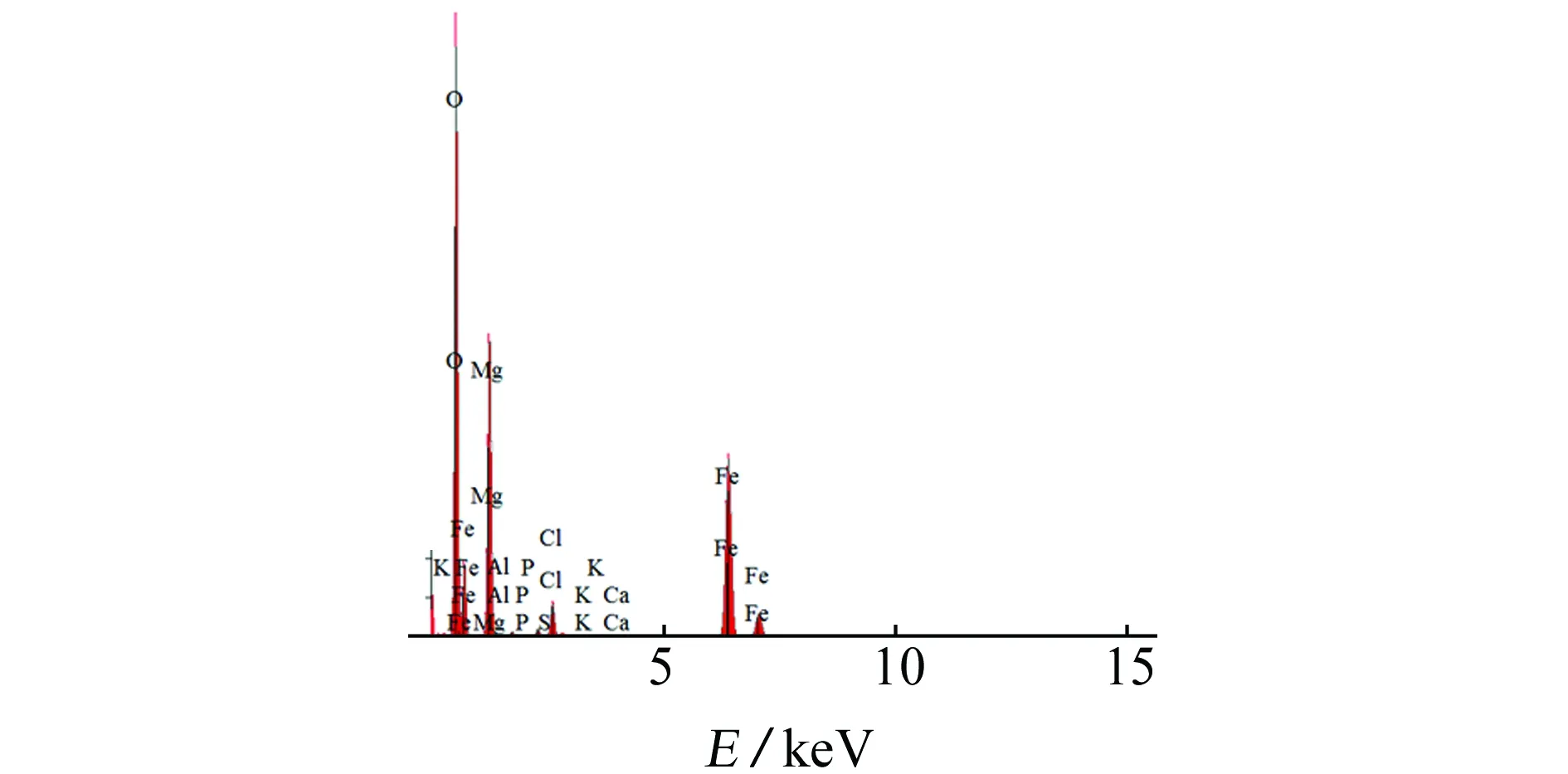
(b) 含舟形藻图2 试样在不含舟形藻和含舟形藻培养液中浸泡15 d后的EDS图Fig. 2 EDS patterns of samples after soaking in f/2 medium without (a) and with (b) navicula for 15 days
2.3 电化学试验
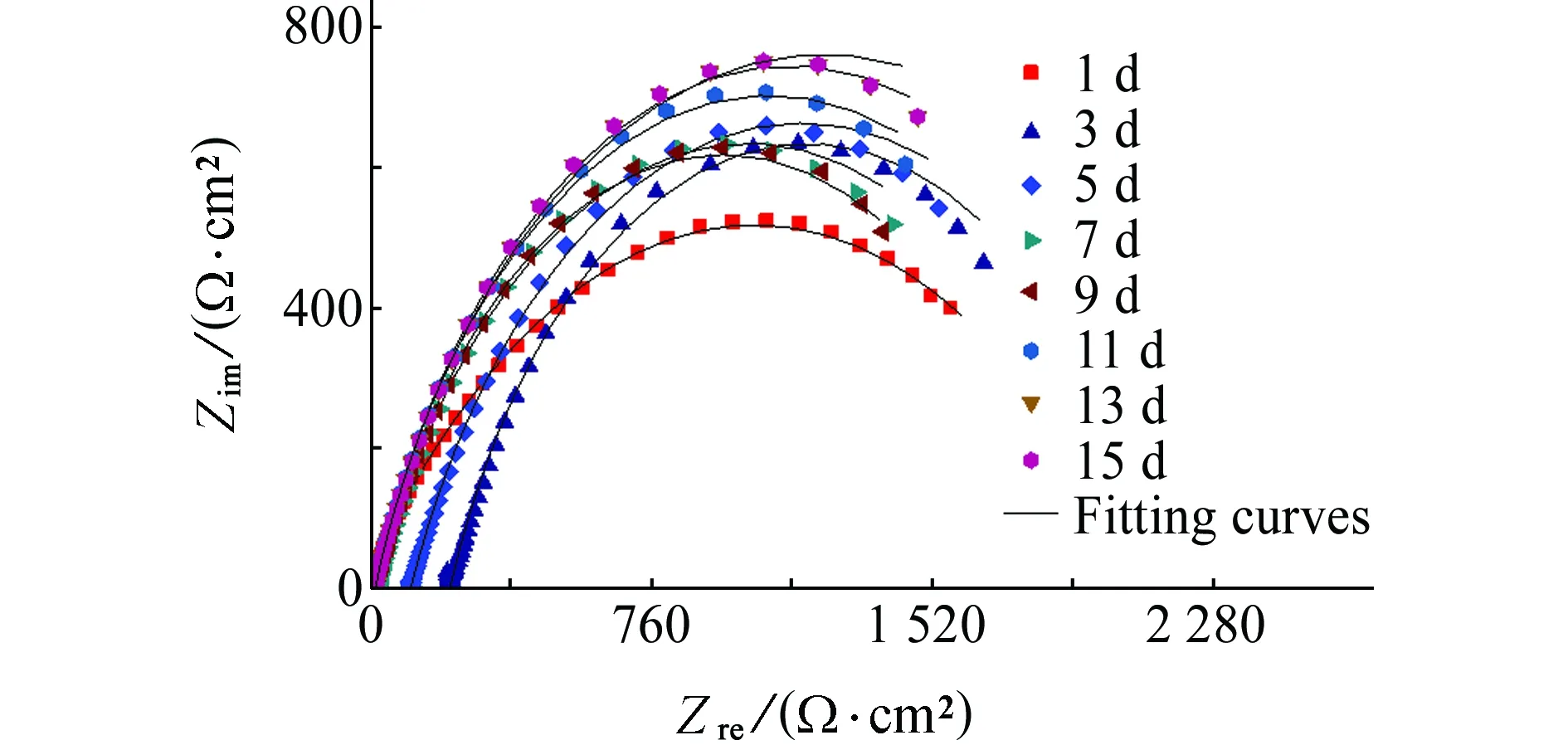
图3~5为试样在不含和含舟形藻培养液中浸泡不同时间后的电化学阻抗谱,采用图6所示等效电路图进行拟合,相关电化学拟合参数见表3和表4。其中,Rsol为溶液电阻,Qdl为界面双电层电容,Rct为电荷传递电阻,Rct(电荷传递电阻)可以用来表征金属腐蚀速率,电荷传递电阻越大,金属腐蚀速率越小。从表中的拟合值可看出,在整个试验周期内,Rct最高为2 552 Ω·cm2,最低为1 496 Ω·cm2,试样的腐蚀速率维持在相对稳定的状态,整个体系相对稳定,由于在无藻培养液中存在磷酸盐,可以通过形成保护膜来抑制碳钢的腐蚀[24-26],随着浸泡时间的延长,腐蚀产物的形成和积累可形成致密且具有一定厚度的生物膜,对基体起到保护作用,故阻抗随浸泡时间的延长不断增大,试样的耐蚀性增加。
(a) 不含舟形藻
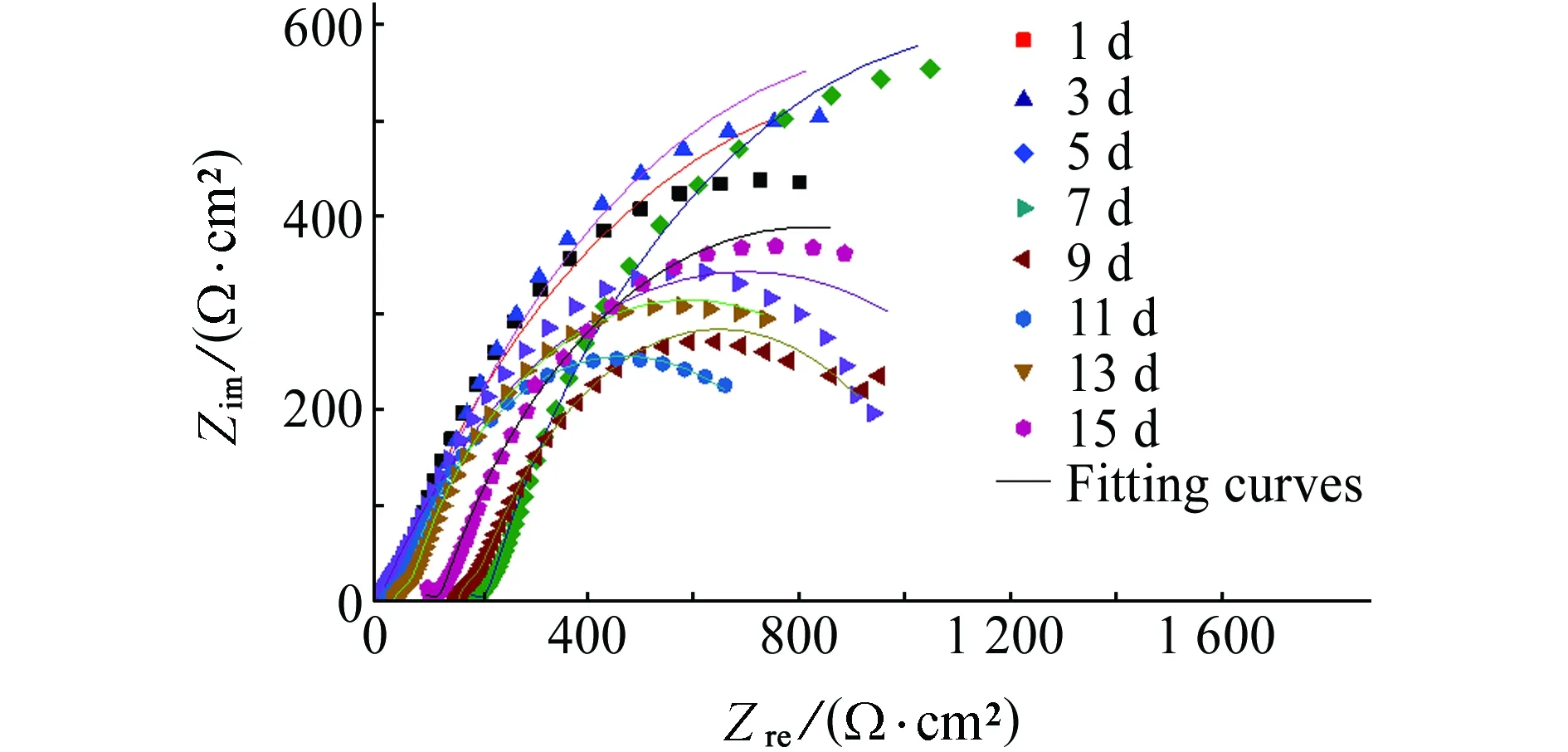
(b) 含舟形藻图3 试样在不含和含舟形藻的培养液中浸泡不同时间后的Nyquist图Fig. 3 Nyquist polts of samples after soaking in culture medium without (a) and with (b) navicula for different times
(a) |Z|-lgf

(b) φ-f图4 试样在不含的培养液中浸泡不同时间后的Bode图Fig. 4 Bode polts of samples after soaking in culture medium without navicula for different times

(a) |Z|-lgf
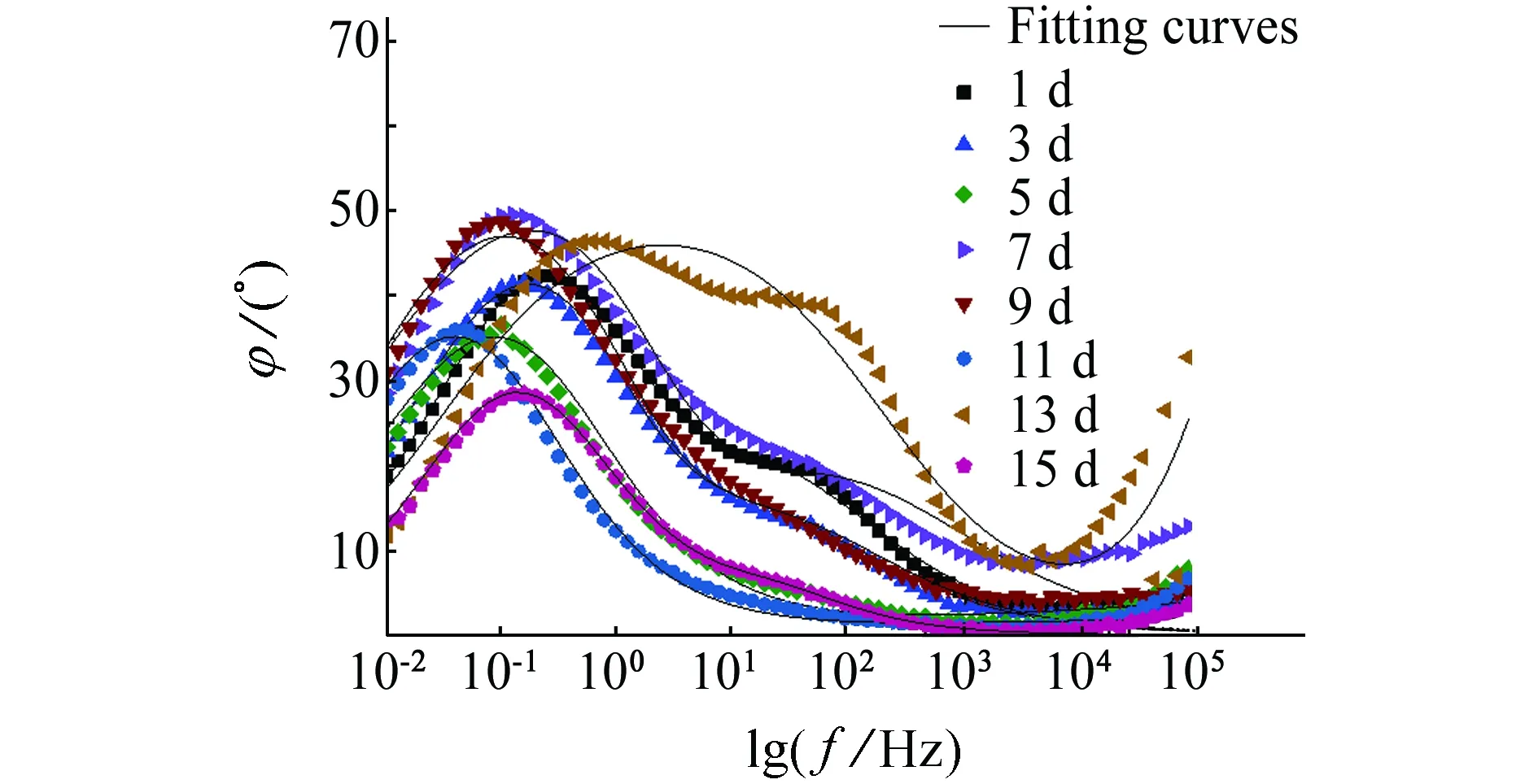
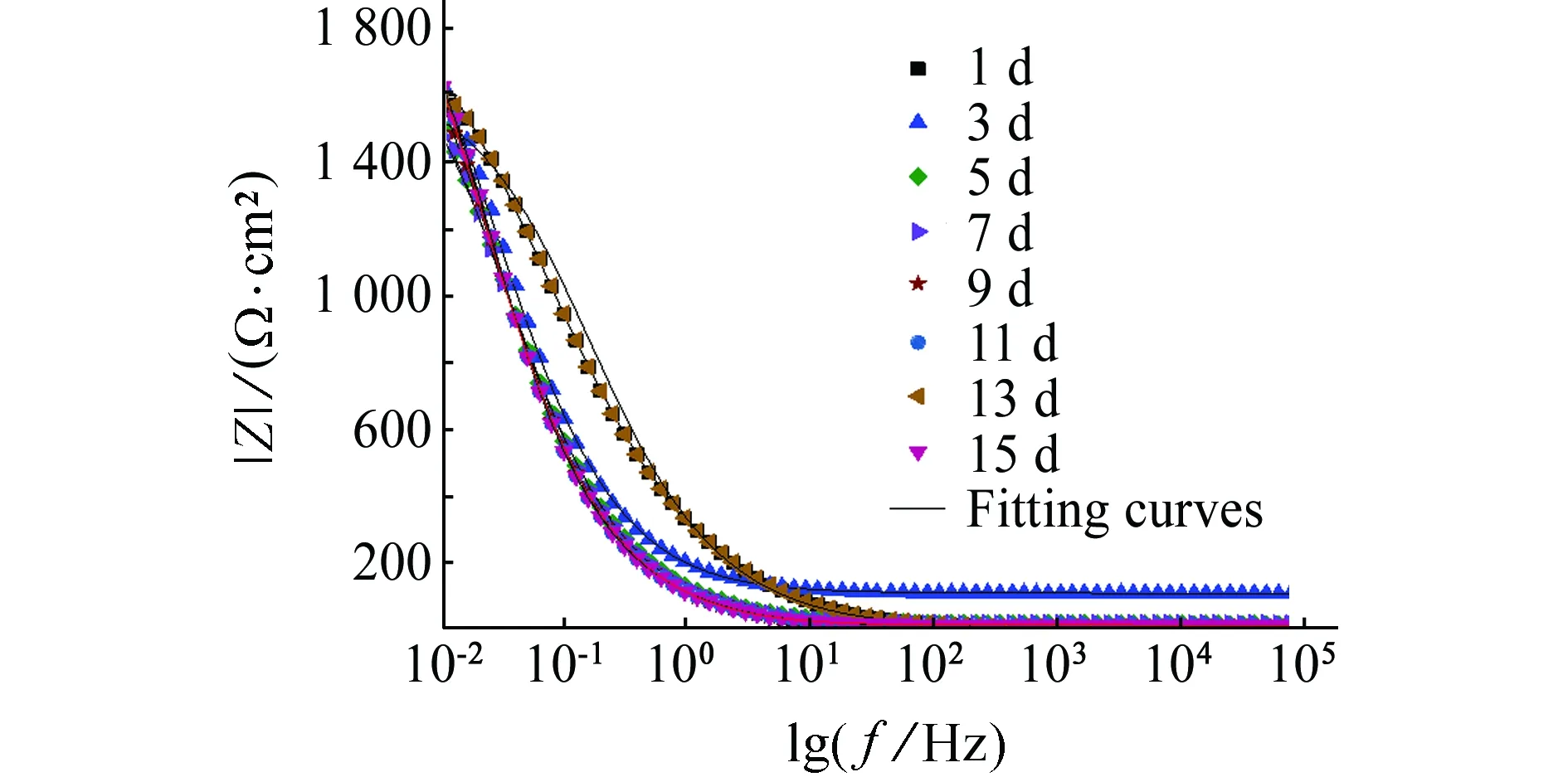
(b) φ-f图5 试样在含舟形藻的培养液中浸泡不同时间后的Bode图Fig. 5 Bode polts of samples after soaking in culture medium with navicula for different times

(a) 不含舟形藻

(b) 含舟形藻图6 电化学阻抗谱的等效电路图Fig. 6 Equivalent circuit diagram of EIS:(a) without navicula; (b) with navicula

浸泡时间/dRsol/(Ω·cm2)QdlYdl/(10-6 Ω-1·cm-2·sn)ndlRct/(Ω·cm2)15.367390.80.800 01 78036.69718 9600.679 71 4965214.91 9010.740 31 9327108.62 0970.714 32 114917.042 1050.718 92 0061118.642 1100.745 31 868138.1052 2500.740 22 1411510.301 7980.795 72 552
图6(b)中,Qf为生物膜表面层电容,Rf为表面层电阻。由表4可见:Rct整体呈现上升趋势。浸泡初期Rct减小,为838.7~1 388 Ω·cm2,这是由于舟形藻的光合作用产生氧气,增加体系中溶解氧浓度,氧的去极化加速金属腐蚀;随着浸泡时间的延长,Rct增加,此时舟形藻处于对数生长期,培养基中舟形藻的密度增大,舟形藻的代谢产物膜与Q235碳钢的腐蚀产物累积对基体产生保护作用,阻碍了传质过程,金属基体腐蚀被抑制;试验后期,Rct减小,这是由于舟形藻光合作用使生物膜下产生局部高浓度溶解氧,增强氧还原阴极电流,使局部发生氧去极化反应从而促进局部腐蚀,见式(5)。
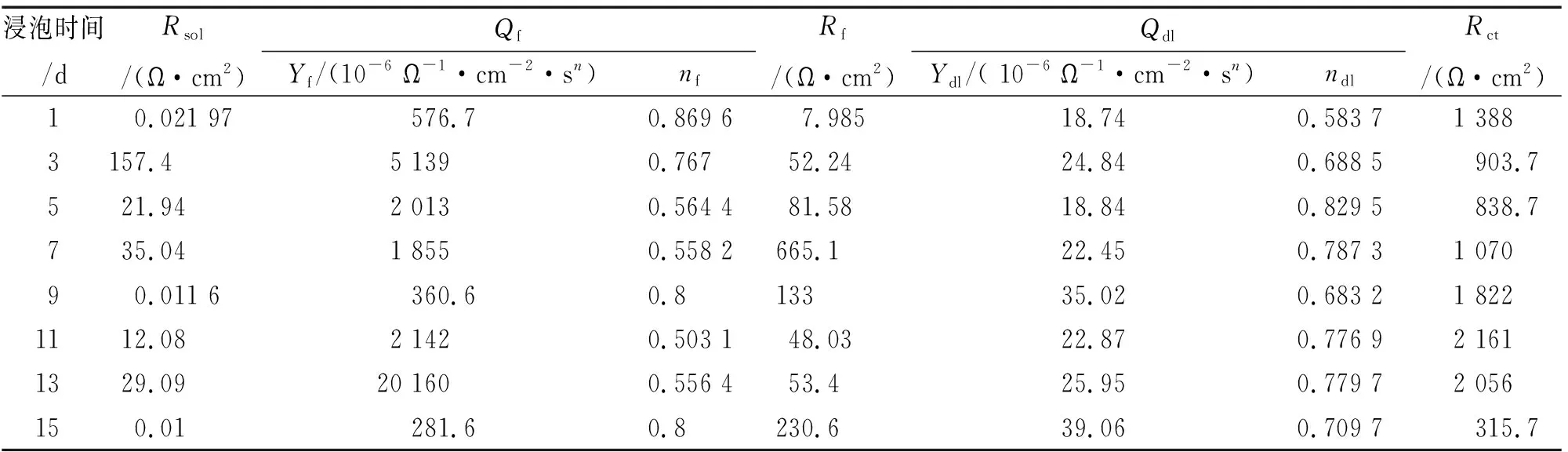
表4 Q235试样在含舟形藻培养液中的EIS等效电路拟合值Tab. 4 Values of electrochemical parameter for Q235 canbon steel in f/2 culture medium with navicula
O2还原反应产生OH-可促进生成氢氧化铁,见式(6)。

在阳极位置,Fe可以连续被氧化,生成Fe2+,并形成沉淀,最终导致Q235碳钢表面形成凹坑。Fe(OH)2可首先氧化为FeOOH,FeOOH是不稳定的,会进一步分解为Fe2O3[13]。
Cl-的侵入也能促进局部腐蚀,从而引起严重的局部腐蚀。
由图7可见:在含舟形藻的试验溶液中,试样的腐蚀电流密度(Jcorr)更高,这表明舟形藻的存在促进碳钢的腐蚀。
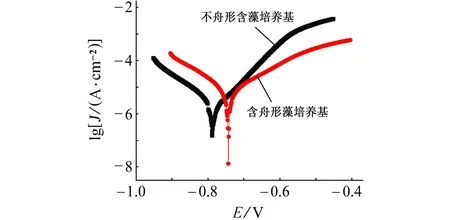
图7 试样在不含和含舟形藻的培养液中浸泡15 d后的极化曲线Fig. 7 Potentiodynamic polarization curves of samples after soaking in culture medium without and with navicula for 15 d
3 结论
(1) Q235碳钢在不含舟形藻的培养液中发生均匀腐蚀,在含有舟形藻的培养液中发生严重的局部腐蚀。
(2) 碳钢在含舟形藻的培养基中的腐蚀过程与舟形藻生长周期呈现一定的规律性:在舟形藻生长初期,Q235碳钢腐蚀加速;随着浸泡时间的延长,舟形藻进入对数生长期,生成的生物产物膜对碳钢有一定的保护作用,使碳钢的腐蚀速率降低;随着浸泡时间继续延长,生物膜开始脱落,同时舟形藻不断产氧,氧去极化作用使碳钢表面腐蚀增加。
(3) 舟形藻参与形成生物膜后,在碳钢表面分泌的EPS对Fe2+有很强的络合能力,能促进Q235碳钢的腐蚀。附着在Q235碳钢表面的舟形藻衰亡释放出细胞内的叶绿素导致镁含量增加。

