CIK细胞培养基及高效杀伤肝癌细胞效靶比的选择
李美鹤,戴尔珣,孙丽,侯雪芹,张汝建
(1泰山医学院,山东泰安 271000;2苏北人民医院;3西安交大扬州科技园;4泰山医学院附属医院)
过继免疫疗法是癌症免疫疗法中的一种,是指将自体或异体的抗肿瘤效应细胞前体在体外进行活化、增殖,然后输入患者体内,使其发挥抗肿瘤作用[1]。过继免疫疗法作用靶点位于人体正常免疫细胞,通过激活自身的免疫系统达到治疗癌症的目的。细胞因子诱导杀伤细胞(CIK细胞)是人体外周血单个核细胞体外诱导产生的具有杀瘤作用的异质细胞群,它对癌症的治疗属于过继免疫疗法,是肿瘤过继细胞免疫疗法中的首选方法,而且是免疫治疗的主要方法之一。一定数量的CIK细胞不仅对肿瘤细胞有杀伤作用,而且能增强患者免疫功能,提高患者免疫力,这一发现给予了可能攻克肿瘤的新希望[2~6]。由于在细胞免疫治疗过程中所需CIK细胞数量巨大,但迄今为止如何更高效扩增CIK尚未统一。1640培养基是扩增CIK细胞最常用的一种培养基,GT-T551培养基也可以作为CIK诱导培养的一种较佳选择,早期研究[7]发现该培养基能显著提高CIK细胞的扩增倍数,但目前对其所培养细胞杀伤作用的研究尚缺乏,所以GT-T551培养基诱导培养CIK的优化培养体系仍需进一步探索。IL-2是一种具有广泛生物活性的细胞因子,是所有T细胞亚群的生长因子,并能够促进B细胞活化增殖,是调控免疫应答的重要因子。此外,IL-2还参与体内的抗原-抗体反应、造血和肿瘤监视,在免疫细胞的诱导分化中起重要作用。IL-2虽然能够增强细胞增殖能力,但一定浓度范围内的IL-2并不能对细胞生物学活性产生明显影响[8]。在临床应用中,不仅要对细胞的增殖能力进行评估,还要对其杀伤效果做出评价。通过研究不同效靶比CIK对肝癌的杀伤情况,以期为今后CIK细胞在肝癌中的临床应用提供依据,这对肿瘤免疫治疗的发展也有重要意义。本研究观察了不同培养基内CIK细胞的增殖能力及不同效靶比CIK细胞对肝癌细胞的杀伤效应,旨在寻找一种稳定、高效的培养方法及杀伤肿瘤细胞的最佳效靶比。
1 材料与方法
1.1 细胞、试剂及仪器 CIK细胞(抽取5例健康志愿者肘静脉外周血各20 mL,肝素抗凝,经Ficoll淋巴细胞分离液密度梯度离心后,吸取白膜层,获得单个核细胞(PBMC),PBS液洗涤2次,肝癌7721细胞(为实验室冷冻保存,将液氮冷冻保存的7721细胞放入37 ℃水浴箱中快速摇晃解冻,离心机1 500 r/min,5 min离心后弃上清,用10 mL含10%胎牛血清的RPMI Medium 1640培养基重悬细胞,移至T25培养瓶中,置37 ℃、5%CO2饱和湿度培养箱培养。隔天全量换液1次。在培养过程中光学显微镜下观察细胞,并记录细胞生长情况及形态变化。当细胞贴壁融合面积达90%以上时,胰酶消化细胞,进行传代培养。取P3代细胞用于后续的实验);10%胎牛血清(杭州四季青),RPMI Medium 1640培养基(Gibco公司),GT-T551(TaKaRa公司),细胞冻存液(Zenoaq公司),重组人白细胞介素-2(IL-2,北京双鹭药业股份有限公司),干扰素-γ(上海凯茂生物医药有限公司),抗CD3单克隆抗体(德国Miltenyi Biotec公司),CCK8检测试剂盒(日本Dojindo公司);三用电子恒温水箱(北京中兴伟业仪器有限公司),37 ℃、5%CO2饱和湿度培养箱及离心机、酶标仪(Thermo公司)。
1.2 不同培养基中CIK细胞的增殖能力观察 抽取5例健康志愿者肘静脉外周血各20 mL,肝素抗凝,经Ficoll淋巴细胞分离液密度梯度离心后,吸取白膜层,获得单个核细胞,PBS液洗涤2次。调整初始细胞密度为1×106/mL,用含2%健康成人血浆的1640培养基和GT-T551培养基分别培养,第0天加入干扰素-γ,终浓度1 000 IU/mL。24 h后加入抗CD3单克隆抗体50 ng/mL、IL-2 500 IU/mL对细胞进行预刺激。两种培养基分别加入0、200、500 IU/mL的IL-2。在培养的第4天,向两种培养基中加入0、200、500 IU/mL的IL-2,并继续培养。每隔2~3 d补液1次。在培养的第0、3、6、9、12、15、18天于光学显微镜下观察CIK细胞的生长情况及形态变化,台盼蓝染色细胞计数(细胞总数=n/4×稀释倍数×104),并绘制生长曲线,计算各组细胞的扩增倍数(CIK细胞扩增前后的细胞总数,以后者除以前者)。
1.3 不同效靶比的CIK细胞对7721细胞杀伤效应观察 将7721细胞与第10天的CIK细胞共培养,调整癌细胞终浓度为5×104/mL。根据所需效靶比调整CIK细胞终浓度分别为0.5×106、1×106、2×106、4×106/mL。CIK细胞为效应细胞,7721细胞为靶细胞,按照效靶比10∶1、20∶1、40∶1、80∶1接种于96孔细胞培养板,并设置靶细胞对照组、效应细胞对照组、培养基对照组,每组3个复孔,各孔总体积均为200 μL。置入37 ℃、5%CO2培养箱中培养,72 h后每孔各加入20 μL的CCK8检测用试剂,继续培养2.5 h,可根据培养板孔内培养液的显色情况略微调整显色时间,然后对培养板中的细胞进行检测,酶标仪测OD450值,并计算杀伤率,杀伤率=[1-(实验组OD值-效应细胞对照组OD值)/靶细胞对照组OD值]×100%。
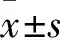
2 结果
2.1 不同培养基CIK细胞扩增倍数比较 结果见表1。

表1 不同培养基细胞扩增倍数比较
注:与1640培养基比较,*P<0.05。
2.2 不同效靶比CIK细胞杀伤率比较 效靶比为10∶1、20∶1、40∶1、80∶1时CIK的杀伤率分别为(7.0±2.0)%、(15.6±2.3)%、(36.4±5.4)%、(52.1±14.4)%,80∶1时的杀伤率与其他三者比较,P均<0.05。
3 讨论
近年来,肝癌的发生率仍居高不下且致死率高,为世界三大肿瘤之一[9]。我国是一个肝炎大国,虽然随着生活水平的不断提升,肝炎的患病率略有下降,但仍处于较高水平,且酒精性肝病和脂肪性肝病的发生率呈现逐年上升的趋势[10],这是导致肝癌高发生率的一个重要原因。由于肝癌早期症状并不明显,发现后多为中晚期,其治疗主要依靠手术和放化疗,而手术多不能根治性切除肿瘤,常残留微小病灶,放化疗则易加重患者心理负担和对患者机体的不良反应,并且术后容易复发,因此治疗难度加大[11]。对于不能手术的晚期肝癌患者来说,寻找有效的治疗方法更是迫在眉睫。
CIK细胞作用广泛,目前已逐步适用于临床并占有越来越重要的地位。据相关报道,CIK细胞可明显抑制肝癌细胞的生长,主要是通过上调凋亡相关基因的表达,促进人肝癌干细胞(HCSCs)的凋亡,从而发挥杀伤作用[12~14]。研究显示,CIK细胞对于肺癌、食管癌、胃癌、结肠癌、白血病等多种恶性肿瘤都能起到一定的疗效,且与树突状细胞(DC)联合作用时能力更强[15~17]。另外,CIK细胞免疫疗法联合化疗效果显著且能降低化疗所带来的不良反应[18~21]。相较于CIK细胞在临床上的广泛应用及治疗的肯定,如何在体外稳定的大量扩增CIK尚未有明确定论,这是目前亟待解决的问题之一,且能为CAR修饰的CIK细胞大量增殖治疗肝癌提供可靠保障。本研究显示,GT-T551培养基更有利于CIK细胞的生长繁殖,且CIK细胞的增殖对IL-2的作用具有浓度依赖性,也就是说IL-2浓度越大细胞扩增倍数及细胞数峰值也越大。由此可见,IL-2在细胞增殖过程中起着不可或缺的作用,一定范围内剂量越大作用越明显。当细胞生长12 d后,细胞数目基本达到最大值,并未继续增殖甚至略有下降,分析原因可能与细胞数目加大,培养基消耗过快,在培养瓶中细胞生长受限有关。在CIK细胞与7721细胞株的共培养中,随效靶比增加,杀伤率逐渐升高,在效靶比80∶1时CIK细胞对肝癌细胞的体外杀伤效应更明显。这与国内外[22,23]一些关于CIK细胞对肿瘤细胞的杀伤作用呈剂量依赖性的报导相一致。
总之,采用GT-T551培养基培养外周血源的CIK细胞,定期加入500 IU/mL的IL-2是一种更为优越的培养方案;在抑瘤方面,可以选择第10天的CIK,通过较高效靶比发挥高杀伤作用。

