产抗生素siomycin A放线菌株13-12抗菌活性探究及菌种鉴定
王 卫,王 彬,刘爱华,王 茜,邢朝斌,解云英,袁丽杰
(1.华北理工大学 基础医学院,河北省慢性疾病重点实验室,唐山市慢性病临床基础研究重点实验室,河北唐山 063210;2. 华北理工大学 公共卫生学院,河北唐山 063210;3.华北理工大学 生命科学学院,河北唐山 063210;4.中国医学科学院 北京协和医学院,医药生物技术研究所,北京 100050)
随着临床耐药菌株的不断出现,一些陈旧的抗生素效果大幅下降,寻找新的菌株、新的抗生素迫在眉睫[1]。如今人们所使用的抗生素绝大部分是放线菌和真菌产生的天然产物及其衍生物[2],目前所报道的来自放线菌抗生素大部分是由链霉菌属(Streptomyces)产生[3],其他菌属相对较少,但由于链霉菌这一放线菌的优势菌种被不断重复发现,排重困难,使得发现新抗生素的机率逐渐下降。
近年来从土壤环境中分离筛选产生新天然活性物质的放线菌日益困难,人们逐渐把目光投向之前较少研究的微生物特殊栖息环境如植物内部[4],希望采用该种方法,来探寻能产生新的代谢活性物质的放线菌。
在人类生存和发展的历史长河中,药用植物扮演着不可或缺的重要角色。做为药用植物的重要内生菌组成部分,内生放线菌广泛存在于其中,因其丰富的物种多样性使其在植物微生态系统中占据十分重要的地位。内生菌作为植物体的一部分与药用植物的“协同进化”关系决定了某些内生菌具有产生与宿主植物相同或相似生物活性的能力[5]。已有研究表明,从药用植物体内部筛选得到的放线菌产生的次级代谢物质具备多种生物活性。Zhao等[6]从美登木(MaytenushookeriLoes.)中筛选到的内生放线菌链霉菌Is9131(Streptomycessp. Is9131),从菌株的代谢产物中分离到dimeric nonactin和dimeric dinactin两种大环内酯类化合物,有较强的抗菌和抗肿瘤活性。一些分离自欧洲红豆杉(TaxusbaccataL.)中的内生放线菌菌株[7],能够产生紫杉烷类物质,该类物质对多种癌症具有良好的治疗效果。桑氏链霉菌Waksman (StreptomycessampsoniiWaksman)筛选自卫矛科植物内部,具备产生抗生素chloropyrrol的能力[8]。由此可见,从药用植物中来分离放线菌资源,并进一步从其中分离出与药用植物相类似作用的天然活性物质,除了可以避免传统药用植物的过度利用外,还能为研发新型药物奠定良好的基础。
刺五加(Acanthopanaxsenticosus)隶属于五加科(Araliaceae)五加属(Acanthopanax),是中国北方道地药材,具有抗菌、抗肿瘤等多种作用[9]。按照“协同进化”理论,刺五加植株内部也可能有可以产生类似活性物质的内生放线菌存在。为此,华北理工大学微生物资源课题组对刺五加内生放线菌资源进行挖掘,对其内生菌株抑菌活性初筛后,发现了具有较好抑菌活性的菌株13-12。本研究针对菌株13-12发酵液的抑菌活性及其稳定性进行评价,明确活性物质提取条件;通过PCR检测菌株13-12活性物质合成相关的功能基因;结合其形态、生理及分子特征对菌株进行鉴定。
1 材料与方法
1.1 菌 株
供试放线菌:放线菌13-12分离自野生刺五加根茎部。ISP2培养基斜面28 ℃培养7 d,4 ℃保存;φ=25%甘油管置于-80 ℃冰箱保藏。
供试检定菌:金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、铜绿假单胞菌(Pseudomonasaeruginosa)、大肠埃希菌(Escherichiacoli),草分枝杆菌(Mycobacteriumphei)、耻垢分枝杆菌(Mycobacteriumsmegmatis),白色念珠菌(Candidaalbicans),大肠埃希菌耐药菌株(E.coliATCC 35218)、金黄色葡萄球菌耐药菌株(MRSA12-1、MRSA ATCC43300)。检定菌由中国医学科学院北京协和医学院,医药生物技术研究所解云英副研究员、孙承航研究员提供。
将供试检定菌接种于Nutrient agar培养基,置于37 ℃恒温箱培养1 d,其中耻垢分枝杆菌置于35 ℃,白色念珠菌置于28 ℃,待培养良好后用φ=25%的甘油溶液将其吹打制成菌悬液备用。
1.2 菌株发酵液制备
菌株13-12接种于ISP2培养基上28 ℃活化7 d后,转接至液体发酵培养基中,培养基组分:可溶性淀粉20.0 g、葡萄糖5.0 g、蛋白胨5.0 g,酵母膏5.0 g,牛肉膏5.0 g,黄豆饼粉10.0 g,玉米浆4.0 g,CaCO34.0g,CoCl2(w=0.02%) 1.0 mL、去离子水1 L,调整最终pH至7.2;装液量为三角烧瓶体积的1/5;28 ℃、180 r/min振荡培养5 d;将发酵产物4 000 r/min离心10 min,取上清液备用。
1.3 抗菌活性试验
抑菌谱测定采用平板纸片法[10],对供试放线菌13-12的发酵液进行抑菌活性测定。将检定菌菌悬液用生理盐水分别对各指示菌菌液进行梯度稀释,稀释约为 1×108cfu/mL,取上述各种菌悬液 0.1 mL于无菌平皿中,然后倒入已冷却至 55 ℃的高压灭菌后的培养基15 mL,充分混匀在适当位置贴上己灭菌的滤纸片(Φ=5 mm),然后分别吸取发酵液30 μL置于滤纸片上,同时以发酵培养基作阴性对照。将不同带菌平板置于37 ℃恒温培养箱(白色念珠菌置于28 ℃、耻垢分枝杆菌置于35 ℃) 18~24 h。重复3次,抑菌圈直径采用十字交叉法进行测量。
1.4 发酵液稳定性试验
根据抑菌谱测定结果选定供试检定菌,测定发酵液稳定性。以未处理的发酵液原液为对照,分别测定发酵液在不同光照时间(室温光照条件下放置24、48、72、96 h),温度(将发酵液于4、20、40、60、80 ℃分别处理2 h,冷却至室温)及酸碱(将发酵液分别调pH到2、4、6、8、10,4 ℃放置8 h 后再回调到原始pH)条件下抑菌圈直径,各处理重复3次。
1.5 功能基因研究
采用Chelex-100法来提取基因组DNA[11],作为功能基因检测及16S rRNA序列扩增模板,-20 ℃保存。
次级代谢产物合成的相关功能基因片段的扩增引物参照不同文献[Ⅰ型聚酮酶基因(PKSⅠ)[12]、Ⅱ型聚酮酶基因(PKSⅡ)[12]、非核糖体肽合成酶基因(NRPS)[13]、卤化酶基因(Halo)[14]、细胞色素酶基因(CYP)[14]],扩增产物利用的琼脂糖凝胶(10 g/L)电泳检测,电压110 V,30 min。
将PCR产物电泳选择阳性功能基因片段切胶回收,与pGM-T载体连接、转化、筛选、挑取单克隆,37 ℃振荡培养3 h后进行菌液PCR鉴定,选择阳性克隆扩大培养,提取质粒后送至北京赛默飞世尔科技有限公司进行测序。
登录NCBI官网(http://www.ncbi.nlm.nih.gov/tools/vecscreen/),使用VecScreen程序去除测序中载体序列;使用DNAMAN 8.0软件将目的核酸序列转换为氨基酸序列;最后利用BLAS Tp程序进行氨基酸序列同源性比对。
1.6 菌株鉴定
形态学观察用ISP3培养基于28 ℃条件下进行埋片培养[15],分别培养7、14、21 d后取出埋片,利用光学显微镜(BX-53; Olympus)观察基内菌丝,气生菌丝的形态特征,扫描电镜(model S-4800; Hitachi)观察菌株孢子形态特征。
培养特征观察参照国际链霉菌计划进行[16]。选用培养基ISP2、ISP3、ISP4、ISP5、ISP7、察氏琼脂、马铃薯浸汁琼脂、营养琼脂接种,28 ℃培养7、14、21、28 d后分别观察记录基内菌丝、气生菌丝的生长情况及可溶性色素。
生理生化特征测定试验方法参照文献[17]。温度(4、10、15、23、28、37 和 45 ℃)、 pH 5.0~11.5 (间隔为0.5)、盐耐受(质量分数0、1%、2%、3%、5%、7%、10%、15%、20%)均以ISP2为基础培养基。通过3% H2O2产生气泡作为过氧化氢酶活性的阳性判定[18];纤维素水解所用基础培养基依据文献[19]配置;利用北京陆桥微生物生化微量鉴定管获得唯一碳源及酶特性指标。
16S rRNA序列测定及分析:扩增引物PA(5′-AGAGTTTGATCCTGGCTCAG-3′);PB(5′-AAGGAGGTGATCCAGCCGCA-3′)。扩增条件:预变性95 ℃、5 min,变性95 ℃、1 min,退火54 ℃、45 s,延伸72 ℃、1.5 min,35个循环;72 ℃ 延伸10 min。产物测序由上海英潍捷基生物公司进行。依据测序结果,在EzTaxon database(http://eztaxon-e. ezbiocloud.net/)[20]核酸数据库中进行13-12菌株16S rRNA基因序列比对。选取相似性较高菌株序列,用ClustalX[21]和MEGA5.0[22]软件包采用邻接法(Neighbor-Joining method)[23]进行聚类分析系统进化树构建,拓扑结构稳定性分析采用1 000 次重复取样。
2 结果与分析
2.1 菌株13-12抗菌活性
菌株13-12发酵液对枯草芽孢杆菌、草分枝杆菌有较好的抑菌活性,抑菌圈直径达18~20 mm,对金黄色葡萄球菌以及耐药菌株MRSA12-1、MRSA43300有一定的抑制作用,对于大肠埃希菌、铜绿假单胞菌以及耻垢分支杆菌没有明显的抑菌活性(表1)。
2.2 放线菌13-12菌株发酵液稳定性
将菌株13-12发酵液放置在室温条件下光照处理24、48、72、96 h,结果表明:处理24 h发酵液抑菌活性基本没有变化;处理48、72、96 h抑菌活性均出现明显降低(图1-A)。发酵液中一些活性物质在室温光照条件下可能分解或发生结构上的改变。因此,在对发酵液活性物质分离提取过程中应避免长时间暴露在室温光照条件下,最好避光。
如图(1-B)所示,发酵液在4 ℃与20 ℃抑菌活性稳定,随着温度的升高发酵液的抑菌活性出现降低。发酵液经40 ℃处理2 h后,其对枯草芽孢杆菌的抑制作用(16.00 mm)较20 ℃条件下(16.53 mm)没有明显变化,对其他检定菌的抑制作用均有不同程度降低。当温度达到80 ℃发酵液对金黄色葡萄球菌抑制作用几乎消失,说明发酵液中活性物质在温度条件达到40 ℃以上时可能出现结构变化,抑菌活性降低。因此,在分离提纯发酵液中活性物质时,需将温度控制在4~20 ℃为宜。
如图(1-C),发酵液收获时pH为7.7(control=7.7),总体来看菌株12发酵液在pH为6~8时较未处理的对照组抑菌活性变化幅度较小,当pH为2与10时抑菌活性降幅较明显。其中发酵液在pH在2~10条件下对草分枝杆菌的抑制活性却较为稳定。说明应将pH控制在6~8对于发酵液中活性物质分离纯化最有利。

表1 菌株13-12发酵液抑菌活性Table 1 Antibacterial activity of fermentation
2.3 菌株13-12功能基因
菌株功能基因PCR扩增结果见图2,分别得到NRPS基因及Halo基因扩增产物。克隆测序得到菌株13-12的NRPS基因长度为732 bp,共编码氨基酸243个,经BLASTp比对与数据库(Genbank)中奇迹束丝放线菌(Actinosynnemamirum)和橄榄产色链霉菌(Streptomycesolivochromogenes)非核糖体肽合成酶(NRPS)同源性最高,达63%(表2);Halo基因序列长度为560 bp,编码185个氨基酸,经BLASTp比对与Genbank数据库中球形浮游动单胞菌(Planomonosporasphaerica)的卤化酶(Halo)同源性最高,达98%(表3)。

图1 菌株13-12发酵液在不同条件下抑菌活性变化Fig.1 Stability of fermentation broths of 13-12 under the different condition
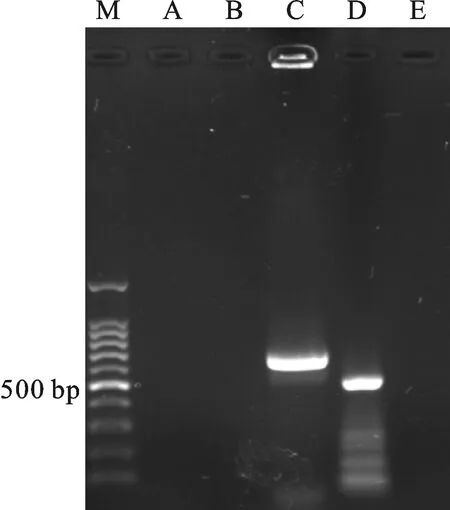
M.100 bp DNA ladder; A.PKSⅠ; B.PKSⅡ; C.NRPS; D.Halo; E.CYP
图2菌株13-12功能基因电泳图
Fig.2Electrophoregramofstrain13-12functionalgenes
2.4 菌株13-12分类鉴定
2.4.1 菌株13-12形态特征 菌株13-12在ISP2培养基上生长状态良好,菌落表面干燥呈现橘红色(图3)。通过光学显微镜和扫描电镜观察发现其基内菌丝丰富,分枝不规则,菌丝生长连续无断裂(图4)。气生菌丝发育良好,在气生菌丝上产生有孢囊柄,柱状孢囊成簇状排列在孢囊柄上(图5)。
2.4.2 菌株13-12培养特征 菌株13-12在不同培养基表现出不同的培养特征,在ISP2、ISP3、马铃薯浸汁琼脂以及营养琼脂培养基中生长良好,基内菌丝丰富,基内菌丝通常是乳白色至淡粉色或淡橙色。在ISP2、ISP3和葡萄糖-天冬酰胺琼脂等培养基上出现少量白色气生菌丝,在少数供试培养基上可以产生可溶性色素,具体培养特征情况见表4。

表2 菌株13-12NRPS 基因比对结果Table 2 Homogeneous comparing of itsNRPS amino acids sequencies

表3 菌株13-12Halo 基因比对结果Table 3 Homogeneous comparing of its halogenase amino acids sequencies

图3 13-12在ISP2培养基上的生长状况Fig.3 Cultural of strain 13-12 on ISP2 media

图4 菌株13-12扫描电镜基内菌丝Fig.4 Substrate mycelium of Strain13-12 on ISP3 Medium scanned by SEM
2.4.3 生理生化特征 菌株13-12在pH 6.5~8.0的条件下均可生长,其生长最适pH为7.5~8.0;生长温度范围为15~45 ℃,当温度为28 ℃时生长状态最好,在37~45 ℃生长能力减弱较为明显;菌株13-12在NaCl质量分数小于等于1%的培养基上生长;菌株能够使明胶液化、淀粉水解、纤维素水解;不能使牛奶凝固,脲酶及氧化酶阴性等;能够以葡萄糖、果糖、肌醇、乳糖等为碳源生长;所测试氮源中能够利用酪蛋白、L-谷氨酸、L-甲硫氨酸、L-丙氨酸、DL-丙氨酸等;生理生化特征见表5。

图5 菌株13-12扫描电子显微镜Fig.5 Aerial hyphae of Strain13-12 on ISP3 Medium scanned by SEM
2.4.4 16S rRNA序列测定结果 测得菌株13-12 16Sr RNA序列全长1 398 bp,在EzTaxon database核酸数据库比对,发现菌株13-12与Planomonospora属菌株高度相关,是Planomonospora的成员。选取序列比对率较高的菌株,利用MEGA5.0分析构建的系统进化树上(图6),菌株13-12与Planomonospora属的典型菌株PlanomonosporasphaericaJCM 9374T以极高的基因序列相似性(99.5%)聚于一个系统进化分支上。结合形态、生理特征以及系统发育树分类鉴定结果,初步将菌株13-12鉴定为Planomonosporasphaerica一个菌株。
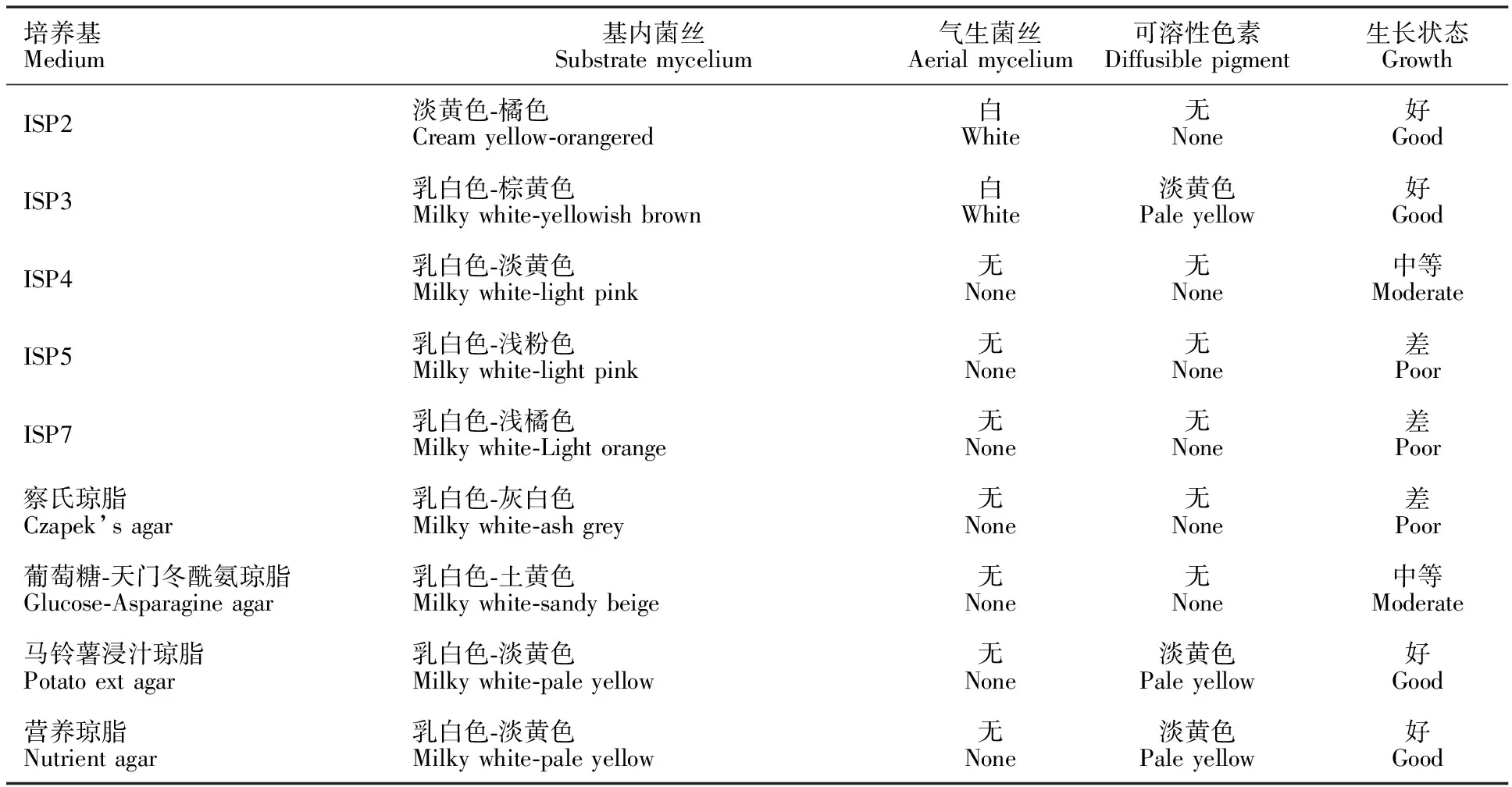
表4 菌株13-12的培养特征Table 4 The cultural characteristics of 13-12 on different media

表5 菌株13-12生理生化特征Table 5 Physiological and biochemical characteristics of strain 13-12
注:“+”阳性生长,“-”阴性。
Note:“+” positive,“-” negative.
3 讨 论
放线菌是天然活性产物的主要来源,目前约有2/3的抗生素来源于放线菌,并被人们开发用于医学、农业病害防治和环境保护等方面。因此,针对具有良好生物活性的菌株进行系统研究,对于深入挖掘其有效成分具有重要指导意义。研究结果显示,菌株13-12发酵液主要对革兰氏阳性菌表现出较好的抑制活性。在室温、避光及 pH6~8范围内发酵液活性较稳定。
目前,科研人员分析放线菌全基因组序列测定结果发现,次级代谢产物合成相关基因呈现特殊的相似性及多样性,因此,基于特殊基因的一致性开展活性产物筛选成为放线菌活性物质筛选的重要手段。

图6 菌株13-12系统发育树Fig.6 The phylogenetic tree of strain 13-12 based on 16S rRNA complete sequences
这种方法一方面可以探究菌株是否可以产生特定的生物活性物质;另一方面也可以在基因水平上衡量其产生生物活性物质的潜能。在目前已知的放线菌相关功能基因中,NRPS基因是负责非核糖体肽生物合成的主要酶基因,常作为菌株产生新颖结构活性化合物的指示。关于Halo基因,学者发现卤化酶催化的卤化作用在抗生素生物合成途径中起着重要作用[24],可极大提高代谢产物的抑菌活性。放线菌菌株13-12含有NRPS基因和Halo基因。在NRPS氨基酸序列比对中,与其同源性最高的是比对为63%的奇迹束丝放线菌(Actinosynnemamirum)和橄榄产色链霉菌(Streptomycesolivochromogenes)。奇迹束丝放线菌已报道可产生β-内酰胺类抗生素诺卡菌素A(nocardicin A),其对革兰氏阴性菌有一定抗菌活性[25]。此类抗生素是临床最常用的抗感染药物[26]。与菌株13-12 NRPS 氨基酸序列相似性为62%的网状链霉菌(Streptomycesreticuli)可产生大环内脂类抗生素白霉素(leucomycin)[27]。菌株13-12 Halo氨基酸序列与异壁链霉菌属ATCC 53650(Streptoalloteichussp. ATCC 53650)卤化酶氨基酸序列相似性达78%,可以合成具有抗肿瘤活性的抗生素可达菌素(kedarcidin),可达菌素同时对革兰氏阳性菌有很强的抑菌活性[28];与球形浮游动单胞菌(Planomonosporasphaerica)色氨酸卤化酶氨基酸序列同源性高达98%,球形浮游动单胞菌产生硫肽类化合物硫链丝菌素[29](thiostrepton)已被美国食品药品监督管理局批准用于清除动物肠道寄生菌[30]。由此可见,菌株13-12可能具有产生β-内酰胺类抗生素、大环内脂类抗生素、可达菌素以及硫链丝菌素等多类抗菌抗肿瘤活性物质或其相似产物的潜能。
本研究通过形态特征、培养特征、生理生化及16S rRNA系统分析等方法对菌株13-12进行菌株鉴定。菌株13-12属于游动单胞菌属(Planomonospora)有效发表种球形浮游动单胞菌JCM 9374T的一个菌株,目前该菌种尚未有在刺五加药材中分离到的报道。游动单胞菌属(Planomonospora)属于链孢囊菌科(Streptosporangiaceae),该属已发表标准菌株有5个种和2个亚种,包括巴龙特孢浮游单胞菌巴龙特亚种(P.parontosporasubsp.parontospora)[31],巴龙特孢浮游单胞菌抗生素亚种(P.parontosporasubsp.antibiotica)[32],委内瑞拉浮游单胞菌(P.venezuelensis)[33],阿尔巴浮游单胞菌(P.alba),球形浮游动单胞菌(P.sphaerica)[29]和珊瑚藻游动单胞菌(P.coralline)[34]。目前该属已报道产生抗生素的菌株有分离自土壤的巴龙特孢浮游单胞菌抗生素亚种,可产生酯肽类抗生素孢囊霉素(sporangiomycin)[32],对革兰氏阳性菌具有较好的抑菌活性。还有菌株阿尔巴浮游单胞菌(P.alba),产生羊毛硫细菌素类抗菌肽planosporicin[35],可干扰革兰氏阳性菌细胞壁代谢,克服现有的细菌耐药机制,是很具前景的现有抗生素替代物[36]。羊毛硫细菌素类抗菌肽已应用于作为食品添加剂以及对抗痤疮丙酸杆菌(PropionibacteriumAcnes)和耐甲氧西林金黄色葡萄球菌(MRSA)并表现出了其有效性和实用性[37]。P.sphaerica分离自土壤,产生硫链丝菌素(thiostrepton),据报道硫链丝菌素及其衍生物是目前发现的唯一一类能够主动作用于宿主细胞和胞内寄生菌,并在杀灭病原菌的同时提高宿主免疫防御能力的抗生素[30]。
在上述实验研究基础上,华北理工大学微生物资源课题组已从菌株13-12中分离到硫肽类抗生素盐窝霉素A(siomycin A)[38]。关于盐窝霉素A作为FoxMl的抑制剂的研究一直备受关注。盐窝霉素A特异性的作用于在FoxMl[39],FoxMl是叉头框转录因子(Forkhead box)家族的一个转录因子,在多种不同的恶性肿瘤组织中均存在高表达[40],与肿瘤的发生发展密切相关,成为肿瘤治疗一个药物新靶标。最近研究表明,盐窝霉素A能有效抑制胸腺癌、肺腺癌等细胞的生长[41]。因此,盐窝霉素A很有可能成为新的抗癌药物。菌株13-12作为盐窝霉素A的产生菌具有较高研究开发价值和应用潜力。另外,根据菌株13-12功能基因检测及发酵液稳定性探究,推测菌株13-12可能还有其他活性产物未得到分离,目前后续产物分离纯化工作正在进行中。
因此,对菌株基本生理特点及活性产物稳定性的系统研究,可为菌株次级代谢产物的分离纯化确定合适的条件,为深入挖掘稳定性良好的活性成分提供优良菌源,为刺五加内生放线菌资源的开发利用提供依据。同时,野生刺五加属于我国濒危药用植物,本研究筛选得到的菌株,所产生的次级代谢产物与宿主植物部分药效相似,可为刺五加生长缓慢、资源紧缺等引起的药源匮乏和生态破坏问题提供新出路,对濒危植物资源的保护具有重要意义。

