参附注射液对血管性痴呆大鼠空间学习记忆功能和海马组织病理学改变的作用*
李乃选 刘红霞 潘 虹 施 真 于腊梅
1滨州医学院烟台附属医院介入血管科 烟台 264100;2 滨州医学院基础医学院生理学教研室
随着人口老龄化的加剧,年龄相关性疾病的发病率和患病人数逐年增高。世界卫生组织预测,到2050年,全世界痴呆的人数将超过1亿。血管性痴呆(vascular dementia,VD)是继阿尔茨海默病(Alzheimer’s disease,AD)后的第二种非常常见的引起痴呆的疾病,大约占痴呆发病率的15%[1]。VD是由多种脑血管异常,如低灌注、缺氧、缺血、休克等引起的一种不可逆状态,主要表现为进行性认知障碍、记忆丧失以及思维和语言的障碍等。目前尚未发现控制VD病程进展的理想方法和药物。
参附注射液(Shenfu injection,SF)是根据南宋名医陈自明《妇人良方》中的“参附汤”(人参、附子)加工提炼而成,主要成分为人参皂苷和乌头类生物碱,两者协同具有更优的回阳救逆、益气固脱的功效[2]。目前该药已在临床用于对包括脑、肝、心脏、胆道等多个器官、组织的缺血再灌注损伤进行保护性治疗,并得出了较好的效果[3-6]。但至今为止SF对VD组织病理学改变及学习记忆功能的影响报道较少,其保护机制还有待更进一步的研究。本实验拟探讨SF对慢性VD大鼠学习记忆功能等脑保护作用及其机制,为临床VD的防治提供理论依据和新的药物靶点。
1 材料与方法
1.1 实验动物和药品 实验用健康雄性Sprague-Dawley(SD)大鼠54只,SPF级,每只体质量为200~250 g,购于山东绿叶天然药物研究开发有限公司,实验动物许可证号:SCXK(鲁)20090009。所有动物自由进食标准饲料与水,所有动物实验符合动物实验伦理规范。参附注射液购于华润三九药业有限公司(规格:10 mL/支,批号: 15120401001)。
1.2 实验方法
1.2.1 动物分组 取健康雄性SD大鼠54只,随机分为三组,A组假手术组;B组模型组;C组药物组。每组再按缺血后再灌注时间点不同分为再灌注7、15 d、1月,每亚组各6只。
1.2.2 造模及给药方法 造模采用双侧颈总动脉反复夹闭再通+硝普钠降压法[7]。用10%水合氯醛溶液(350 mg/kg)腹腔麻醉成功后,立即取仰卧位固定于实验操作台上,颈部备皮,75%酒精常规消毒,采用颈部正中切口,分离两侧颈总动脉,穿线备用;腹腔注射0.25 mg/mL硝普钠溶液10 mL/kg,使用无创动脉夹先夹闭双侧颈总动脉 10 min,再开放 10 min,然后再夹闭10 min,再通;再通后在手术切口撒上适量青霉素粉末,逐层缝合切口,造模完毕。A组麻醉与手术过程与模型组、药物组相同,但不阻断双侧颈总动脉,不注射硝普钠。C组于造模后当天开始至术后相应的时间点每日经腹腔注射参附注射液,剂量为10 mL/kg。
1.2.3 Morris水迷宫试验 Morris水迷宫由自制的圆柱形水池、可移动位置的平台以及排注水系统组成[8]。水池高65 cm,直径为160 cm,平台高35 cm,直径为10 cm,实验中注水深度没过平台1.5 cm。水池内壁,底面和平台均漆成黑色,实验中用无毒墨汁将水染成黑色使平台不可见。标记在平台外侧的四个等距离点把水池分为四个象限,平台置于其中一个象限的中线上,距池壁20 cm。测试期间迷宫外各参照物及实验者位置保持一致,水温控制在(25±2)℃。
实验前1 d将大鼠放入水池中(不含平台)自由游泳2 min,使其熟悉环境。实验时以水池壁上的4个标记A、B、C、D处为入水点,每次实验时依次由该4个入水点将大鼠朝向池壁轻轻放入水中。记录大鼠从入水到四肢全部登上平台所消耗的时间作为逃逸潜伏期(escape latency,EL),如果大鼠找到隐匿平台让其在平台上停留15 s,再将其取出放在笼中休息。若动物2 min内尚未找到平台,则将动物引导至平台并使它在上面停留15 s,放回笼中,潜伏期记为120 s。水迷宫测试在造模后不同时间点进行,以观察药物疗效。每次测试所有大鼠从1个标记处入水1回为1轮,每次4轮,每轮之间休息15 min,每天上、下午各1次,连续测试3 d (共计6次),比较各组EL的长短。
1.2.4 取材及组织病理学检测 在相应的时间点水迷宫试验结束后,各组大鼠经10%水合氯醛(400 mg/kg,腹腔注射)深度麻醉后,迅速开胸暴露心脏,4℃ 预冷4%多聚甲醛灌注,断头剥离海马组织,固定脱水包埋切片,切片厚度为5 μm, 进行HE染色和Nissl染色,光镜下观察神经元损伤情况并拍照,照片放大倍数为物镜×目镜。另大鼠灌注固定后参照脑立体定位图谱选取海马CA1区,选取标本进行电镜标本制备,透射电镜观察此脑区超微结构变化。
2 结果
2.1 一般情况观察 大鼠在造模术中,腹腔注射硝普钠后夹闭双侧颈总动脉时可见大鼠口唇发绀,而四肢末端无明显发绀,脑电图在缺血期间呈现一条直线,提示大鼠脑部缺血。造模术后存活的大鼠多数表现为行动迟缓、活动减少、眼裂变小、精神萎靡、反应迟钝、毛发无光、进食减少、体重下降,这些症状多在72 h后逐渐减轻。假手术组大鼠无明显变化。各组大鼠均无明显肢体瘫痪。
2.2 Morris水迷宫试验检测 通过Morris水迷宫检测发现,VD大鼠逃逸潜伏期在各个时间节点均较假手术组明显著延长 (7 d组:P<0.01; 15 d组:P<0.001;1 月组:P<0.001),说明各模型组大鼠的空间学习、记忆能力显著下降,造模成功。模型组各时间点比较,各组间EL值差异有统计学意义(P<0.001),提示随着造模时间的延长,大鼠学习记忆能力逐渐下降,痴呆程度逐渐加剧。经SF治疗后,大鼠逃逸潜伏期与相应时间点的模型组相比明显缩短。其中7 d和1月组EL值与模型组比较存在明显差异(7 d组:P<0.05;1月组:P<0.05),但时间仍长于假手术组(7 d组:P<0.01;1月组:P<0.001)。药物组内各时间点比较,EL值差异有统计学意义(F=10.667,P=0.001)。
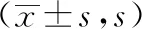
表1 各组大鼠Morris水迷宫EL值比较
注:与假手术组比较,*P≤0.05,**P≤0.01,***P≤0.001;与模型组比较,#P≤0.05;同组各时间点比较,▲P≤0.05;与7d组比较,▲▲P≤0.01,▲▲▲P≤0.001;与15d组比较,★P≤0.05。
2.3 HE染色 图1所示从左到右依次为假手术组、模型组和药物组(SF);从上到下依次为7 d亚组、15 d亚组和1月亚组。模型7 d组大鼠海马CA1区锥体细胞层次减少,排列稀疏,神经细胞肿胀,细胞间隙增大,细胞核体积变小,深染,结构不清,呈核固缩表现,神经纤维排列紊乱(图1B)。模型15 d组海马CAl区锥体细胞排列进一步稀疏、紊乱,细胞核固缩为三角形或多角形,脱失现象较明显(图1E)。模型1月组海马CA1区细胞严重脱失,胶质细胞明显增生(图1H)。药物组较相应时间点的模型组有明显改善。锥体细胞水肿略减轻,但锥体细胞排列紊乱,核固缩仍明显,部分见神经纤维缺失(图1C、F、I)。
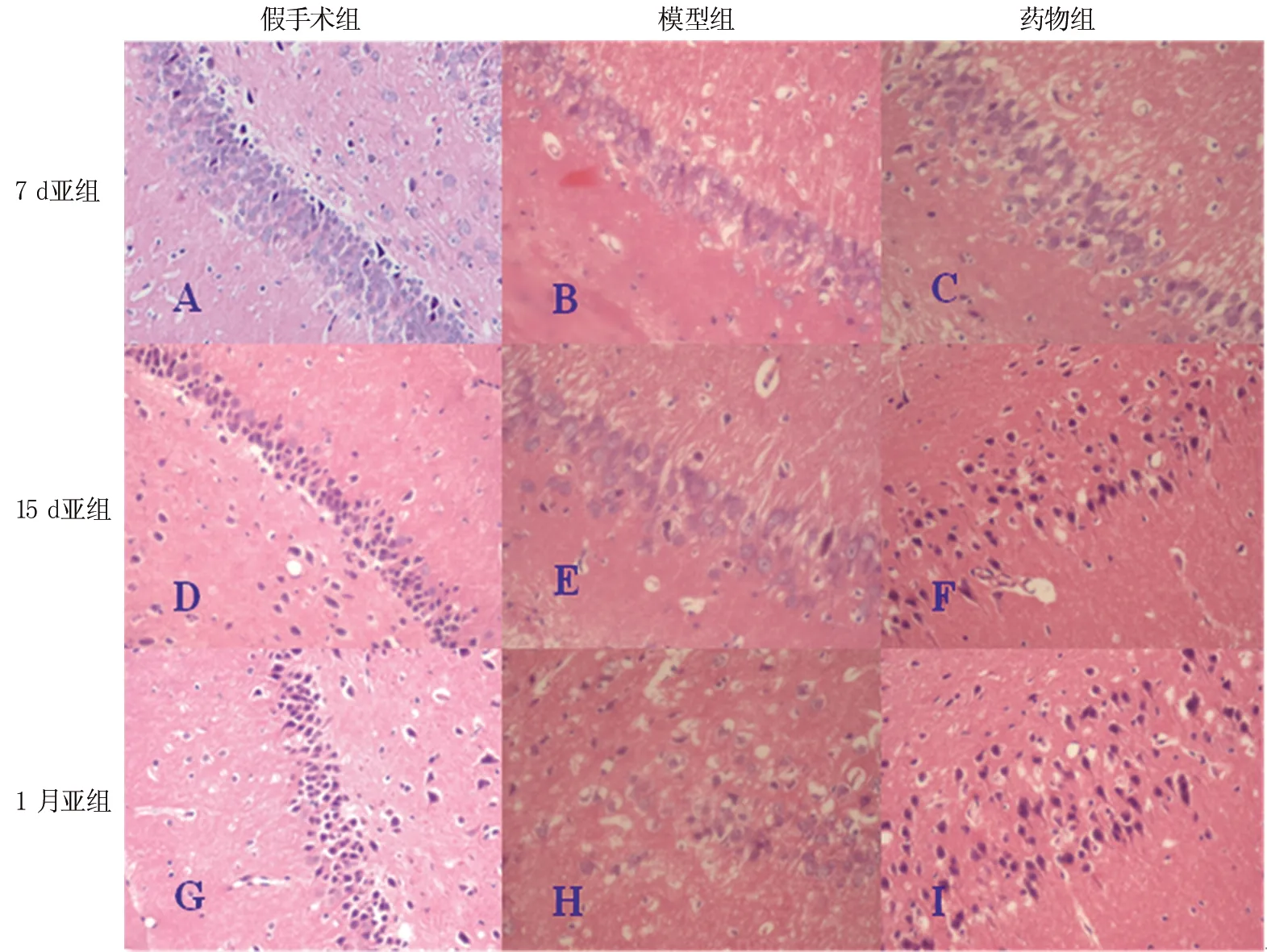
图1 各组大鼠HE染色 (×400倍)
2.4 Nissl染色 图2所示从左到右依次为假手术组、模型组和药物组(SF);从上到下依次为7 d亚组、15 d亚组和1 m亚组。 假手术组各时间点大鼠海马CA1区锥体细胞及其顶树突排列整齐且密集,胞浆中尼氏体(粗面内质网的核糖体)分布均匀、丰富、颗粒状、染色深(图2A、D、G)。模型组各时间点大鼠海马CA1区锥体细胞排列稀疏,细胞间隙增大,其顶树突缩短甚至消失,可见到陷空细胞,锥体细胞层有大片细胞缺失。许多锥体细胞胞浆内尼氏体边集、减少甚至消失,部分神经元内出现小空泡(图2B、E、H),模型组从7 d~1月组损伤逐渐加重。药物组各时间点较相应时间点的模型组有所改善,大鼠海马CA1区锥体细胞及其顶树突排列尚整齐、密集,胞浆中尼氏体增多,损伤程度减轻(图2C、F、I)。
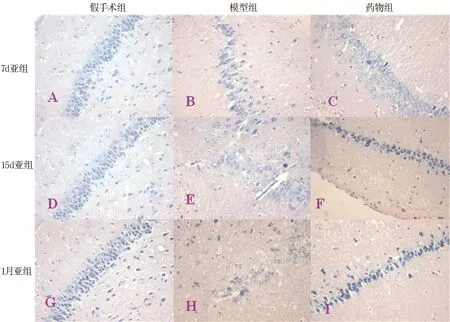
图2 各组大鼠Nissl染色 (×400倍)
2.5 电镜检测 图3所示从左到右依次为1月时间点的假手术组、模型组和药物组(SF)。假手术组突触结构完整清晰,突触前膜内可见大量清亮的突触小泡。模型组突触前膜的完整性破坏,部分区域断裂、模糊,前膜内突触小泡数量明显减少,突触数目减少。SF治疗后突触数目有所增加,突触的完整性得到大幅度改善,突触前膜内可见较多的突触小泡。

图3 各组大鼠海马组织超微结构 (1月)
3 讨论
VD是指因多次脑卒中或长期慢性脑缺血等脑血管因素造成脑组织损害,导致大脑功能全面衰退的综合征,主要表现为学习记忆和认知能力减退、情绪改变与行为障碍等。多年来,人们对VD进行了大量的研究,包括其发病的危险因素、发生机制、诊断和治疗等。很多学者认为脑缺血/再灌注和长期慢性脑灌注不足损伤了中枢神经系统是VD发病的主要原因,已形成了许多假说,如脑内能量代谢障碍学说,兴奋性递质的兴奋毒性学说,细胞内Ca2+超载学说,自由基代谢紊乱学说,NO细胞毒学说,细胞内酸中毒学说,神经免疫机制等。目前认为,VD的发生发展可能是一个多种致病因素、多个病理环节相互作用和累积的结果,病程是一个多靶点、多层次、多途径的动态演变过程,脑缺血/再灌注时,它们互为因果,形成恶性循环,最终导致神经元坏死。但迄今为止,确切的VD发病机制尚不清楚。
目前大鼠是制备VD模型最常用的动物。常用的模型主要有大脑中动脉栓塞(MCAO)模型、多发性脑梗塞痴呆(MID)模型、四血管阻断全脑缺血模型(4-VO)、双侧颈总动脉结扎模型(2-VO)、脑缺血再灌注结合降压模型、脑缺血再灌注结合失血模型、卒中倾向高血压大鼠致痴呆模型等。不同的模型适用于不同病因诱发痴呆的研究。虽然动物模型较多,但国际上还没有一个公认的理想的VD模型。本实验采用的是双侧颈总动脉反复夹闭再通+硝普钠降压法[7-8](即脑缺血再灌注结合降压模型)。该方法可导致进行性的学习记忆功能障碍,较好较全面地模拟了人类的血管性痴呆的实际发病情况,又没有明显的肢体运动障碍,同时手术操作简单,无需开颅,术后不影响动物进食,动物死亡率低,可长期存活,可以较好的模拟人类的VD。大鼠脑缺血后,其脑血流的变化是一个先剧烈下降(造模后一周内)而后逐渐缓慢恢复的过程,造模1个月后,损伤组大鼠脑血流已经达到对照组的2/3,8周后,损伤组大鼠脑血流只轻度低于对照组[9], 造模6个月后,损伤大鼠脑血流已经与对照组无差别[10]。本实验观察了大鼠脑缺血后7、15 d和1月时间点的变化,发现,在这些时间点大鼠的脑损伤呈进行性变化,至于其脑血流的变化将在以后的实验中进一步观察。
智能障碍是VD的主要症状之一,其中学习记忆能力减退在VD患者尤为显著。Morris水迷宫实验[11](Morris water maze test,Rachard Morris,1981)是80年代初建立起来的判断动物空间学习记忆能力的重要实验方法,已被证实是一种在研究学习和记忆机理方面非常有用的工具,成为一种研究空间学习和记忆的标准模式。本实验通过检测大鼠逃逸潜伏期的长短,反映大鼠的空间学习记忆功能。大鼠空间学习记忆能力越好,其逃避潜伏期越短;反之亦然。在本实验中,模型组大鼠与假手术组比较,逃逸潜伏期明显延长(P<0.01),表明学习记忆能力较差,出现显著的学习记忆功能障碍,说明造模成功。Morris水迷宫测试的平台位置与大鼠位置、状态无关,是一种异我为参照点的空间参考记忆,属于陈述性记忆,而临床健忘和痴呆的病人,正是陈述性记忆首先受损比较突出[12]。
脑慢性缺血后最明显的神经损伤是神经细胞体和突触连接的减少。本实验利用HE染色、尼氏染色和透射电镜观察了假手术组和模型组大鼠海马CA1区神经细胞的变化,结果发现:在脑慢性缺血7、15 d和1月后,海马CA1区锥体细胞层次减少,排列稀疏,神经细胞肿胀,细胞间隙增大,细胞核体积变小,深染,结构不清,呈核固缩表现,脱失现象严重。许多锥体细胞胞浆内尼氏体边集、减少甚至消失,部分神经元内出现小空泡,神经纤维排列紊乱,并且损伤程度随时间延长呈进行性加重。突触的完整性破坏,部分区域断裂、模糊,前膜内突触小泡数量明显减少,突触数目减少。这与既往的文献报道一致,双侧颈总动脉结扎2、4、8~13周后分别有6%~29%、55%、67%的动物的海马区出现神经细胞数量减少[9-10]。
VD主要与缺血性脑血管病有关,长期慢性脑缺血是VD形成的最重要因素之一。近年来,中药对脑缺血或脑缺血再灌注损伤的保护作用研究较多,但并未实现临床疗效的根本突破。SF已在临床用于保护多个器官组织的缺血再灌注损伤,并得到了较好的效果。文献报道在脑缺血再灌注损伤模型中,SF能减少脑组织MDA水平和提高SOD和谷胱甘肽(GSH)表达,减轻脑组织神经元变性程度,降低梗死面积[13];SF还能提高Nrf2蛋白的表达,并调节下游蛋白血红素加氧酶1和醌氧化还原酶1的表达,发挥抗氧化作用[14]。对于VD,SF下调凋亡相关基因 Bax 和 Caspase-3 的表达,上调抗凋亡基因 Bcl-2 水平,发挥抗海马神经元凋亡作用,改善 VaD 大鼠学习记忆能力[15-16]。
本实验观察了SF对VD大鼠空间学习记忆功能的影响。SF药物组大鼠逃逸潜伏期与相应时间点的模型组相比明显缩短(P﹤0.05),但时间仍长于假手术组(P﹤0.01),说明SF能从一定程度上改善大鼠的空间学习记忆功能。利用HE染色、尼氏染色和透射电镜观察模型组和SF治疗组大鼠海马CA1区神经细胞的变化,结果发现:大鼠海马CA1区锥体细胞数较相应时间点的模型组增多,锥体细胞水肿减轻,神经纤维排列仍紊乱,胞浆中尼氏体逐渐增多,突触的完整性得到改善,突触前膜内可见较多的小泡,损伤程度较模型组减轻。这些都体现了SF对痴呆后海马CA1区的保护作用。海马是大脑学习记忆的关键脑区之一,又是最易受缺血、衰老等因素影响的脑区之一。SF能改善大鼠的空间学习记忆功能,减少脑缺血大鼠海马CA1区神经细胞的凋亡,同时还能增加海马CA1区锥体细胞粗面内质网中核糖体(尼氏体)的数量,增加细胞突触的表达。核糖体是合成蛋白质的场所,核糖体数量增加就预示着蛋白质合成的增加,这将为该区脑组织的恢复提供足够的能量供应,加速海马CA1区锥体细胞的复原,这也是SF发挥其脑保护作用、改善痴呆后学习记忆功能的分子机制之一。
综上所述,本实验发现SF能在一定程度上减少VD大鼠海马组织病理损害和神经元丢失,改善VD大鼠空间学习记忆功能,从而改善大鼠的痴呆症状。但是关于其进一步具体机制的研究还需更深入的工作。众所周知,突触可塑性是学习记忆的神经生物学基础。脑缺血或再灌注后海马突触可塑性与学习记忆障碍的关系非常密切。所以下一步的工作计划将是对其具体机制的研究,尤其是与突触及突触可塑性相关机制的研究将作为工作的重点内容。

