运动防治阿霉素诱导的心肌损伤的证据和未来方向
孙忠广 卢果 赵淋淋 郑笑慈 刘文滢 尚学东 徐昕
1上海体育学院运动康复系(上海 200438)
2国家体育总局运动医学研究所(北京 100061)
癌症是重大的公共卫生问题[1]。阿霉素(Doxorubicin,DOX)是一种抗癌化疗药物,被列为“蒽环类抗生素”,在许多肿瘤性疾病(如造血系统恶性肿瘤,乳腺、卵巢、甲状腺和骨骼的晚期实体瘤)的治疗中起着关键作用,且疗效显著,已成为各种癌症标准治疗方案的一部分;但阿霉素治疗后会出现一定的副作用,即剂量依赖性心肌损伤,长期使用会导致各种心肌病[2,3]。有研究显示,心肌病会影响癌症化疗病人的治疗效果,还会导致癌症病人的死亡[4]。因此,如何缓解阿霉素诱导的心肌损伤,同时最大限度发挥其治疗癌症的益处,是目前亟待解决的问题。
本文回顾阿霉素诱导的心肌损伤的机制和支持运动疗效的现有证据,为癌症患者的康复提供新观点、新靶点和新方法。
1 文献检索和筛查
在Pubmed英文数据库中,通过关键词组合“Exercise AND Doxorubicin AND Heart”检索英文文献。在中国知网数据库中,选择运动领域相关的核心期刊进行中文文献检索,检索词为“运动和阿霉素和心脏”。所有英文文献和中文文献的检索日期均截止到2019年1月20日。文献录入标准:(1)已在学术期刊上出版的全文或摘要;(2)有关运动治疗阿霉素诱导的心肌损伤的原创实验性研究。
在Pubmed数据库中共检索到英文文献 123篇,中国知网上未发现相关中文文献。经初步阅读标题和摘要后,筛除不符合录入标准的文献81篇,对符合录入标准的42篇英文文献进行全文阅读筛查。经全文阅读筛查后,剔除6篇不符合录入标准的文献,共36篇文献符合录入标准。
2 阿霉素诱导的心肌损伤
2.1 阿霉素诱导的心肌损伤症状
阿霉素药物治疗的基本原理是损害癌细胞的有丝分裂和代谢过程,但同时,某些正常的细胞和组织也会受到化疗的影响,导致各种轻度和严重的不良反应,包括恶心、呕吐、骨髓抑制和心血管副作用,即低血压、心动过速、心律失常和心力衰竭等[5]。
2.2 阿霉素诱导的心肌损伤机制
根据阿霉素注射的剂量可以分为急性心肌损伤(一次性注射剂量超过10 mg/kg体重)和慢性心肌损伤(多次注射,累计注射剂量20 mg/kg体重)[5]。目前阿霉素诱导心肌损伤有以下几种机制:①阿霉素诱导心肌活性氧(reactive oxygen species,ROS)增加[10],ROS增加导致细胞蛋白水解系统的激活,加速肌丝细胞凋亡,关键途径涉及肿瘤抑制蛋白p53的激活[6];②阿霉素通过下调GATA4蛋白的表达,抑制肌丝蛋白合成,诱导细胞凋亡[7];③阿霉素引起心肌细胞钙稳态的改变,刺激钙离子的释放和抑制肌质网钙离子的摄取,导致胞浆钙超载,这种钙过载可能导致促进凋亡因子细胞色素C的释放[8];④阿霉素影响心肌的线粒体DNA结构[9,10];⑤阿霉素改变肌球蛋白重链的比例,导致肌原纤维紊乱[20];⑥阿霉素改变心脏能量代谢变化,降低细胞内三磷酸腺苷(adenosine triphosphate,ATP)的储备,还降低了腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)蛋白水平及其碱性活化状态,导致AMPK下游靶点的抗乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)的磷酸化水平降低,进而导致脂肪酸氧化受损[6,11]。
2.3 阿霉素诱导的心肌损伤的早期检测
心肌损伤的早期检测对可逆的心肌损伤(2型相关的心脏功能障碍)或不可逆的心肌损伤(1型相关的心脏功能障碍)具有实质性影响[12]。已有研究使用不同的心脏成像技术来测试心脏射血分数,包括2D或3D超声心动图、组织多普勒成像和心脏核磁共振成像[13]。最常用的心脏监测方法是通过2D超声心动图测量心脏射血分数,如果在正常状态下检测出较低的心脏射血分数或者阿霉素治疗期间心脏射血分数的无症状性降低,则表示存在心肌损伤。2D超声心动图检测亚临床心肌损伤的敏感性较差。心脏核磁共振成像可以评估心脏收缩期和舒张期功能,并支持心肌直接成像,但是其高成本和缺乏指标的有效性限制了其日常使用[13]。同样的,实时3D超声心动图似乎比常规2D超声心动图有优势,然而,由于成本的原因,其并没有得到广泛的应用,并严重依赖于高质量的图像和操作人员的专业知识来实现上述卓越的功能[14]。因此敏感心脏成像技术需要纳入未来的研究,如心肌代谢(如ATP/磷酸)配合心脏磁共振成像,循环生物标志物与成像模式结合等,这些都可以作为心脏功能变化的早期检测手段[15,16]。
2.4 阿霉素诱导的心肌损伤的治疗措施
目前许多心脏保护措施正在被积极研究,以用于治疗或预防阿霉素诱导的心肌损伤,这些措施包括运动、高压氧预处理、血管紧张素转换酶抑制剂、钙通道阻滞剂和β受体阻滞剂等,其中运动是能够明显减弱阿霉素诱导的心肌损伤的非药物策略之一[17]。
3 运动防治阿霉素诱导的心肌损伤的证据和机制
有关运动缓解阿霉素诱导的心肌损伤的研究中,大部分文献都是动物实验,研究了不同类型的运动对急性或慢性心肌损伤的影响,有关阿霉素使用之前运动干预的研究比较多,运动形式可以分为有氧运动(游泳、跑台和自主转轮)和抗阻运动等。还有少部分文献进行了临床癌症患者的运动干预研究。我们对以上研究进行表格分类归纳,表1是阿霉素使用前运动对急性心肌损伤影响的动物研究,表2是阿霉素使用前运动对慢性心肌损伤影响的动物研究,表3是阿霉素使用期间或之后运动对心肌损伤影响的动物研究。
3.1 阿霉素使用前运动对急性心肌损伤影响的动物研究证据和机制
关于阿霉素使用前运动对急性心肌损伤影响的动物研究有20篇,如表1所示。大部分采用的跑台运动;另外有7篇是短期运动(1~5天),有4篇是中期运动(2~3周),有9篇是长期运动(8~14周)。
运动可以增加心肌抗氧化酶,抑制心肌氧化应激,保护心脏免受ROS的损伤。如阿霉素使用前的短期和长期跑台运动可以导致心脏保护标记物谷胱甘肽(glutathione,GSH)、热休克蛋白 70(heat shock protein 70,HSP70)、HSP60、HSP72和超氧化物歧化酶(superoxide dismutase,SOD)显着增加,还可导致心脏损伤标记物丙二醛(malonaldehyde,MDA)、肌酸激酶和肌酸磷酸激酶减少[18,21,22,25,37,38]。母体进行的运动也可以通过增加抗氧化酶调节氧化应激增加新生鼠心脏对阿霉素毒性的抗性[34]。
运动通过改变心脏肌球蛋白重链(myosin heavy chain,MHC)同种型分布来保护心脏。早期锻炼可以降低阿霉素诱导的慢性心肌损伤,且这种保护机制和α-MHC同种型的上调以及MHC亚型分布的保存相关[20,23]。另外,抗阻运动也可以产生类似的保护作用[35]。
运动训练通过血管平滑肌松弛保护心脏,心肌收缩协调性增加,增强心肌收缩力,提高左室射血分数,改善心脏自主神经功能。如14周的自主转轮运动可以减弱与阿霉素使用相关的血管平滑肌功能障碍,还能维持血管平滑肌在阿霉素使用后的收缩和舒张反应[29]。
运动通过维持心脏细胞中的钙离子稳态来保护心脏。肌浆网(SR)Ca2+-ATP酶 2a(Serca2a)在调节心脏功能方面扮演着重要角色[39]。阿霉素使用之前的短期运动可以抵消急性心肌损伤和左心室不良重塑,其机制与维持心肌细胞中的钙离子稳态以及Serca2a的表达增加有关[33,40]。
运动训练通过减少心肌阿霉素的积累来保护心脏。中期和长期的运动预处理都可以减少心肌中阿霉素的积累,这种减少与保留的心脏功能相关,表明运动对DOX诱导的损伤的心脏保护作用可能部分是由于心肌阿霉素积累的减少[27,28,36]。
运动训练可以降低阿霉素诱导自噬/溶酶体信号的传导。阿霉素使用之前的运动可以抑制阿霉素诱导的心脏中自噬信号/基因表达的增加,抑制自噬/溶解系统通路的激活,从而抵抗阿霉素诱导的心肌损伤[30,41]。
运动训练可以调节心脏能量代谢,调节AMPK在心脏组织中的活性。2个月的跑台运动可以改善心脏局部功能和运动容量,AMPK-mTOR信号传导在其中起着重要作用[32]。另外,有氧运动可以增加总AMPK活性以及AMPKα同种型和心肌中AMPK的下游靶标(ACC;glucose transport-4,GLUT4),减少脂质过氧化反应,最终改善心肌能量紊乱[42]。
运动训练的有益适应与线粒体相关机制的调节有关,即控制以及重建心脏线粒体网络的能力。在阿霉素治疗过程之前和期间进行的运动会抑制心脏线粒体的细胞凋亡信号传导,并调节心脏中线粒体动力学和自噬的改变[43]。急性运动也可以保护心脏线粒体功能障碍,保持线粒体磷酸化能力,减弱阿霉素诱导的对线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)开放的耐受性[24]。
运动训练通过抑制心肌中凋亡和萎缩蛋白的表达来缓解心肌损伤。跑台运动能抑制阿霉素诱导的凋亡因子活性的增加,从而保护心功能[31,41]。短期运动可以防止阿霉素诱导的心肌中叉头转录因子1(FoxO1)和肌肉环指蛋白1(Muscle ring finger protein 1,MuRF-1)的增加,还增加过氧化物酶体增殖物受体γ共活化因子-1α(PGC-1α),导致FoxO靶基因的表达降低。
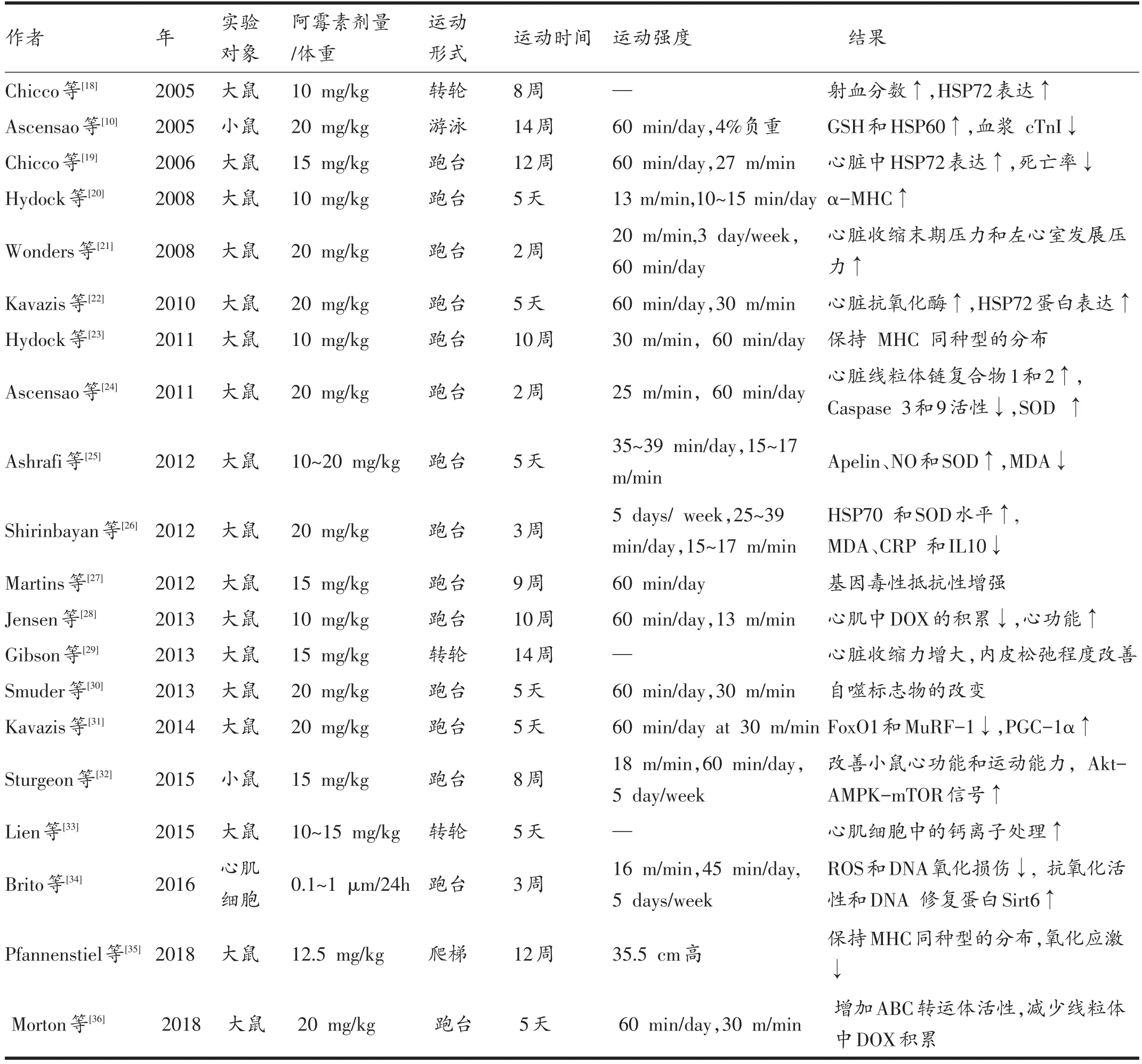
表1 阿霉素使用前运动对急性心肌损伤影响的动物研究
3.2 阿霉素使用前运动对慢性心肌损伤影响的动物研究证据和机制
目前有4篇关于运动防治阿霉素诱导的慢性心肌损伤的动物研究,如表2所示。其中Hydock等[45]发现注射阿霉素后,转轮组大鼠的心脏相比安静组含有更高水平的α-MHC亚型,并且阿霉素注射显著降低转轮组大鼠的自主转轮距离,这可能是一种心脏保护反应。Marquesaleixo等[47]发现心脏线粒体的可塑性和适应能力可能是运动诱发的心脏保护机制,长期有氧运动使心肌细胞线粒体膜及线粒体呼吸链逸出形成的活性氧减少,MPTP开放的耐受性降低,使心肌线粒体DNA免受损伤,保护心肌线粒体的功能结构。Chicco等[44]发现低强度运动缓解了阿霉素诱导的心肌损伤,与降低了凋亡信号通路的活性有关,也与谷胱甘肽过氧化物酶的增加有关。Matsuura等[59]发现6周跑台运动降低了阿霉素引起的动物死亡率,恢复了血管平滑肌的松弛特性,其机制可能至少部分是由于恢复了血管平滑肌松弛的特性,从而减少了周围血管的阻力和对心脏的压力。

表2 阿霉素使用前运动对慢性心肌损伤影响的动物研究
3.3 阿霉素诱导的心肌损伤后运动对心肌损伤影响的动物研究证据和机制
目前大部分研究都是运动对阿霉素诱导的心肌损伤的的防治研究,阿霉素使用期间和之后的运动干预研究还较少。目前只有3项研究考察了阿霉素使用期间和之后运动的影响,如表3所示。其中Hydock等[46]发现在阿霉素给药期间和之后的转轮运动通过保持最大二尖瓣和主动脉血流速度来防止阿霉素诱导的心脏毒性,与MHC亚型表达变化有关。Dolinsky等[40]研究发现阿霉素可以引起不良的左心室重塑,阿霉素注射之后的运动可以部分减弱不良的左心室重塑,其机制和运动训练增加线粒体电子传递链复合物以及线粒体融合蛋白1和2有关,还与Serca2、过氧化物歧化酶的增加有关。Marquesaleixo等[60]发现在阿霉素治疗过程之前和期间进行的有氧运动改善线粒体生物能量适应性,其机制可能与部分抑制线粒体氧化应激和损伤有关,如线粒体链复合物1和2升高,对心脏具有保护作用的Sirt3含量升高。
上述研究表明,阿霉素使用前和使用后,运动都可以缓解慢性或急性心肌损伤,我们总结了以下作用机制,如图1所示:运动训练增加了心肌抗氧化酶保护心脏免受ROS的损伤作用;改变MHC同种型分布的变化;使血管平滑肌松弛;维持心脏细胞中的钙离子稳定;减少心肌阿霉素积累;降低阿霉素诱导的自噬/溶酶体信号的传导;调节心肌能量代谢;改善线粒体功能障碍、抑制心肌中萎缩蛋白的表达和抑制凋亡因子的活性。
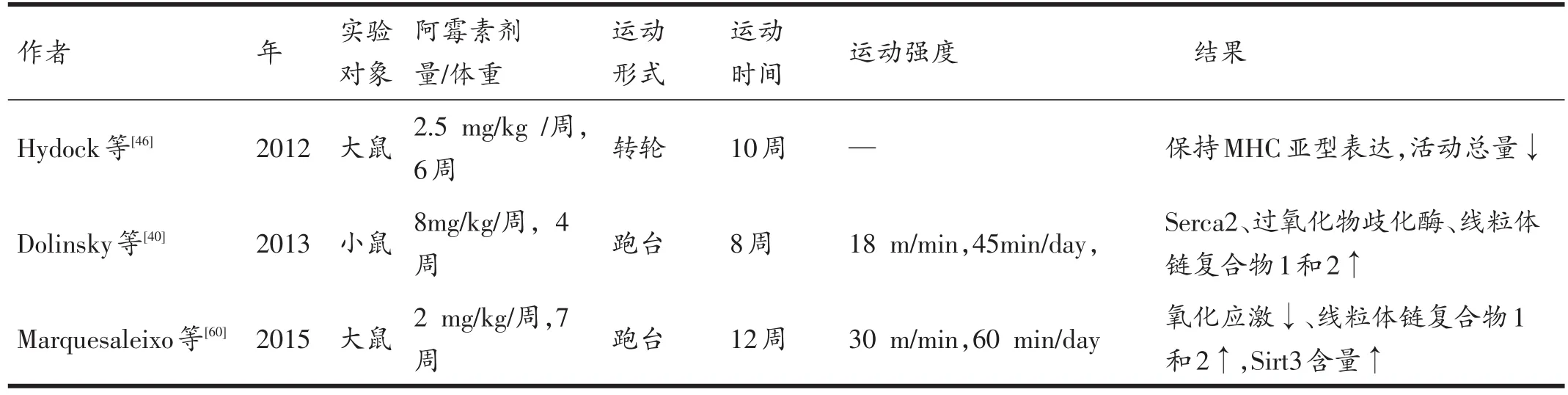
表3 阿霉素使用期间或之后运动对心肌损伤影响的动物研究
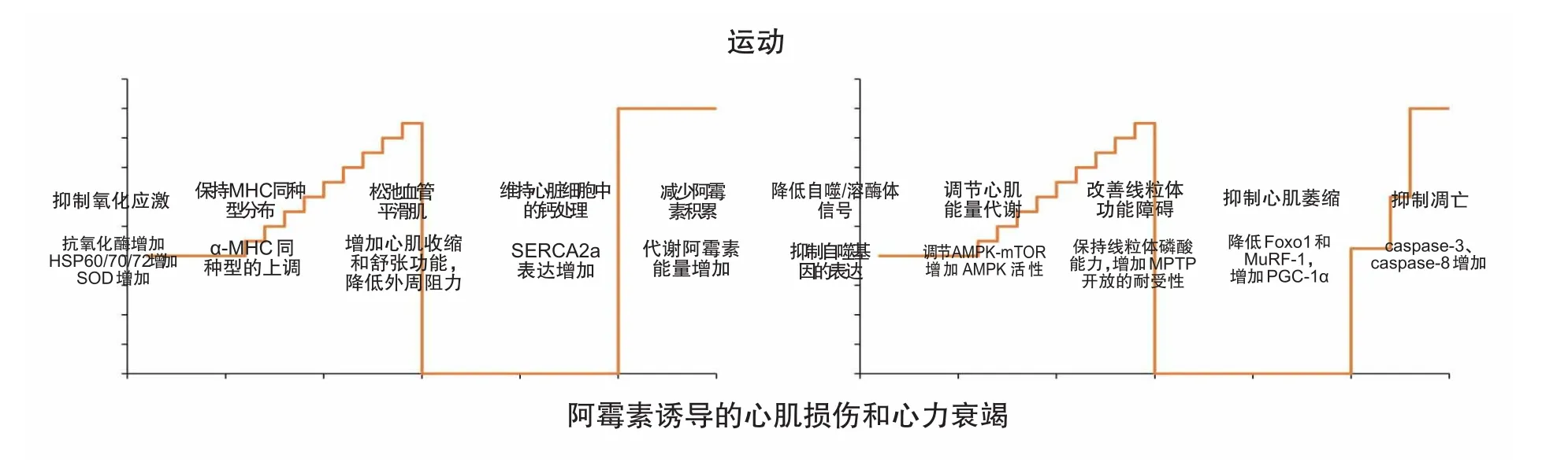
图1 运动缓解阿霉素诱导的心肌损伤机制图
3.4 运动防治阿霉素诱导的心肌损伤的临床研究证据
除动物研究外,也有一些关于运动防治阿霉素诱导的心肌损伤的临床研究。其中阿霉素治疗前的运动干预可以预防阿霉素治疗过程中诱导的心肌损伤。有研究发现每次阿霉素治疗前24小时进行的运动训练对临床心脏损伤的标志物没有影响,但对乳腺癌患者的血流动力学、肌肉骨骼症状、情绪和体重具有积极的全身作用,可以减轻乳腺癌患者的症状[48]。在阿霉素治疗之前24小时进行的跑步运动对心脏提供了保护作用,包括减弱氨基末端脑钠尿肽(NT-proBNP)的释放和增加收缩功能[49]。
也有临床研究表明阿霉素治疗过程中的运动干预能缓解阿霉素诱导的心肌损伤。心血管事件是非转移性乳腺癌患者过早发病和死亡的主要原因,乳腺癌患者经常运动可以降低死亡率[50]。有研究对2973名患有非转移性乳腺癌的女性进行了6年的跟踪调查,发现其心血管事件的发生率随着活动水平的增加而降低,遵循癌症运动指南并且运动代谢当量(metabolic equivalent,MET)≥9 MET/小时/周的心血管事件相比每周运动<9 MET/小时/周的人减少了23%[51]。有研究对20名接受阿霉素治疗的早期乳腺癌妇女进行有氧运动干预,发现有氧运动可以改善癌症的副作用和患者的心肺能力[52]。中等强度运动不仅可以维持,而且可以显着改善接受化疗的女性的有氧运动能力和肌肉力量[53]。重要的是,在女性癌症患者接受化疗期间,包括高强度有氧间歇训练在内的监督式有氧训练计划是安全的(且耐受性相对较好)[54]。
阿霉素药物治疗的儿童癌症患者也存在心肌病的风险,有研究评估了儿童癌症患者在12周运动干预前后的身体组成、力量和心肺适应性,发现运动训练也可以提高儿童癌症患者的运动能力[55]。
上述证据支持运动是预防或治疗DOX诱导的心脏损伤的有效策略。应该鼓励乳腺癌、儿童癌症等患者定期运动,因为运动已证实可以改善癌症相关的疲劳、心肺能力、身体健康和生活质量[56]。
4 运动防治阿霉素诱导的心肌损伤的问题和未来方向
4.1 运动是否会影响阿霉素药物化疗的效果
虽然运动可以缓解阿霉素药物导致的心肌损伤,但也要考虑运动是否会影响阿霉素药物化疗的效果。在动物研究中,Parry等[57]发现阿霉素治疗后的耐力运动对阿霉素抗肿瘤功效没有影响,且运动可以保持心脏功能,并减少心室中阿霉素积聚,其机制与上调心室中多药耐药蛋白( multidrug resistance protein,MRP)的表达有关。临床研究也表明适当的体育活动是减少乳腺癌幸存者死亡和乳腺癌事件的重要干预措施,并且不会降低阿霉素的抗肿瘤功效[58]。目前的动物研究和临床研究结果均表明运动在缓解阿霉素导致的心肌损伤的同时,不会影响阿霉素药物化疗的效果。今后应通过更多的临床研究来验证,如其他的运动方案或者不同癌症患者。
4.2 不同运动处方的问题
目前,防治阿霉素诱发的心脏损伤的最合适和有效的运动处方是未知的,因此对不同运动处方的比较分析是有意义的。如有研究发现短期有氧运动可以缓解阿霉素诱导的心脏功能障碍,这种短期的运动干预比较有吸引力,因为时间比较短,比较容易执行。也有研究发现长时间的有氧运动也能缓解阿霉素诱导的心肌损伤,但与短期有氧运动相比效果如何尚不清楚。另外,有氧运动或者无氧运动方式的相关研究均表明其可以防止阿霉素诱导的心肌损伤,包括跑步、转轮、游泳和爬梯,但这些运动方式的防治效果是否有差异还需要进一步研究。我们最终的目标是将运动与癌症治疗结合在一起,并寻找适合癌症患者的最佳运动方式,因此未来的研究还应着重于确定运动保护心脏损伤的最佳运动强度和时间,以及比较不同运动形式的保护效果。
4.3 动物研究向人体的转化
关于运动防治阿霉素引起的心脏损伤的研究主要集中在动物研究,临床相关研究相对较少。根据动物研究的结果,我们总结了运动防治心肌损伤的机制(图1),包括有氧运动抑制氧化应激、调节能量代谢等,但这些机制是否也可适用于人类,需要更多的临床研究确认。另外,由于大部分研究使用的啮齿类动物模型,故运动方法仅限于跑步、转轮、游泳和爬梯。但在临床研究中,大部分是跑步运动,还有一部分间歇有氧运动,均能有效降低癌症患者的心血管事件。跑台运动方式对于动物模型和癌症患者均适用;癌症患者无法进行转轮运动,但是癌症患者的间歇运动可能与转轮运动有一定的相似之处,如可以根据自身情况调整运动强度,在较低的强度和较高的强度中切换。另外,癌症患者心肺能力比较差,容易疲劳,不太适合进行游泳和爬梯等大强度运动。因此我们要根据癌症患者的身体情况和个人喜好选择适当的运动方式。
动物研究表明阿霉素使用前长时间的有氧运动可以缓解阿霉素带来的心肌损伤。但我们需要考虑到临床癌症患者的现实情况,癌症患者从确诊到开始使用药物化疗的时间很短,不足以进行长时间运动;另外,癌症患者不止化疗一次,周期比较长,还要考虑到后续化疗过程和化疗之后造成的心肌损伤。因此,还需要进行更多的阿霉素治疗期间或治疗后的运动干预研究。
4.4 运动在防治心肌损伤过程中的安全性问题
尽管运动对心脏保护益处得到很好的验证,但运动中仍然存在一定的风险,尤其是长时间较大强度的运动,强度较小的运动可以很大程度上降低风险。不管疾病状况和运动效果如何,重要的是要考虑运动的安全性。如在癌症患者中,我们要考虑患者的心血管风险因素(如年龄、高血压、血脂异常)和生理状态(如疲劳、运动耐受性),癌症患者可能病情太重,无法坚持规定的运动剂量,甚至会出现不良的运动反应,可能会减弱运动的益处。另外,因为儿童癌症幸存者和成年癌症幸存者在相对寿命、阿霉素使用量、心肌损伤程度和运动耐受性方面也不同,今后应分开研究儿童和成人癌症幸存者的运动效果。
5 结论
本文概述了阿霉素诱导的心肌损伤的性质和机制,并列出支持运动缓解阿霉素诱导的急性或慢性心肌损伤的动物研究和临床研究证据,提出运动治疗阿霉素诱导的心肌损伤的保护机制,包括增加了心肌抗氧化酶、改变MHC同种型分布的变化、使血管平滑肌松弛、维持心脏细胞中的钙处理、减少心肌阿霉素积累、降低阿霉素诱导的自噬/溶酶体信号的传导、调节心肌能量代谢、改善线粒体功能障碍、抑制心肌中萎缩蛋白的表达和抑制凋亡因子的活性。今后应该着重于确定运动保护心脏损伤的最佳运动强度和时间,比较不同运动形式的保护效果;进行更多的临床研究;进行更多的阿霉素治疗期间或治疗后的运动干预研究;注重癌症患者运动的安全性。

