例析盐溶液中的“三大守恒”
杨创文
广东省佛山市顺德李兆基中学 广东 佛山 528300
新课程标准提出:通过对电离平衡、水解平衡等存在的证明及平衡移动分析,形成并发展学生的微粒观、平衡观和守恒观;发展学生“宏观辨识与微观探析”“变化观念与平衡思想”等化学学科核心素养,培养系统思维能力。
关于水溶液中的离子平衡涉及到的不等式(即离子溶液大小比较)和三大守恒式(即物料守恒、电荷守恒和质子守恒)是近年高考的必考点。解答此类题,既要定性分析微粒性质,也要定量分析有关离子,涉及的知识主要是电离理论、水解理论与及“三大守恒”关系式。
“三大守恒”式中,电荷守恒出现频率最大,物料守恒近年热度有所下降,对于质子守恒高考出现的次数较少,但每次出现均会难倒大部分同学。关于质子守恒,在高考备考过程中笔者带领学生有针对性地进行复习,并取得不错的效果。
一、以常规题型为例,形成快速答题模版
从溶液组成,可分为单一溶质和混合溶质两类;从选项类型,可分为等式和不等式两类。
例题1.在Na2CO3溶液中,下列关系式不正确的是( )
A.c(Na+)=2c()+2c()+2c(H2CO3)
B.c(Na+)+c(H+)=2c()+c()+c(OH-)
C.c(OH-)=c(H+)+c()+2c(H2CO3)
D.c(Na+)+c()+2c(H2CO3)=2c()+c(OH-)
解题思路:此题为典型“三大守恒”关系题,可通过列表方式书写“三大守恒”
快速且正确书写出上述“三大守恒”关系式是解题的关键。A为物料守恒,B为电荷守恒,C为质子守恒,故本题的答案为D。
例题2.在Na2S溶液中下列关系不正确的( )
A.c(Na+)=2c(HS一)+2c(S2一)+c(H2S)
B.c(Na+)+c(H+)=c(OH一)+c(HS一)+2c(S2一)
C.c(Na+)>c(S2一)>c(0 H一)>c(HS一)
D.c(OH一)=c(HS一)+c(H+)+2c(H2S)
解题思路:此题既可等式也可不等式形式出现,但只要有等式都考虑写“三大守恒”式。
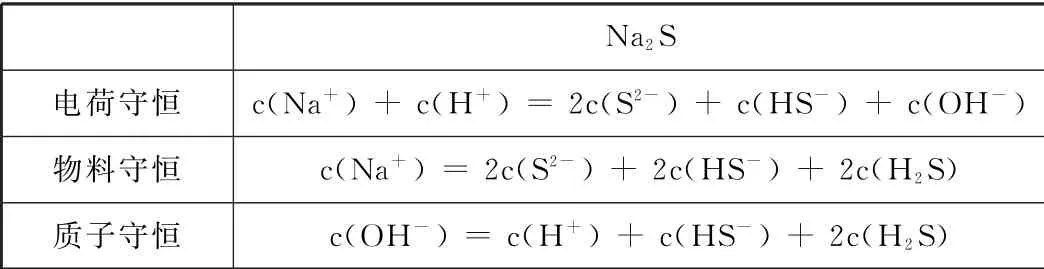
Na 2S电荷守恒 c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)物料守恒 c(Na+)=2c(S2-)+2c(HS-)+2c(H 2S)质子守恒 c(OH-)=c(H+)+c(HS-)+2c(H 2S)
模仿例1很快能找出选项A不正确,C选项不等式关系需要综合考虑Na2S的电离和H2O的电离以及S2-的水解。
例题3.在Na HCO3溶液中,下列关系式不正确的是( )
A.c(Na+)=c()+c()+c(H2CO3)
B.c(Na+)+c(H+)=2c()+c()+c(OH-)
C.c(OH-)=c(H+)+c(H2CO3)-c()
D.c(Na+)>c(HCO3一)>c(0 H一)>c()>c(H+)
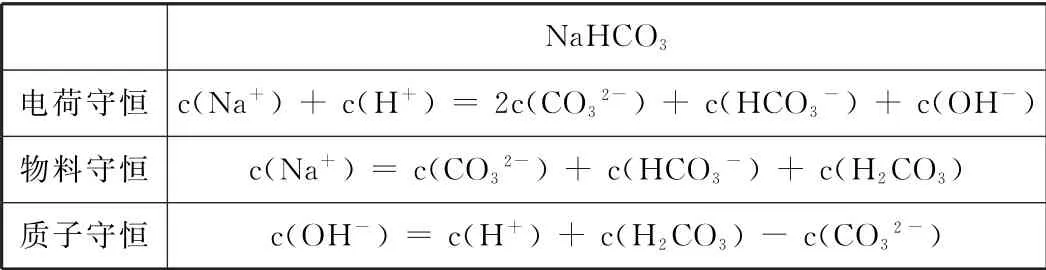
Na HCO3电荷守恒c(Na+)+c(H+)=2c(CO3 2-)+c(HCO3-)+c(OH-)物料守恒 c(Na+)=c(CO3 2-)+c(HCO3-)+c(H 2 CO 3)质子守恒 c(OH-)=c(H+)+c(H 2 CO3)-c(CO3 2-)
例题4.浓度均为0.1 mol/L的Na2CO3和Na HCO3等体积混合,下列关系式正确的是( )
A.c(Na+)+c(H+)=c()+c()+c(OH-)
C.c(Na+)<c()+c()+c(H2CO3)
解题思路:本题为混合溶质型题,有一定难度。准确列“三大守恒”关系式,对于理清微粒之间的关系将有很大帮助。

n(Na 2 CO3):n(Na HCO3) =1:1电荷守恒c(Na+)+c(H+)=2c(CO3 2-)+c(HCO3-)+c(OH-)物料守恒 2c(Na+)=3[c(CO 3 2-)+c(HCO3-)+c(H 2 CO3)]质子守恒 2c(OH-)+c(CO3 2-)=2c(H+)+3c(H 2 CO3)+c(HCO3-)
通过上述四个例题训练不难发现,解答水溶液中的离子平衡相关题目,对于“三大守恒”关系式的熟练运用相当重要,在教学过程很有必要给学生分析清楚这些式子存在的原因,以帮助学生加深理解,尤其是质子守恒式的书写。
二、框图建模法帮助学生准确掌握“三大守恒”关系式,特别是“质子守恒”关系式
1、关于电荷守恒。电解质溶液呈电中性,任何电解质溶液其阳离子所带的电荷总和必然等于阴离子所带的电荷总和,即存在a C(Aa+)=b C(Bb-)。所以书写电荷守恒式时,只要把溶液中存在的阳离子和阴离子全找出来,分别列在等号两边,注意离子所带的电荷数与该离子系数保持一致即可。
2、关于物料守恒。物料守恒是指溶液中某一组分的原始浓度应等于它在溶液中各种存在形式的浓度之和。即变化前后某种元素原子个数守恒。如固体NA2CO3中N(NA+)=2 N(),因为在水溶液中会存在水解,故把其水解后的产物全找齐,则得到物料守恒式:c(Na+)=2c()+2c()+2c(H2CO3)3、关于质子守恒。质子守恒是指酸失去的质子数目与碱得到的质子数目相等。高中只从电离的角度简单学习了酸碱理论,学生对质子守恒的应用存在较大的局限性。为了帮助学生更好的掌握质子守恒,笔者进行如下尝试:
(1)联立“电荷守恒”和“物料守恒”,消去强电解质离子,得到质子守恒式子。
此方法浅显易懂,容易接受,对于正确解题有很大的帮助,熟练掌握此方法后可以解答大多数的质子守恒,尤其是混合盐溶液的质子守恒,其优势明显。该方法要先准确地将“电荷守恒”和“物料守恒”写出来,然后两式联立消去强电解质离子,每步均不能出错,如果其中一步出错,结果可是相当凄惨。其次,该方法纯粹为解题而生,并不能对“质子守恒”有深刻的认识。鉴于此,笔者会引导学生从微观粒子变化的角度去探索“质子守恒”。
(2)水的电离平衡角度理解“质子守恒”的本质
盐溶液中除了溶质存在电离平衡及水解平衡,还存在水的电离平衡。当溶质仅为正盐时,溶液提供质子(即H+)的只有水,在H2O⇌H++OH-中,水电离出的氢离子等于水电离出的氢氧根离子,即:C(H+)水电离=C(OH-)水电离。例如NA2CO3中存在如下水解平衡,C+H2O⇌+OH-和+H2O⇌H2CO3+OH-,结合水解方程得出:1个结合1个H+生成1个,这部分的C(H+)可以用C()形式复原,由两个水解方程联立可得:1个结合2个H+生成1个H2CO3,而这部分的C(H+)则用2×C(H2CO3)形式复原,这里有个2倍的关系,恰恰是学生最容易出错的地方。整理后c(OH-)=c(H+)+c()+2c(H2CO3)。此方法可以不用写“电荷守恒”和“物料守恒”式,但也存在比较致命的弱点,对于酸式盐溶液,以及存在酸式盐的混合盐溶液则存在较大的难度。其原因是酸式盐也会提供质子,如此会存在多个关系式,给最后联立求总式带来一定难度。通过Na HCO3的练习,学生普遍觉得,如果要快速书写质子守恒,还不如用第一种方法来得实在。因为此时,除了水会电离产生质子,同时HCO3-也会电离产生质子,在解题时就得多方面考虑。如何帮助学解决这一困难,笔者作了常规处理,Na HCO3溶液中存在的电离平衡及水解平衡分别有:H2O⇌H++OH-,⇌H++,+H2O⇌H2CO3+OH-。若只考虑电离则有C(H+)=C(OH-)+C(),由于还存在HCO3-的水解,水电离出的部分H+以H2CO3形式呈现,则水解多出来的C(OH-)=C(H2CO3)。联立两种情况,就可以得出质子守恒式:C(H+)+C(H2CO3)=C(OH-)+C()。此方法处理多元弱酸的酸式盐将倍感吃力,如NAH2PO4。
(3)酸碱质子理论深层次揭示“质子守恒”
质子理论认为:酸给出质子后变成碱,碱接受质子后变成酸,酸=碱+质子,此式中右边的碱是左边的酸的共轭碱,左边的酸是右边的碱的共轭酸,既能给出质子又能接受质子的物质为两性物质。以酸碱质子理论为指导,结合框图法能更加直观地反映质子守恒的关系。
以NA2CO3为例(图-1)。
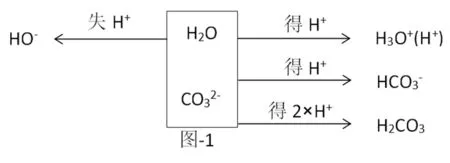
质子理论指出H2O既可以是酸也可以是碱。通过上述框图,清晰得出左为边失去质子后的形态,右边为得到质子后的形态。存在如下关系:c(OH-)=c(H+)+c()+2c(H2CO3),H2CO3系数为2,是因为1个得到2个质子,最终以2个H2CO3形式出现。框图法书写质子守恒,无需写“电荷守恒”和“物料守恒”,故更高效,更准确。但要求学生能判断哪些微粒能产生质子,哪些微粒能结合质子,以及它们对应的共轭酸碱。
对于直接书写酸式盐的“质子守恒”式,框图分析法更具优势,例Na HCO3(图-2)

NA HCO3的质子守恒式为:c(OH-)+c()=c(H+)+c(H2CO3)
再如Na H2PO4,其分析如下(图-3)
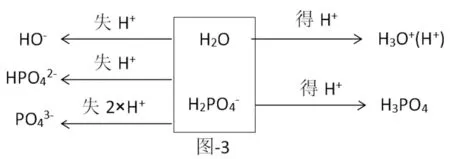
Na H2PO4的质子守恒式为:c(OH-)+c()+2c()=c(H+)+c(H3PO4),前面的系数为2,原因是1个H2PO4-可以失去2个质子,最终以2个形态出现。
混合溶液其质子守恒相对难些,例Na2CO3与Na HCO3等浓度等体积混合,分析如下(图-4)。
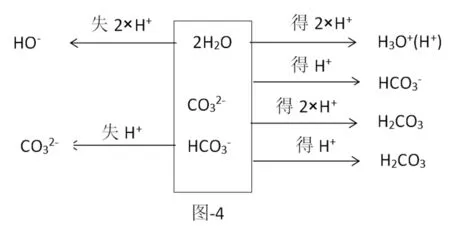
该混合液质子守恒式为:2c(OH-)+c()=2c(H+)+c ()+3c(H2CO3),H2O的系数为2,原因是Na2CO3与Na HCO3等浓度等体积混合,可以视为两份溶液,水的量加倍,从而导致H2O得失质子数也加倍。H2CO3系数为3是由于1个得2个质子,1个得1个质子,两者合并共得3个质子,最终以3个H2CO3形态呈现。
Na2CO3与Na HCO3若以任意比例混合,如Na2CO3:Na HCO3=x:y,求其质子守恒式。
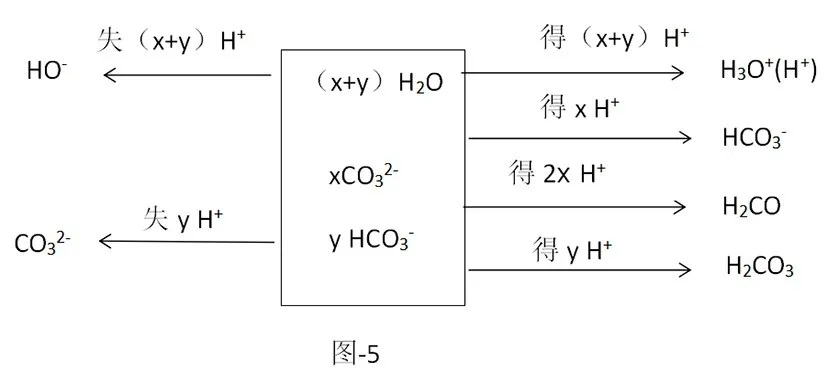
其质子守恒式为:(x+y)c(OH-)+yc()=(x+y)c(H+)+xc()+(2x+y)c(H2CO3)
综上所述,教师在教学过程中帮助学生深挖知识背后的原理有助于学生深层次地理解考题所蕴藏的知识,在帮助学生理解的基础上快速且正确地作答,需要教师对解题过程进行建模,并能准确地把思维建模方法教会学生。学生要学习的不仅仅是知识,更多的是维思方式,所以,在教学过程教师很有必要对自己的思维进行建模,并帮助学生建模以达到更优的教学效果。

