高糖环境对大鼠髓核细胞基质代谢的影响
田文葭,李 琰,倪海祥
1)浙江中医药大学附属第一医院内分泌科 杭州 310006 2)浙江大学医学院附属第二医院骨科 杭州 310009
椎间盘突出与糖尿病均是困扰现代人群的常见疾病,以往认为两者是互相独立的疾病,而近年来的多项研究[1-2]均表明,两者之间存在密切联系。椎间盘退变的主要病理特征为细胞外基质(蛋白聚糖和Ⅱ型胶原)的降解增加以及合成减少。而糖尿病作为一种全身性的代谢疾病,除了会损害常见的靶器官如视网膜、肾脏、大血管、神经,也会对眼肌、骨、脑、乳腺等器官组织造成损害[3-4]。腰椎及颈椎间盘突出症患者患糖尿病的比例较其他疾病患者明显升高[1-2],糖尿病伴腰椎间盘突出症患者髓核中的蛋白多糖含量较单纯腰椎间盘突出症患者显著降低[5]。这些研究在一定程度上解释了糖尿病患者更容易发生椎间盘突出的原因,但是都没有分析具体机制。Zhang等[6]、Cheng等[7]的研究证实了高糖环境与髓核细胞凋亡、自噬相关,然而对髓核细胞基质代谢与糖尿病的关系仍缺乏研究。本文分析了高糖环境对大鼠髓核细胞生长、基质降解酶(MMP-3、MMP-13和ADAMTs)表达、基质成分Ⅱ型胶原蛋白和蛋白聚糖表达的影响,以期明确葡萄糖浓度与髓核细胞基质代谢之间的关系,旨在进一步探讨糖尿病与椎间盘退变之间的可能联系及作用机制。
1 材料与方法
1.1大鼠髓核细胞的分离与培养4~6周龄SD大鼠30只,雌雄对半,购自上海交通大学实验动物中心,许可证号:SCXK(沪)2013-0021,饲养于全屏障清洁级动物实验房内。大鼠腹腔注射戊巴比妥(150 mg/kg),处死,剪去背部毛发,络合碘消毒后,沿棘突正中切口切开至脊柱,剥离椎旁肌,钝性分离脊柱,咬除肋骨,完整分离胸椎下段及腰椎。将分离的胸、腰椎移至无菌操作台内,用尖刀切开纤维环,用显微镊挑出完整髓核组织,PBS清洗3遍,转移至15 mL离心管内,加入2.5 g/L胰蛋白酶-EDTA消化液于37 ℃水浴中消化5 min,加入含血清DMEM培养液终止消化,1 000 r/min离心5 min,弃上清。再次加入2 g/LⅡ型胶原酶于37 ℃水浴中消化100 min,加入含血清DMEM培养液终止消化。用200目无菌不锈钢滤网过滤后,将滤液移至离心管,1 000 r/min离心5 min,弃上清。使用DMEM培养液重悬细胞,计数后将细胞以3×108个/L接种至直径为10 cm的培养皿中。
1.2实验材料与仪器倒置显微镜(德国LEICA公司),PCR仪(美国THERMO公司),DMEM培养基和胎牛血清(美国Hyclone公司),CCK-8试剂盒(日本同仁化学公司),Trizol试剂(美国Invitrogen公司),反转录试剂盒和PCR试剂盒(日本TAKARA),ELISA检测试剂盒(上海邦奕公司),免疫组化试剂盒及Ⅱ型胶原蛋白一抗(武汉博士德公司),MMP-3、MMP-13、ADAMTS-4一抗(美国CST公司),P38、磷酸化P38(p-P38)、GAPDH一抗(美国Abcam公司)。
1.3不同浓度葡萄糖作用后髓核细胞的生长情况大鼠髓核细胞贴壁后在光镜下观察。取2~3代细胞,重悬后以5×103个/孔的密度种于96孔板中,使用含不同浓度(5、15、25 mmol/L)葡萄糖的DMEM培养基培养72 h,每24 h使用CCK-8试剂盒检测1次细胞增殖情况。检测时,移除96孔板内培养基,每孔加入CCK-8溶液10 μL,室温下孵育2 h,使用酶标仪检测450 nm处的吸光度。每个浓度设5个复孔。实验重复3次。
1.4不同浓度葡萄糖作用后髓核细胞中Ⅱ型胶原蛋白、蛋白聚糖mRNA的检测将髓核细胞以1×105个/mL的密度种于6孔板中,用含不同浓度(5、15、25 mmol/L)葡萄糖的DMEM培养基培养24 h。吸弃培养液,PBS洗3遍。使用Trizol法提取总RNA,DEPC水溶解,使用紫外分光光度计检测RNA浓度。按照反转录试剂盒说明,冰上操作,每1 μg RNA加入4 μL反转录混合试剂,补DEPC水使总体积至20 μL,然后按照37 ℃ 15 min、85 ℃ 5 s的条件行反转录。以制备的cDNA为模板,以GAPDH为内参基因,进行Real-time PCR。使用BLAST设计引物(表1)。冰上操作配置20 μL PCR反应体系:SYBR酶10 μL、上下游引物各0.4 μL、ROX Dye Ⅱ 0.4 μL、DNA模板2.0 μL、DEPC水6.8 μL。PCR反应条件:95 ℃30 s,95 ℃5 s,60 ℃34 s,共40个循环;溶解曲线:95 ℃15 s,60 ℃1 min,95 ℃15 s。使用2-ΔΔCT法计算目的mRNA表达水平。实验重复3次。
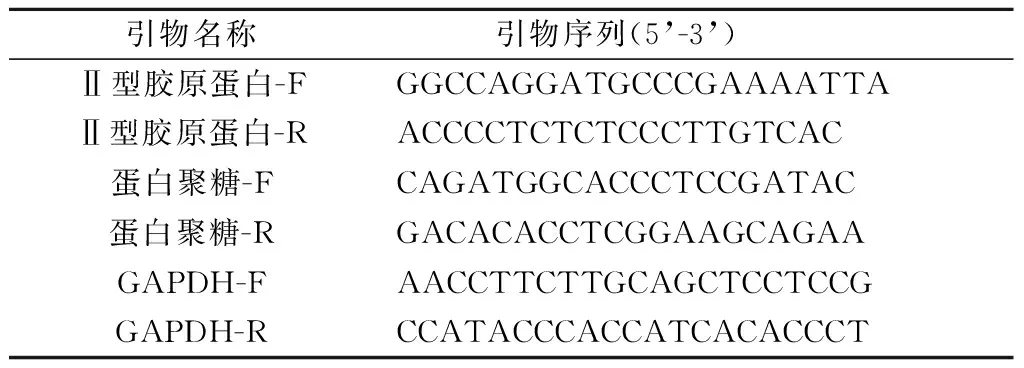
表1 引物列表
1.5不同浓度葡萄糖作用后髓核细胞中MMP-3、MMP-13、ADAMTS-4、P38及p-P38蛋白的检测将髓核细胞以1×105个/mL的密度种于6孔板中,使用含不同浓度(5、15、25 mmol/L)葡萄糖的DMEM培养基培养24 h。吸弃培养基,使用RIPA裂解细胞并提取总蛋白,BCA试剂盒检测蛋白浓度。配置100 g/L SDS-PAGE凝胶,加入蛋白样品及Marker,80 V恒压电泳2 h,切下凝胶,冰浴下恒流(0.25 A)转膜2 h。50 g/L脱脂牛奶室温封闭1 h,然后加入按1∶1 000稀释的MMP-3、MMP-13、ADAMTS-4、P38及p-P38一抗4 ℃孵育过夜,加入按1∶5 000稀释的二抗室温孵育1 h。以GAPDH作为内参,实验重复3次。使用Odyssey的红外成像系统(LI-COR)检测蛋白条带并进行定量分析。
1.6不同浓度葡萄糖作用后髓核细胞培养液中Ⅱ型胶原交联羧基端肽(CTX-Ⅱ)质量浓度测定将髓核细胞以1×105个/mL的密度种于6孔板中,用含不同浓度(5、15、25 mmol/L)葡萄糖的DMEM培养基培养48 h。取培养液1 mL,4 000 r/min离心5 min后取上清,使用CTX-Ⅱ ELISA试剂盒检测CTX-Ⅱ质量浓度。实验重复3次。
1.7不同浓度葡萄糖作用后髓核细胞中Ⅱ型胶原蛋白的检测制备髓核细胞爬片,在含不同浓度(5、15、25 mmol/L )葡萄糖的DMEM培养基中生长5 d,取出细胞爬片,用PBS清洗,以多聚甲醛固定30 min;再次用PBS清洗,用Triton X-100处理10 min,用体积分数3% H2O2处理5 min。PBS清洗,加入按1∶200稀释的Ⅱ型胶原蛋白一抗4 ℃孵育过夜,加入二抗室温孵育1 h。DAB显色,PBS冲洗,脱水,中性树胶封片。显微镜下观察并拍照。使用Image-Pro Plus 6.0 分析染色结果,以积分光密度(IOD)值表示目的蛋白表达水平。
1.8统计学处理采用SPSS21.0进行数据分析,3组细胞各指标的比较采用单因素方差分析,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1 3组大鼠髓核细胞的生长状况大鼠髓核细胞贴壁后在光镜下呈不规则多边形,细胞折光性好,随着培养时间的延长,细胞周围可见基质样物质沉积。第1~3代髓核细胞活力较佳,生长快,约5 d可以达到90%融合。从第4代开始细胞逐渐出现退变现象,细胞呈长梭形,体积缩小,基质样物质减少,细胞生长减缓,细胞间隙减小,逐渐向类成纤维细胞发展(图1)。本实验选取第2~3代细胞进行CCK-8增殖实验,结果(图1)显示: 25 mmol/L组的髓核细胞生长较5、15 mmol/L组减缓(P<0.001)。
*:与5、15 mmol/L组比较,P<0.001
2.2 3组大鼠髓核细胞蛋白聚糖mRNA、Ⅱ型胶原蛋白mRNA和蛋白及CTX-Ⅱ质量浓度的比较见图 2、表2。培养24 h后25 mmol/L组细胞Ⅱ型胶原蛋白、蛋白聚糖mRNA表达水平较5、15 mmol/L组降低(P<0.05)。培养48 h后25 mmol/L组细胞培养液中CTX-Ⅱ质量浓度较5、15 mmol/L组增加(P<0.05)。培养5 d后,Ⅱ型胶原蛋白免疫细胞化学染色结果显示,3组均阳性染色,25 mmol/L组细胞的IOD值较其他两组降低(P<0.05)。
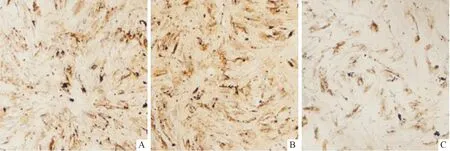
A:5 mmol/L组;B:15 mmol/L组;C:25 mmol/L组
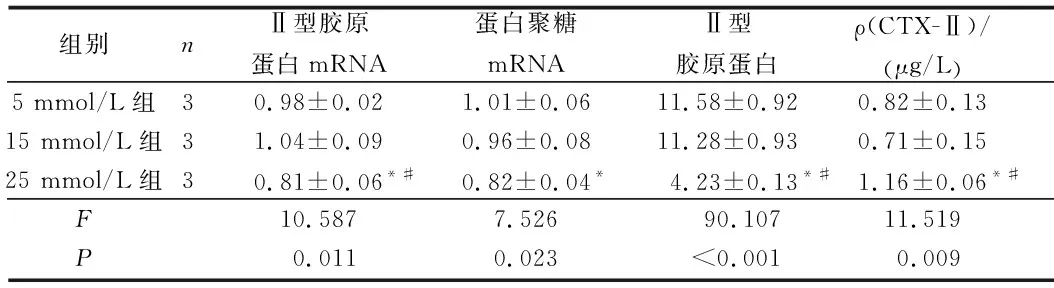
组别nⅡ型胶原蛋白mRNA蛋白聚糖mRNAⅡ型胶原蛋白ρ(CTX-Ⅱ)/(μg/L)5 mmol/L组30.98±0.021.01±0.0611.58±0.920.82±0.1315 mmol/L组31.04±0.090.96±0.0811.28±0.930.71±0.1525 mmol/L组30.81±0.06*#0.82±0.04*4.23±0.13*#1.16±0.06*#F10.5877.52690.107 11.519P0.0110.023<0.001 0.009
*:与5 mmol/L比较,P<0.05;#:与15 mmol/L比较,P<0.05
2.3 3组髓核细胞中MMP-3、MMP-13和ADAMTS-4表达水平的比较见图3和表3。25 mmol/L组细胞MMP-3、MMP-13表达水平较5、15 mmol/L组升高,而3组ADAMTS-4表达水平差异无统计学意义。
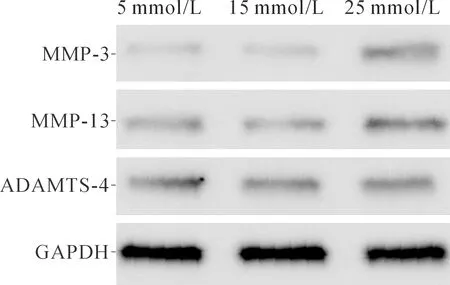
图3 3组细胞中基质降解酶的表达
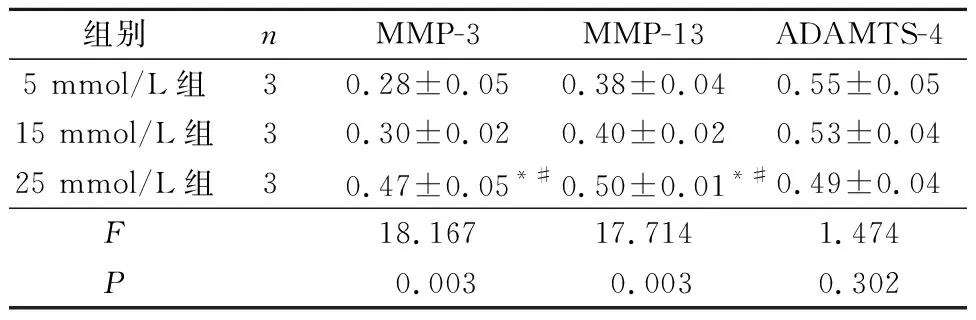
组别nMMP-3MMP-13ADAMTS-45 mmol/L组30.28±0.050.38±0.040.55±0.0515 mmol/L组30.30±0.020.40±0.020.53±0.0425 mmol/L组30.47±0.05*#0.50±0.01*#0.49±0.04F18.16717.7141.474P0.0030.0030.302
*:与5 mmol/L比较,P<0.05;#:与15 mmol/L比较,P<0.05
2.4 3组髓核细胞中P38磷酸化水平的比较Western blot结果见图4。培养24 h后,5、15、25 mmol/L组p-P38/P38分别为(0.10±0.01)、(0.17±0.01)和(0.63±0.09),3组比较,差异有统计学意义(F=89.892,P<0.001);25 mmol/L组细胞P38磷酸化水平较其他2组升高(P<0.001)。
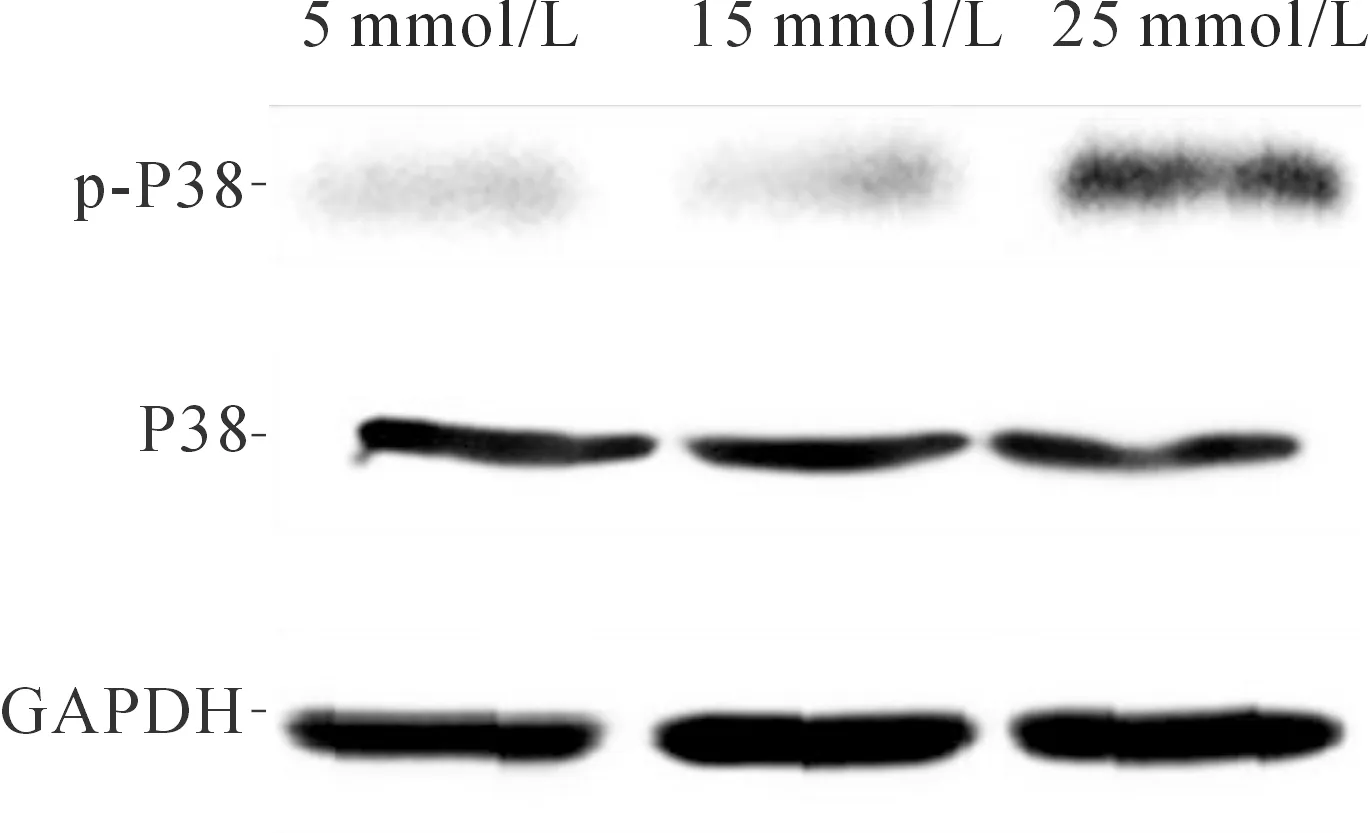
图4 3组细胞P38、p-P38的表达
3 讨论
椎间盘是人体内最大的无血供组织,主要通过两种方式获取营养物质,其一为终板途径(主要通过软骨终板扩散营养物质),其二为纤维环途径(主要通过纤维环表面的血管来传送营养物质),因此椎间盘内的髓核细胞长期在低糖、低氧的环境中生长。葡萄糖是椎间盘的主要供能物质,已有研究[8]表明,椎间盘内的葡萄糖主要通过浓度梯度扩散进行运输,这也就意味着血糖升高势必造成椎间盘内葡萄糖浓度随之升高。高浓度的葡萄糖可能导致椎间盘内乳酸堆积,进而诱发氧化应激反应,从而抑制髓核细胞的增殖以及促使髓核细胞凋亡[7]。另一项体外实验[9]也证实,高浓度葡萄糖对髓核细胞的增殖有显著的抑制作用。本研究中体外分离培养的大鼠髓核细胞在贴壁后增殖迅速,在使用25 mmol/L葡萄糖培养48 h后,髓核细胞的增殖明显受抑,且随着时间的延长,抑制作用逐渐加强;而15、5 mmol/L浓度的葡萄糖对大鼠髓核细胞增殖的影响差异无统计学意义;提示髓核细胞对葡萄糖浓度存在耐受阈值,超过这个阈值后其增殖会受到抑制,而在此阈值之下增殖并未受到明显影响。
在正常椎间盘中,细胞外基质处于不断降解和合成的动态平衡中。基质降解酶与其抑制剂的表达失衡是椎间盘退变的重要原因之一[10-11]。在椎间盘中,MMP和ADAMTS是主要的基质降解酶。研究[12-14]发现,血糖升高会导致血清MMP水平增高,从而影响MMP与其抑制剂TIMP的平衡,进而增强细胞外基质的降解。Won等[15]发现糖尿病模型大鼠椎间盘组织内MMP的表达较非糖尿病大鼠显著增强,从而间接证实糖尿病与椎间盘退变存在联系。我们的研究结果也显示:25 mmol/L组的髓核细胞MMP-3和MMP-13表达上升,同时细胞培养液中CTX-Ⅱ质量浓度增加;而ADAMTS-4的表达并无明显变化。这提示我们,高糖环境对基质降解酶的调控主要针对MMP。不仅如此,高糖环境对髓核细胞的基质合成也可能存在一定影响。Robinson等[5]发现,合并糖尿病的腰椎间盘突出症患者髓核中蛋白聚糖的含量较非糖尿病患者减少。作为髓核组织细胞外基质的主要成分之一,蛋白聚糖的减少与基质含量减少直接相关。我们的研究也证实高糖环境能够显著减少大鼠髓核细胞Ⅱ型胶原蛋白和蛋白聚糖mRNA的表达。结合上述研究结果,我们认为高糖环境可以通过抑制基质合成及增加基质降解两条途径来减少髓核细胞胞外基质含量。
P38是MAPK信号通路的成员之一,已有研究[16-17]证实其与椎间盘基质代谢关系密切;P38抑制剂能够显著改善由炎症因子引起的基质分解增加与合成下降。Cheng等[7]证实高糖环境能够诱发大鼠髓核细胞P38磷酸化,进而引起细胞氧化应激和凋亡增加。我们也发现25 mmol/L组大鼠髓核细胞中P38磷酸化水平提高。这一结果与髓核细胞的基质变化相符,提示P38在髓核细胞对高糖环境的反应中起了重要作用。
综上所述,高浓度葡萄糖可抑制大鼠髓核细胞的生长,并通过抑制基质合成及增加基质降解两条途径来减少髓核细胞胞外基质含量,从而导致椎间盘的退变;这一变化可能与P38磷酸化程度有密切关系。未来可以针对这一方向展开进一步研究,从而明确高糖环境对髓核细胞基质代谢调控的具体作用机制。

