柱后衍生化-HPLC法测定硫酸卡那霉素注射液及滴眼液的含量
张杨慧 蒋孟虹 秦峰 刘浩,*
(1 中国医药工业研究总院,上海 201203;2 上海市食品药品检验所,上海 201203)
卡那霉素(kanamycin)属于2-脱氧链酶胺双取代衍生物类的氨基糖苷类抗生素,由卡那霉素链霉菌(Streptomyces kanamyceticus)所产生,具有广谱抗菌作用[1](主成分卡那霉素A及其主要杂质化学结构如图1所示),尤其对革兰阴性菌及青霉素、链霉素、红霉素等产生耐药性的金黄色葡萄球菌、大肠埃希菌、产气杆菌、肺炎杆菌和痢疾杆菌有很强的抗菌作用。Umezawa[2]于1957年发现卡拉霉素,1958年由日本明治制果药业株式会社首先开发生产,国内于1965年从云南西双版纳土壤中分离得到卡那霉素链霉菌,并研究试制成功国产的卡那霉素。
卡那霉素缺乏特征的紫外吸收[3],中国药典2015年版二部规定采用HPLC-蒸发光散射检测(ELSD)法测定硫酸卡那霉素注射液和滴眼液的含量[4]。ELSD具有通用性强、价格低廉、维护要求低等优点,但由于ELSD法的重现性较差,灵敏度较低,且流动相中所含的多氟羧酸类离子对试剂酸性较强,影响色谱柱填料的稳定性,不利于长期应用。美国药典第40版使用HPLC-电化学检测的方法进行含量测定[5]。虽然电化学检测方法具有灵敏度高的优点,但仪器昂贵,对操作人员的技术水平要求较高,较难作为常规检测方法使用。
柱后衍生化技术是一种常用的在线处理技术,具有不改变被分离组分的色谱行为、在流动相试剂的选择上限制较小、可以实现自动化在线衍生、具有良好的重现性等优点,已在硫酸异帕米星注射液、妥布霉素滴眼液等氨基糖苷类抗生素的含量测定中有应用[6-7]。本文参考文献[6-7]建立的高效液相色谱-柱后衍生化-荧光检测法灵敏度高,操作简便快速,结果准确可靠,可作为硫酸卡那霉素注射液及滴眼液含量测定的方法。
1 仪器与材料
仪器:Agilent 1100高效液相色谱仪,荧光检测器,Pickering PCX 5200柱后衍生化系统。
庚烷磺酸钠(色谱纯)由东京化成工业株式会社提供;乙腈(色谱纯)由Merck公司提供;冰醋酸、无水硫酸钠、硼酸、氢氧化钠和2-巯基乙醇(分析纯)由上海凌峰化学试剂有限公司提供;邻苯二甲醛(色谱纯)由北京百灵威科技有限公司提供;水为高纯水。
硫酸卡那霉素对照品(批号:130556-201502,中国食品药品检定研究院);卡那霉素B对照品(批号:130548-200501,中国食品药品检定研究院)(发酵副产物);6-O(3-氨基-3-脱氧-α-d-葡吡喃糖基)脱氧链霉胺(批号:7-APD-119-1,Toronto Research Chemicals)(降解产物);硫酸卡那霉素注射液[批号:1612152,A公司;批号:1701170121,B公司;批号:1703021,C公司;批号:1701191,D公司;批号:151027,E公司];硫酸卡那霉素滴眼液(批号:170203,170202,F公司)。
2 方法
2.1 色谱分离条件
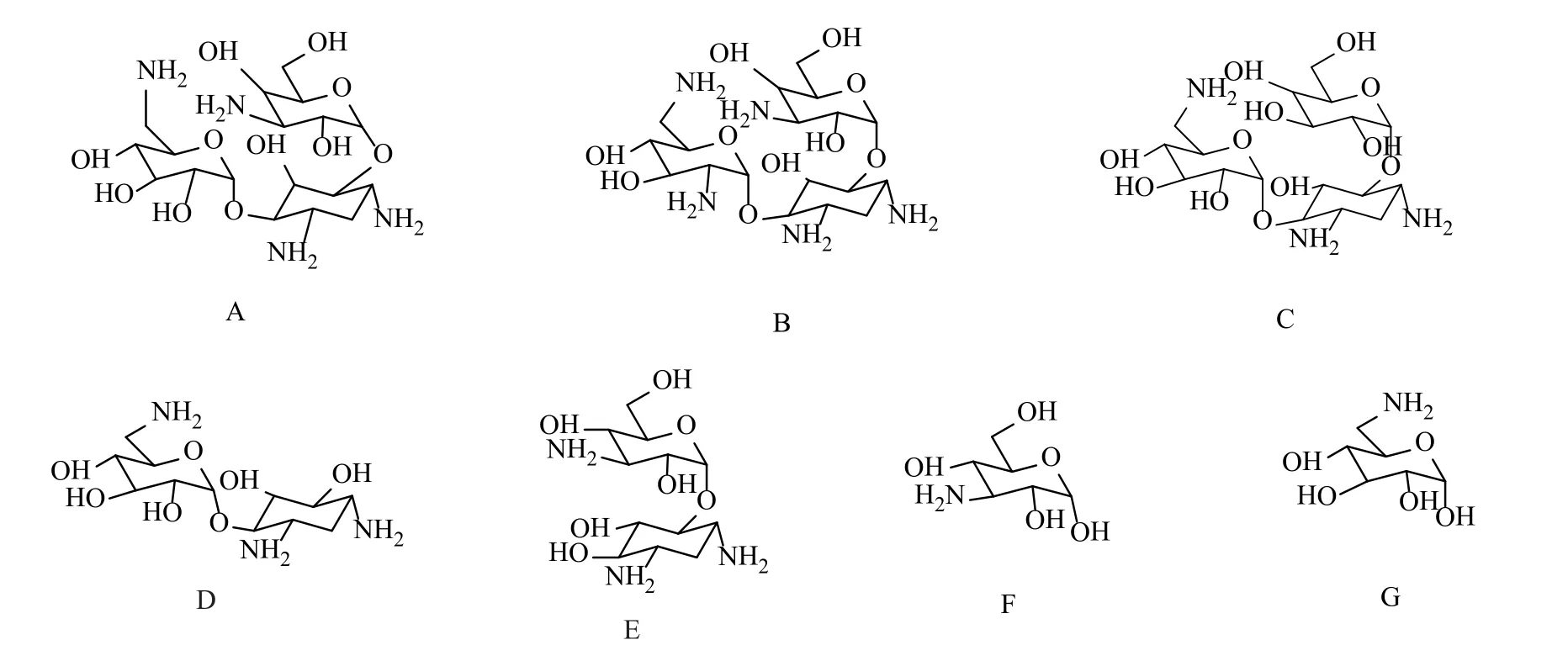
图1 卡那霉素A及其主要杂质结构Fig.1 Chemical structures of kanamycin A and its chief related compounds
色谱柱Zorbax Eclipse Plus C18(4.6mm×100mm,3.5μm);流动相:pH3.4的缓冲液(取庚烷磺酸钠一水合物4.35g和无水硫酸钠16g,加水溶解并稀释至1000mL,用冰醋酸调节pH值至3.4±0.1)-甲醇(74:26);流速:1mL/min;柱温35℃;样品室温度4℃;进样体积:5μL。
2.2 衍生化条件
衍生化试剂[取邻苯二醛0.8g、甲醇300mL、2-硫基乙醇2mL和硼酸盐缓冲液(称取72.0g硼酸和43.0g氢氧化钠,加水溶解并稀释至4000mL,用1mol/L硼酸溶液或1mol/L氢氧化钠溶液调节pH值至10.4±0.1)700mL,混匀,用0.45μm滤膜过滤]的流速为0.3mL/min;衍生化反应温度:45℃;荧光检测器激发波长:340nm,发射波长:455nm。
2.3 溶液的配制
系统适用性溶液:取卡那霉素对照品约10mg,置于50mL量瓶中,加2mol/L盐酸溶液5mL,振摇使混合均匀,水浴加热30min,使卡那霉素A部分降解产生杂质3和杂质4,用2mol/L氢氧化钠溶液5mL中和,加卡那霉素对照品25mg和卡那霉素B对照品5mg,振摇使溶解,用水稀释至刻度,摇匀,作为系统适用性溶液。精密量取系统适用性溶液5μL,注入液相色谱仪,记录色谱图,结果表明,卡那霉素A与卡那霉素B之间能完全分离(分离度大于7.0),主峰与前相邻杂质峰也有效分离(分离度大于2.0)(图2)。
供试品溶液:精密量取硫酸卡那霉素注射液适量,加水定量稀释制成约含卡那霉素0.5mg/mL的溶液。精密量取硫酸卡那霉素滴眼液适量,加水定量稀释制成约含卡那霉素0.5mg/mL的溶液。
对照品溶液:精密称取硫酸卡那霉素对照品适量,加水溶解并定量稀释制成约含卡那霉素0.5mg/mL的溶液。
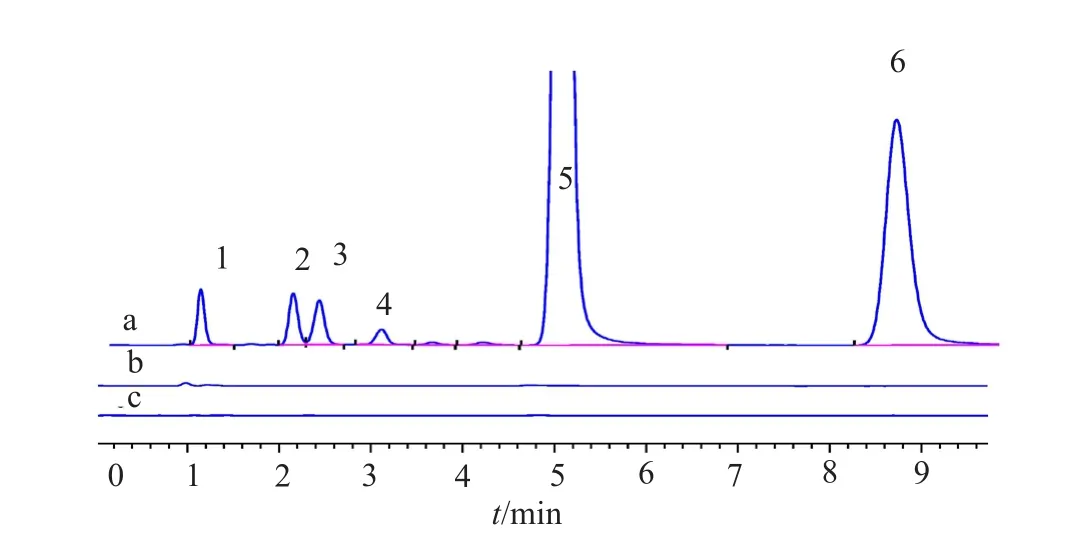
图2 系统适用性溶液(a)、注射液空白辅料溶液(b)和滴眼液空白辅料溶液(c)典型色谱图Fig.2 Typical chromatograms for system suitability solution (a),injection solution of blank (b) and eye drops solution of blank (c)
3 方法学验证
3.1 专属性
分别取硫酸卡那霉素注射液及滴眼液空白辅料按“2.1”项下色谱条件进样分析。色谱图如图2所示。结果表明流动相及空白辅料均对卡那霉素主峰及杂质峰无干扰,表明方法的专属性良好。
精密量取硫酸卡那霉素注射液适量,加水定量稀释制成约含卡那霉素5mg/mL的溶液,作为硫酸卡那霉素注射液样品储备液;硫酸卡那霉素滴眼液原液即为其样品储备液;分别取样品储备液1mL进行强酸、强碱、高温、光照、氧化破坏,并用纯水稀释制成约含卡那霉素0.5mg/mL的溶液。按“2.1”项下色谱条件进样分析。色谱图如图3所示。主峰与降解杂质峰之间均分离良好,新建方法的专属性良好。
3.2 重复性
精密量取同一批号的硫酸卡那霉素注射液6份,按“2.3”项下方法配制成供试品溶液,按“2.1”项下色谱条件测定其含量,按外标法以峰面积计算,平均含量为102.4%,RSD=0.75%(n=6);同法对硫酸卡那霉素滴眼液的含量测定方法进行重复性考察,平均含量为104.9%,RSD=0.66%(n=6),结果表明该方法重复性良好。
3.3 回收率
精密称取硫酸卡那霉素对照品适量(约相当于卡那霉素20、25和30mg),各3份,分别置于50mL量瓶中,并按100%比例加入辅料,加水溶解,作为80%、100%和120%的注射液供试溶液,按“2.1”项下的色谱条件测定含量,3个浓度水平下平均回收率分别为100.1%、99.8%和98.9%,RSD=0.63%(n=9);同法对硫酸卡那霉素滴眼液的含量测定方法进行回收率考察,3个浓度水平下平均回收率分别为99.8%、98.9%和99.3%,RSD=0.66%(n=9),结果表明该方法回收率良好。
3.4 线性与范围
精密称定对照品适量置于25mL量瓶中,加水溶解并稀释至刻度,摇匀,作为对照品储备液。分别精密量取对照品储备液适量,制成系列浓度分别为0.0973、0.973、9.73、97.3、243.3、486.5和583.8μg/mL的对照品溶液。按“2.1”项下的色谱条件测定,以卡那霉素A峰面积A对浓度C进行线性回归,得回归方程:A=11.99C+15.73,r=0.9999。结果表明,卡那霉素A在0.0973~583.8μg/mL的范围内与卡那霉素A峰面积呈良好线性。
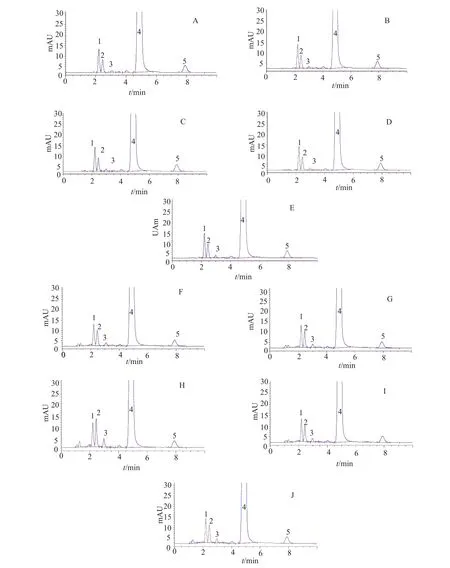
图3 硫酸卡那霉素注射液(A~E)和滴眼液(F~J)专属性试验色谱图Fig.3 HPLC chromatograms for specificity test of kanamycin sulfate injection and eye drops
3.5 检测限与定量限
以信噪比S/N=3计,卡那霉素A的检测限为0.12ng;以信噪比S/N=10计,卡那霉素A的定量限为0.39ng(以进样5μL计)。
3.6 稳定性
取供试品溶液,分别在0、6和18h进样分析考察溶液的稳定性,按外标法以峰面积计算,硫酸卡那霉素注射液平均含量为101.3%,RSD为1.42%(n=3),滴眼液平均含量为106.4%,RSD为2.26%(n=3),结果表明溶液在18h内稳定。
3.7 耐用性
分别考察了供试品溶液在Zorbax Eclipse plus C18(10cm×0.46cm, 3.5μm, 1.0mL/min)、COSMOSIL C18(25cm×0.46cm, 5μm, 1.5mL/min)和Tskgel ODS-100S(25cm×0.46cm, 5μm, 1.5mL/min)3种不同品牌填料的色谱柱上的分离情况,结果各杂质峰均能和卡那霉素主峰得到有效分离,本方法的耐用性较好。
3.8 样品测定
按“2.3”项下方法分别制备供试品溶液及对照品溶液,按“2.1”项下色谱条件分别进样,依照外标法计算含量,与2015版中国药典二部[8]项下方法对比,结果见表1。结果表明本文所建立的高效液相-柱后衍生化-荧光检测法测得的含量与HPLC-ELSD法(药典方法)测得的含量基本一致。

表1 LC-柱后衍生化法与LC-ELSD法测定硫酸卡那霉素注射液及滴眼液含量结果的对比Tab. 1 Comparative study on the results of contents obtained from post column derivatization and ELSD in kanamycin sulfate injection and eye drops
4 新建立方法和中国药典方法的比较
按中国药典方法试验[4],以信噪比S/N=3计,硫酸卡那霉素检测限约为22.9ng,比柱后衍生化-HPLC法低近200倍。柱后衍生化-HPLC法较HPLC-ELSD法灵敏度高。
按中国药典方法试验[4]发现,硫酸卡那霉素中有3个杂质会同时洗脱,如图4所示,HPLC-ELSD系统分离所得编号为2的杂质实为HPLC-柱后衍生化系统中3个杂质的混合物。柱后衍生化-HPLC法较HPLCELSD法分离能力高。
5 讨论
5.1 色谱条件的优化
由于硫酸卡那霉素极性较强,在反相色谱条件下保留较弱,本研究在流动相中加入离子对试剂,从而使被测组分在色谱柱上有适当的保留。考察了己烷磺酸钠,庚烷磺酸钠,辛烷磺酸钠3种离子对试剂。结果显示,随着烷基链的延长,卡那霉素及其有关物质保留均增强,考虑到分析时间的合理性,选择庚烷磺酸钠作为离子对试剂。

图4 HPLC-ELSD系统(a)与HPLC-柱后衍生化-荧光检测系统(b)各色谱峰保留行为典型色谱图Fig.4 HPLC chromatograms of impurities in ELSD (a) and post column derivization systems (b)
本试验考察了30、35和40℃不同色谱柱温对色谱分离的影响。试验发现,色谱柱温越低,容量因子越大,色谱峰保留时间越长,综合考虑保留时间,对称因子,分离度等因素,选择色谱柱温度为35℃。
本试验考察了流动相中有机改性剂的种类对定量分析的影响。选择了甲醇和乙腈两种有机改性剂,结果显示,虽然乙腈的洗脱能力强于甲醇,但以乙腈为有机溶剂的色谱系统,其主峰拖尾严重,不利于定量分析。考察了不同比例的甲醇对色谱行为的影响,在主峰与相邻杂质峰得到有效分离的前提下,甲醇比例越高,主峰保留越弱,综合考虑对称因子,理论塔板数,保留时间等因素,确定缓冲液与甲醇比例为74:26。
5.2 柱后衍生化条件的优化
在柱后衍生化试剂的选用时要考虑到衍生化产物的溶解度,衍生化试剂与流动相及制剂辅料可能发生的副反应等因素。常用的衍生化试剂有邻苯二甲醛(o-phthalaldehyde, OPA)[6-7]、2,4-二硝基氟苯(DNFB)[8]、2,4,6-三硝基苯磺酸(TNBS)[9]等。本研究中采用的柱后衍生化试剂为含有2-巯基乙醇和邻苯二甲醛的溶液,其反应机制主要是在巯基乙醇的存在下,伯氨基与邻苯二甲醛快速反应生成强荧光性吲哚取代衍生物,被荧光检测器检测。由于硫酸卡那霉素注射液和硫酸卡那霉素滴眼液中所含有的辅料[抗氧剂(亚硫酸氢钠),等渗调节剂(氯化钠),抑菌剂(羟苯乙酯),缓冲剂(硼砂-硼酸体系),络合剂(依地酸二钠)等]均不含有伯胺类物质,所以辅料对主药的测定不产生干扰。
本试验考察了0.3、0.5和0.7mL/min衍生化试液的流速对衍生化情况的影响。试验中发现衍生化试液的流速对色谱峰响应的影响较小,且流速越快,柱后压力越大,考虑到衍生化试液的使用量及柱后压力的影响,选择柱后衍生化试液流速为0.3mL/min。
6 结论
本文建立的高效液相色谱-柱后衍生化-荧光检测法操作简便、抗干扰性强、柱效高、分离能力强、灵敏度高、准确度和精密度好,可弥补HPLC-ELSD法灵敏度较低,分离能力较差的缺点,可作为硫酸卡那霉素注射液和滴眼液的含量测定方法,有效控制硫酸卡那霉素的质量。

