甲状旁腺素联合骨髓间充质干细胞对骨质疏松大鼠股骨颈骨密度相关指标的影响
张泽华,霍建忠,郭耀,季兴华
(山西医科大学附属大医院骨科,太原 030001)
骨质疏松症是因骨量丢失、骨强度降低及骨微观结构改变从而增加了脆性骨折风险的一种疾病,它给医学带来了挑战并对社会经济造成了威胁。骨质疏松患者的终生骨折风险高达40%,而发生骨折最常见的部位为脊柱、髋部及手腕,其他部位也可发生,如肱骨、肋骨等[1]。骨质疏松症的药物治疗主要分为两类,一类为促骨形成类药物,如甲状旁腺素(parathyroid hormone, PTH),代表药物特立帕肽;另一类为抗骨吸收药物,如双磷酸盐类[2]。从细胞水平、动物实验及患者临床的应用方面,单纯应用PTH治疗骨质疏松的有效性已被证实[3-5],但PTH联合用药存在局限性,如不推荐与抗骨吸收类药物联用[6],是否能寻找另一种非药物途径来联合PTH进行骨质疏松治疗是一个亟待解决的临床问题。骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)广泛存在于人体骨髓及松质骨中,可在体内进行自我复制,并成为骨组织修复以及相关疾病的治疗选择[7]。BMSCs具有多向分化能力,目前在体外的提纯与扩增技术已成熟。基于上述背景,本研究在体外构建组织工程扩增BMSCs,再将其注入骨质疏松大鼠模型的股骨颈内,随后单独或联合使用PTH,通过Micro-CT测量反映骨密度的相关指标变化,初步研究BMSCs联合PTH对骨质疏松性大鼠的局部成骨效果。
1 材料与方法
1.1 试剂与设备
大鼠雌激素ELISA试剂盒(美旋生物科研试剂上海有限公司);水合氯醛(天津盛鑫源化学试剂有限公司);胎牛血清(ScienCell生命科技有限公司);DMEM/F12 1∶1培养基、无菌PBS溶液、青霉素-链霉素双抗溶液、含EDTA的0.25%胰蛋白酶(武汉博士德生物工程有限公司);成骨细胞诱导液 (Cyagen Biosciences,美国);Rat PTH 1-34(默克生命科学上海有限公司);全波长酶标仪Eppendorf(中国生命科技有限公司);Micro-CT(SCANCO Medical AG Inc,瑞士)。
1.2 实验动物及骨质疏松模型构建
SD IGS雌性大鼠50只,2月龄,SPF级,体质量(210±20)g,饲养于山西医科大学实验中心动物房,正常摄食、进水。将50只雌性大鼠按随机数字表法分为A、B、C、D、E 5组,每组10只。浓度8%水合氯醛腹腔麻醉,B、C、D、E组经大鼠腰背部切口进入腹腔切除双侧卵巢, A组仅切除卵巢周围同等大小的脂肪组织。手术后12周,分别在每组按抽样检验法抽取3只大鼠,心脏穿刺取血液2 ml,1000转/min离心10 min,收集血清加入大鼠雌激素试剂盒,450 nm酶标仪测定各孔吸光度值,分别计算各组大鼠雌激素平均浓度。随后将每组抽取的3只大鼠处死,采用Micro-CT检测股骨颈的骨密度相关指标,即骨小梁数量(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness, Tb.Th)、骨小梁分离度(trabecular separation, Tb.Sp)和骨体积分数(bone volume to tissue volume,BV/TV)。
1.3 BMSCs培养与鉴定
健康SD IGS雄性大鼠5只,4周龄,SPF级,平均体质量80 g,相关指标符合实验动物标准。脱颈法处死,碘伏全身浸泡消毒5 min,超净工作台上分离双侧股骨,剪掉两端骨骺,用含10%FBS的DMEM/F12 1∶1完全培养基冲出骨髓至15 ml离心管中,反复吹打,1000转/min离心3 min,弃上清,加入8 ml完全培养基吹打混匀后接种在4个25 cm2规格的培养瓶中, 4 ml/瓶,置37℃、5%CO2浓度的培养箱中培养。48 h后半量更换培养基,以后每3 d全量更换新鲜培养基。待细胞铺满培养瓶底至细胞融合成单层、密度为80%~90%时,用0.25%胰酶消化,按1∶2的比例进行传代培养。待传至P3代时,选择生长状态良好的细胞至离心管,0.25%胰酶消化,4℃离心,1000转/min,离心3 min,用PBS(含1%胎牛血清)充分洗涤细胞3次,重悬细胞,各管依次加入单克隆抗体CD34、CD45、CD29、CD90,流式细胞仪进行检测分析。
1.4 术后干预
术后12周,每组剩余7只大鼠。A、B组不做干预处理,其中B组为骨质疏松空白对照组;C组按60 μg/kg剂量背部皮下注射Rat PTH 1-34,隔日1次[8],连续注射12周(PTH干预组);D组显露双侧股骨颈,采用旋转进针法注入0.5 ml浓度为5×108/ml的BMSCs(BMSCs干预组);E组在D组基础上背部皮下注射Rat PTH 1-34,注射浓度、频率与C组一致(PTH联合BMSCs干预组)。
1.5 干预后大鼠股骨颈骨密度相关指标变化
各组剩余大鼠均在干预12周后处死。大鼠经解剖、分离双侧股骨,小心剔除周围肌肉后经Micro-CT检测Tb.N、Tb.Th、Tb.Sp及BV/TV,并行三维图像重建。
1.6 统计学处理

2 结 果
2.1 骨质疏松大鼠模型鉴定
术后12周,A组大鼠雌激素浓度为(496.2±14.7)ng/L,B、C、D及E组大鼠雌激素浓度分别为(361.7±17.3)、(359.3±15.3)、(362.8±13.9)和(360.9±16.5)ng/L,与A组比较,B、C、D及E组雌激素水平均显著下降,差异有统计学意义(P<0.05),但B、C、D及E组间差异不明显(P>0.05)。Micro-CT检测5组股骨颈骨密度相关性指标发现,A组Tb.N、Tb.Th、BV/TV均明显高于其余4组,Tb.Sp明显低于其余4组,差异均有统计学意义(P<0.05),但B、C、D、E组各组间骨密度相关性指标结果差异无统计学意义(P>0.05;表1)。由此可以证明B、C、D、E组骨质疏松大鼠模型建立成功[9]。
2.2 BMSCs形态与鉴定
BMSCs接种24 h后观察可见部分细胞贴壁,48 h后光镜下可见培养瓶底部有少量梭形细胞,高倍镜下核仁清晰可见。3 d后再次换液可见密集的细胞团,呈漩涡状(图1)。传代后细胞贴壁较原代快,形态均匀,生长迅速。流式细胞技术单标法显示,P3代细胞表达CD29(99.86%)、CD90(99.73%),几乎不表达CD34(6.48%)、CD45(0.94%)(图2),表明本研究成功获取并培养了BMSCs。
2.3 干预12周后骨密度相关指标变化
Micro-CT数据显示,单独使用PTH、注入BMSCs及联合使用二者均可改善骨微观结构,但均未达到与A组相似的正常水平。与B组比较,C、D、E组的Tb.N、Tb.Th及BV/TV显著增加,Tb.Sp显著下降,差异有统计学意义(P<0.05);与C或D组比较,E组Tb.N、Tb.Th及BV/TV亦显著增加,Tb.Sp显著下降,差异有统计学意义(P<0.05;表2)。各组Micro-CT骨形态学三维重建见图3。
3 讨 论
随着“老年世纪”的到来,如何有效治疗骨质疏松症已成为当前临床的热点问题,而成功构建骨质疏松的动物模型是实验进行的关键一步。切除卵巢后的大鼠模型与绝经后女性在骨质疏松生理变化过程上相似,已成为建立骨质疏松的经典模型之一[10]。
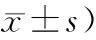
表1 术后12周各组大鼠股骨颈Micro-CT检测数据
A: sham operation group; B: osteoporosis group; C: PTH intervention group; D: BMSCs intervention group: E: PTH-BMSCs intervention group. Tb.N: trabecular number; Tb.Th: trabecular thickness; Tb.Sp: trabecular separation; BV/TV: bone volume to tissue volume. Compared with group A,*P<0.05.

图1 原代培养BMSCs的光学显微镜观察

图2 大鼠BMSCs流式细胞技术鉴定
A: sham operation group; B: osteoporosis group; C: PTH intervention group; D: BMSCs intervention group: E: PTH-BMSCs intervention group. Compared with group A,*P<0.05; compared with group B,#P<0.05; compared with group C,△P<0.05; compared with group D,▲P<0.05.
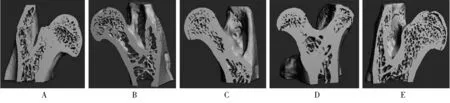
图3 各组大鼠股骨颈三维重建图像
在正常的人体骨髓中,主要有两类细胞,即起源于造血干细胞的造血细胞和起源于BMSCs的间充质细胞[11]。BMSCs具有自我更新的多向分化潜能,在实验室中不同的诱导条件下,BMSCs可分化为成骨细胞、成脂细胞、成软骨细胞等,其数量与活性在骨组织重建及维持骨量、增强骨密度等方面起着至关重要的作用[12]。有研究表明[13],老年人群中BMSCs的增殖与分化能力均有不同程度下降,导致骨形成速度减慢,其直接后果是骨量的丢失和骨微结构的破坏,这与骨质疏松的病理观察相符。经典胚胎学研究和体外成体器官研究表明,微环境在干细胞的自我更新和分化中起着决定性作用[14]。本实验结果也表明,与骨质疏松空白对照组比较,BMSCs干预组及BMSCs联合PTH干预组中Tb.N、Tb.Th及BV/TV显著增加,Tb.Sp显著下降,差异有统计学意义(P<0.05),这与文献报道一致[15]。但如何使注入的BMSCs更多地向成骨方面增殖、分化将是今后在研究详细机制方面的热点与难点。
目前,一种人工合成的PTH已被美国食品药品管理局批准,其促骨形成药物已在临床上使用多年。PTH对骨代谢有双重调节效应,即小剂量间断性应用PTH能促进骨髓干细胞向成骨细胞的增殖、分化[16],而大剂量连续使用则会上调核子-κB 受体活化因子配体的表达,降低骨保护素的表达,促进破骨细胞的生成并增强其活性,导致骨吸收。本研究选择去势大鼠来模拟临床上的绝经后骨质疏松妇女,随后施加小剂量间断性PTH(药物治疗)与局部注射BMSCs(细胞治疗)干预,通过Micro-CT骨形态参数对比PTH与BMSCs单独或联合使用对骨质疏松的改善作用。实验结果显示,单独使用PTH或BMSCs均可以提高Tb.N、Tb.Th及BV/TV,降低Tb.Sp等相关骨性指标,且二者联合使用在抑制骨质疏松大鼠骨量丢失、改善骨微观结构等方面总体效果更好,但其具体机制目前尚不清楚。查阅文献[17,18],我们推测大体机制如下。体外培养的BMSCs经局部注射后,在骨髓微环境及基质中各种因子的作用下进行自我扩增并向成骨方向分化,这一过程使得注射部位骨量及骨骼强度增加。而PTH则是一种能促进BMSCs向成骨方向分化的重要激素,可通过与成骨细胞表面受体结合,激活cAMP/Ca2+/蛋白激酶C/磷酯酶C等信号通路,增强Ⅰ型胶原等成骨相关基因的表达,刺激成骨细胞的活性,从而促进骨再生,提高骨转换指标,增加新骨的形成,迅速增加骨量,进而提高骨密度,降低发生骨折的风险。
综上,PTH联合BMSCs对骨质疏松大鼠模型的干预效果比单独使用二者效果显著。本研究创新点在于这种联合治疗的方法弥补了临床上对骨质疏松患者无合适联合药物治疗的局限,并已显示出传统治疗方法不可比拟的优势,随着研究的不断深入,相信该联合治疗方法将会为临床上越来越多的骨质疏松患者提供治疗选择。但也存在不足之处,如股骨颈注入BMSCs时无特定专用器械致细胞损失,缺乏相应的植入细胞标记及细胞植入后的活体示踪等,需在今后的研究中继续探讨改进,并尝试在椎体、胫骨等多部位注射进行验证。

