高产小麦品种郑麦7698花后光合特性研究
金立桥,胡 琳,张子山,赵世杰,高辉远,齐学礼
(1.河南科技学院 小麦研究中心,河南 新乡 453003; 2.山东农业大学 生命科学学院/作物生物学国家 重点实验室, 山东 泰安 271018; 3.河南省农业科学院 小麦研究所,河南 郑州 450002)
郑麦7698是河南省农业科学院小麦研究所于2011年育成审定的高产强筋冬小麦品种,它具备高产潜力大、强筋优质、抗条锈病和白粉病、株型紧凑、叶型直立、抗倒伏等特点。近几年已经在河南、安徽、江苏和陕西等省累计推广达300万hm2,在14次大面积机收实打测产中有10次产量超过10 500 kg/hm2。与区试对照小麦品种周麦18相比,郑麦7698无论在经济产量还是生物产量上均显著高于后者[1]。研究表明,小麦籽粒灌浆主要依赖于叶片、茎和穗的光合作用[2-13],而小麦开花后光合作用对于小麦籽粒产量的形成尤为重要[14-16]。因此,阐明郑麦7698开花后光合特性,对理解郑麦7698高产机制有重要意义,对今后选育高产、高光效小麦品种具有指导意义。然而,由于小麦穗的特殊结构,在大田生长状态下,其光合速率的原位测定一直是个技术难题。此外,长期以来人们利用传统方法测定的小麦叶片光合速率也与小麦叶片在田间所处实际位置的光合速率存在较大的差异。小麦光合速率的传统测定方法是将小麦的光合器官(叶片)的一部分(光合功能最好的叶片部位)夹入光合仪的叶室中测定,并保持测定光(太阳光或人工光源)与被测叶片垂直。其存在以下几个问题:在比较不同品种时,利用某个器官一部分的光合能力来表示整个器官的光合能力会产生偏差;在比较不同器官光合能力时,由于不同器官的呼吸速率不同,尤其是穗有远高于叶片的呼吸速率,所以利用净光合速率来比较不同器官的光合能力时,会导致较大的误差甚至是错误的结论;在测定光合速率的过程中,由于改变了测定材料在田间的实际生长位置,也就改变了该光合器官的光照条件,尤其是现代品种的叶片都比较直立,除早、晚外,太阳光与叶片的夹角都远远小于90°,测定结果与实际情况就会有较大的出入,无法反映其在大田生长状态下的实际光合能力。为了解决以上问题,本研究使用特制叶室与CIRAS-3光合系统连接组成开放式气路,在整个测定过程中将整个穗和旗叶密闭到叶室中,同时保持穗和旗叶原来的生长位置,测定其总光合速率(净光合速率+呼吸速率)。该测定方法能够更客观地研究整个穗和旗叶在大田实际生长状态下的光合能力,这为客观地评价小麦器官的光合特性提供了切实可行的方法。目前,尚未见利用该方法测定小麦光合作用的报道。为此,选取河南省的区试对照品种周麦18与郑麦7698进行光合性能比较研究,分析郑麦7698高产原因,旨在为小麦高产育种提供理论指导。
1 材料和方法
1.1 试验材料及栽培条件
供试材料为小麦品种周麦18(区试对照品种)和郑麦7698(种子由河南省农业科学院小麦研究所提供)。试验在山东农业大学试验田(36°09′40″N、117°09′2″E)进行,试验田土壤为壤土,含有机质12 g/kg、速效磷13.2 mg/kg、速效钾78.5 mg/kg、速效氮83.1 mg/kg。2016年10月2日,将不同小麦品种播种在不同的小区,行距为20 cm,种植密度为250株/m2,小区面积为3 m×3 m,随机分布,每个品种3个重复,正常田间水肥管理。播种前,底施30.0 g/m2过磷酸钙、30.0 g/m2尿素、7.5 g/m2氯化钾。
1.2 测定项目及方法
1.2.1 光合有效辐射截获量 在大田条件下,于小麦开花期的6:00—18:00,在小麦冠层上方用AM-19LQ积分式光量子计(Avalon,USA),测定总入射光合有效辐射(Photosynthetically active radiation,PAR),记为PARtotal;在穗下部测定透过穗层的光合有效辐射,记为T1;同时在小麦冠层最下部测定透过整个小麦冠层的光合有效辐射,记为T2。测量过程中,光量子计与地面水平,且与行平行。每2 h测定一次,每次6个重复。计算光合有效辐射截获量,其中,整个冠层光合有效辐射截获量为:PARwhole=PARtotal-T2;穗层光合有效辐射截获量为:PARear=PARtotal-T1;穗下冠层光合有效辐射截获量为:PARleaf and stem=PARtotal-T1-T2。一天中整个冠层(Pwhole)、穗层(Pear)和穗下冠层(Pleaf and stem)的总光合有效辐射截获量计算公式如下。
Pi为6:00—18:00每个测定时间点的光合有效辐射截获量;T为2次测定之间的时间间隔。
1.2.2 小麦穗和旗叶总光合速率 将定制的圆柱形透明叶室(直径4 cm、长15 cm)与CIRAS-3光合测定系统(PP Systems,USA)连接组成开放式气路系统(图1),对小麦穗和旗叶总光合速率进行测定。分别在开花后0、6、12、18、24、30、36 d,随机选取6个穗和旗叶,于9:00—11:00,在实际生长条件下(自然光照、大气CO2浓度、大气相对湿度和大气温度),保持穗和旗叶在大田实际生长状态下的位置和夹角,测定小麦穗和旗叶净光合速率。在净光合速率测定后使用铝箔纸完全包裹叶室,使待测器官处于完全黑暗条件下,10 min后测定其暗呼吸速率。总光合速率=净光合速率+暗呼吸速率的绝对值。
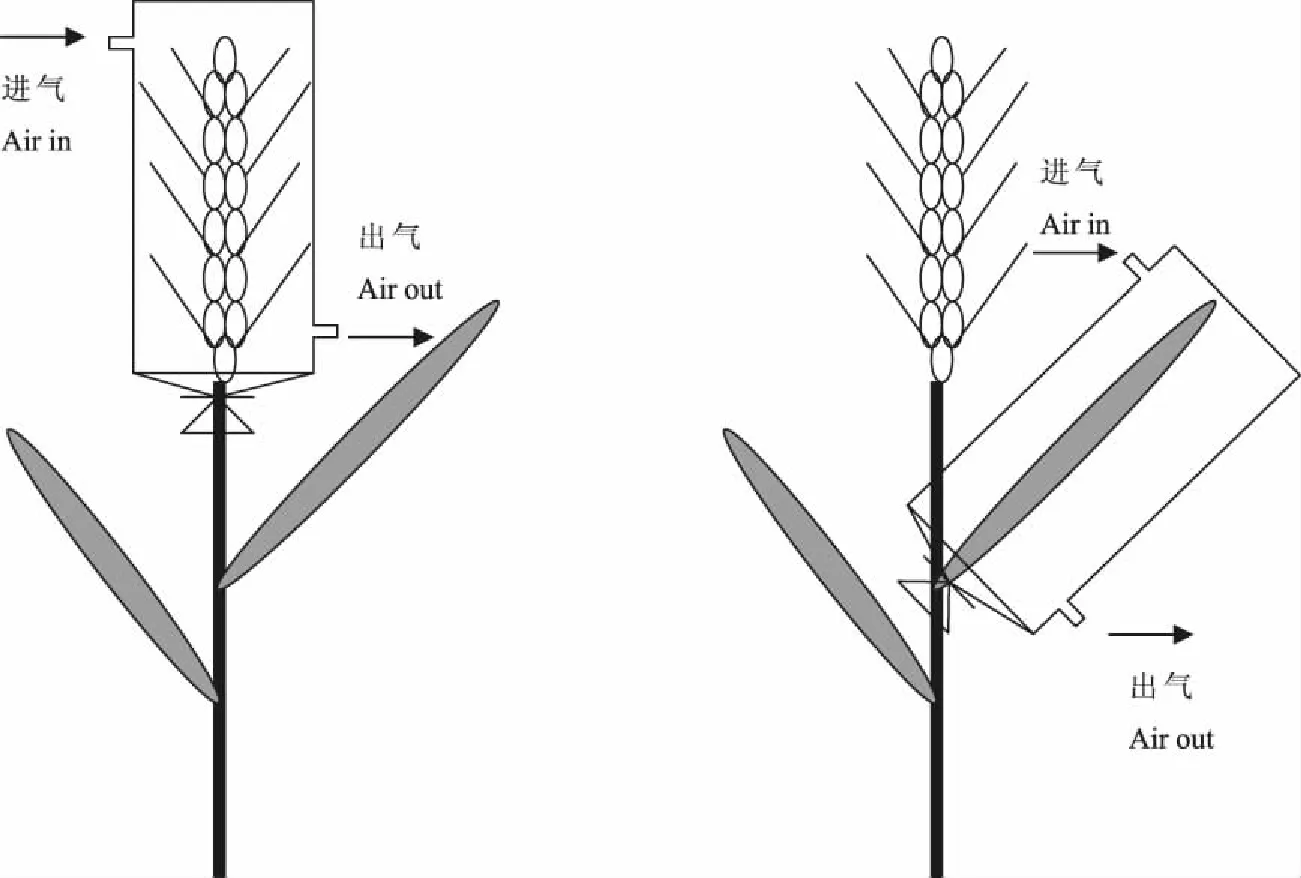
图1 定制叶室原位测定小麦叶片和穗光合速率的示意图Fig.1 The scheme of the measurement of a whole leaf and ear of wheat in situ with a specialized chamber
1.2.3 光合作用气体交换参数 开花后15、25 d,分别选取具有代表性的旗叶6片,根据旗叶长度从叶尖到叶柄将其平均分成前、中、后三部分,在叶温25 ℃、CO2浓度380 μmol/mol、光强1 400 μmol/(m2·s) (饱和光强)下,测定净光合速率。
开花后15、25 d,采用 CIRAS-3光合测定系统的控制系统将叶温和CO2浓度分别控制在25 ℃和380 μmol/mol,然后由CIRAS-3光合测定系统可调式光源按1 800、1 400、1 000、600、400、300、200、150、100 μmol/(m2·s)的顺序分别调节光强,测定光合-光强响应曲线,并根据光合-光强响应曲线计算出最大光合速率(Amax)和表观量子效率(AQY);将叶温和光强分别控制在25 ℃和1 400 μmol/ (m2·s) (饱和光强)下,采用可调式 CO2供气系统按1 800、1 600、1 400、1 200、1 000、800、600、400、300、200、100、50 μmol/mol的顺序分别提供CO2,绘制光合-CO2响应曲线,并根据光合-CO2响应曲线计算出最大羧化效率(Vcmax)以及RuBP最大再生速率(Jmax)。
1.2.4 旗叶叶绿素含量 开花后25 d,选取具有代表性的旗叶6片,根据旗叶长度从叶尖到叶柄将其平均分成前、中、后3部分,用ARNON[17]的方法测定叶绿素含量。
1.2.5 产量及其构成因素 小麦完全成熟后,在每个品种的3个小区中分别取2 m2的小麦,测定籽粒产量、生物学产量,调查穗粒质量、穗粒数及千粒质量,并计算收获指数。
1.3 统计分析
用SPSS 16软件中的t检验来分析数据间差异显著性。
2 结果与分析
2.1 郑麦7698和周麦18开花后不同时间穗和旗叶总光合速率的比较
由图2可知,开花后0~24 d,郑麦7698和周麦18旗叶总光合速率均维持在较高水平,之后大幅下降;在整个测定时期,郑麦7698旗叶总光合速率均显著高于周麦18。郑麦7698和周麦18穗总光合速率变化趋势与旗叶基本一致,开花后0~24 d,郑麦7698和周麦18穗总光合速率均维持在较高水平,之后大幅下降;但是郑麦7698穗总光合速率在开花后6~18 d显著高于周麦18,其余时间差异不显著。比较整个测定时期,郑麦7698旗叶总光合速率平均比周麦18提高40.0%,而郑麦7698穗总光合速率平均比周麦18提高17.2%。
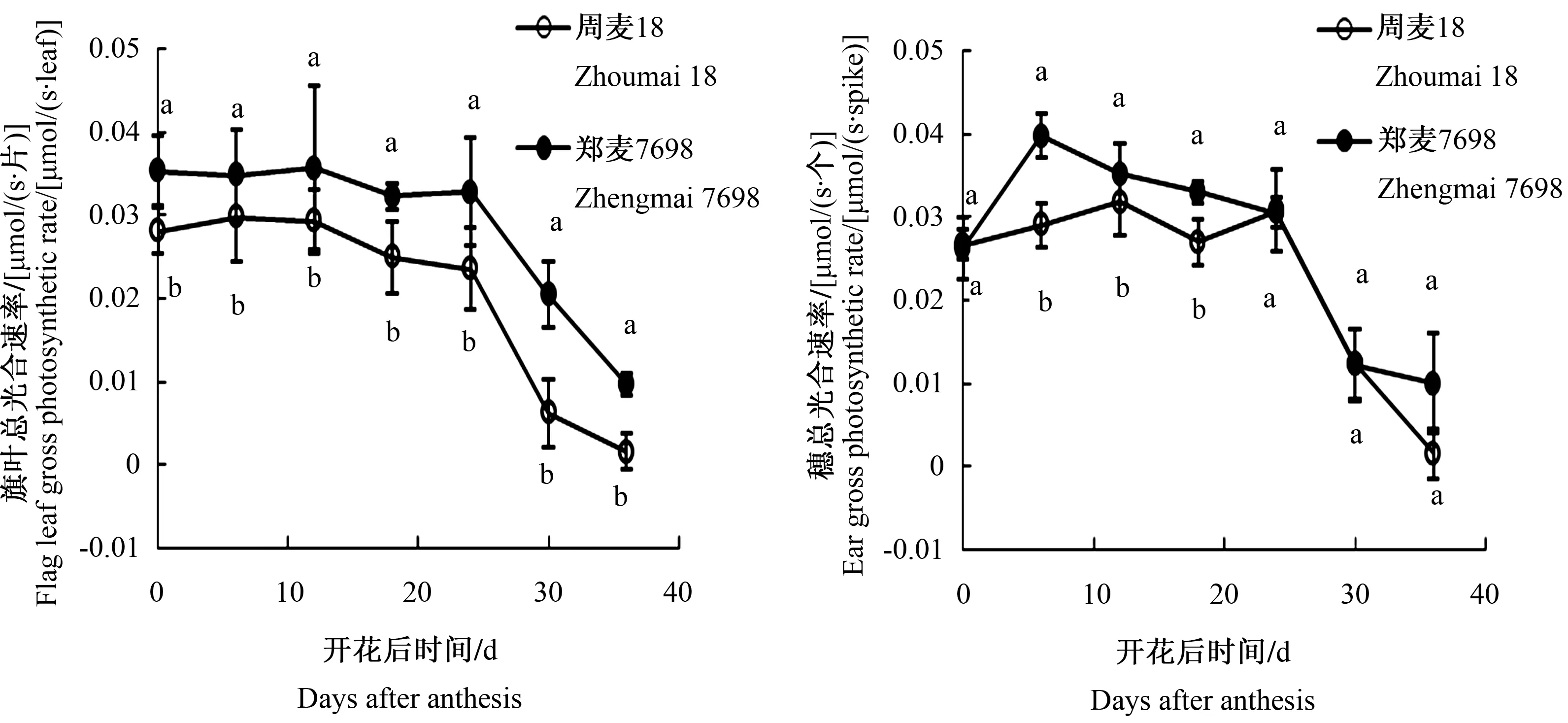
不同小写字母表示不同品种之间的差异显著(P<0.05),下同 Different letters indicate that the differences among Different cultivars reach significant level (P<0.05),the same below图2 郑麦7698和周麦18开花后不同时间穗和旗叶总光合速率比较Fig.2 The gross photosynthetic rates of flag leaf and ear of Zhoumai 18 and Zhengmai 7698 in different days after anthesis
2.2 郑麦7698和周麦18不同冠层光合有效辐射截获率比较
由图3可知,郑麦7698和周麦18整个冠层光合有效辐射截获率总体呈上升—下降—上升—下降的变化趋势,穗层光合有效辐射截获率总体呈先下降后上升的趋势,而穗下冠层光合有效辐射截获率总体呈先升高后下降的趋势;郑麦7698整个冠层和穗层的光合有效辐射截获率均高于周麦18,穗下冠层正好相反。郑麦7698与周麦18整个冠层的总光合有效辐射截获率无显著性差异,而郑麦7698穗层的光合有效辐射截获率显著高于周麦18,增幅达29.6%,而穗下冠层光能截获率显著低于周麦18。这表明,与周麦18相比,郑麦7698的穗层截获了更大比例的入射光能。因此,郑麦7698的冠层能够更有效地利用光能合成光合产物供籽粒灌浆。
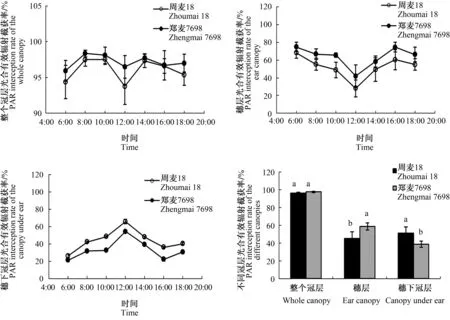
图3 周麦18和郑麦7698不同冠层光合有效辐射截获率比较Fig.3 The interception rates of PAR of different canopies of Zhoumai 18 and Zhengmai 7698
2.3 郑麦7698和周麦18开花后不同时间旗叶光合-光强响应曲线和光合-CO2响应曲线比较
在开花后15 d,郑麦7698和周麦18光合-光强响应曲线和光合-CO2响应曲线无显著差异;在灌浆后期,出现明显差异(图4)。从表1可以看出,开花后15 d,郑麦7698和周麦18的最大光合速率、表观量子效率、最大羧化效率以及RuBP最大再生速率均没有显著差异;但是到开花后25 d(灌浆后期),郑麦7698的最大光合速率、表观量子效率、最大羧化效率和RuBP最大再生速率均显著高于周麦18,提高幅度分别为23.3%、12.9%、48.4%、53.6%。这表明与周麦18相比,郑麦7698在灌浆后期能够维持更高的光反应和暗反应活性。
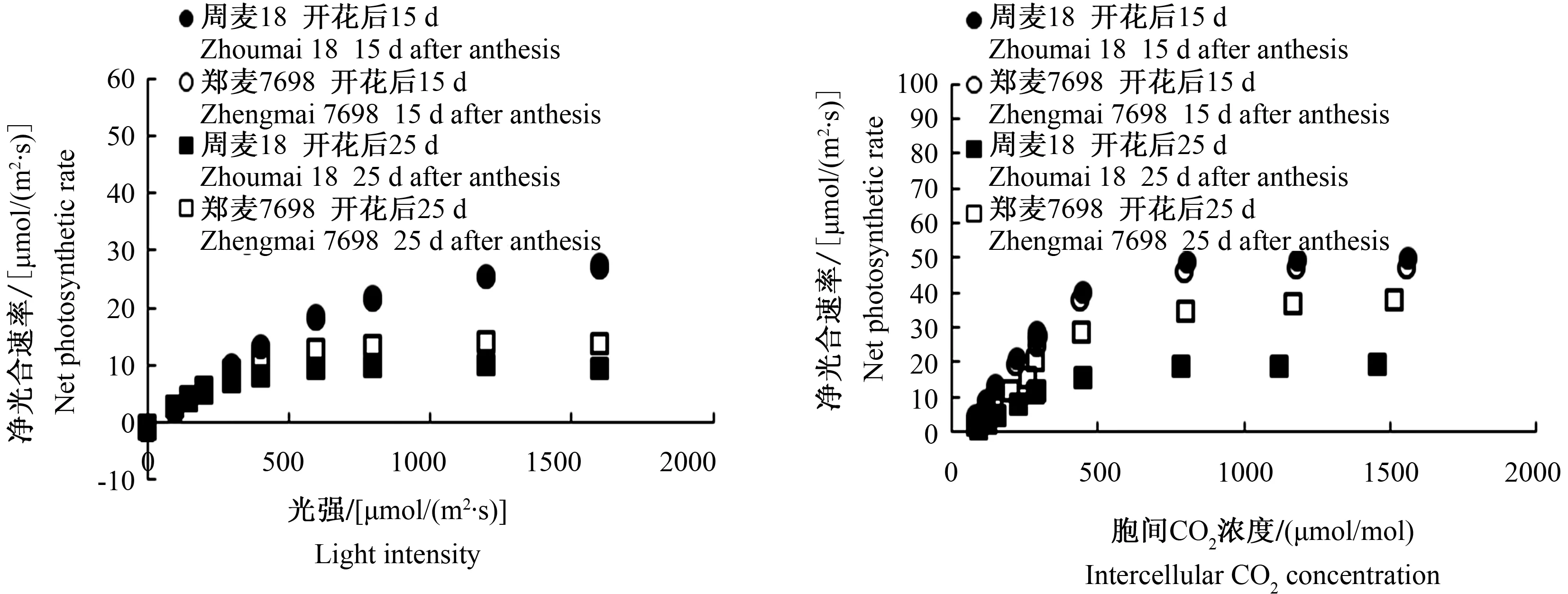
图4 周麦18和郑麦7698开花后不同时间旗叶光合-光强响应曲线和光合-CO2响应曲线比较Fig.4 The response curves of photosynthesis to different concentrations of CO2 and light intensities in flag leaves of Zhoumai 18 and Zhengmai 7698 in different days after anthesis表1 周麦18和郑麦7698开花后不同时间最大光合速率(Amax)、表观量子效率(AQY)、 羧化效率(Vcmax)及RuBP最大再生速率(Jmax)比较Tab.1 The maximum net photosynthetic rate (Amax),the apparent quantum yield (AQY),maximum carboxylation efficiency (Vcmax) and maximum regeneration rate of RuBP (Jmax) in Zhoumai 18 and Zhengmai 7698 in different days after anthesis

指标Indicators开花后15 d15 d after anthesis 周麦18Zhoumai 18郑麦7698Zhengmai 7698开花后25 d15 d after anthesis周麦18Zhoumai 18郑麦7698Zhengmai 7698Amax/[μmol/(m2·s)]31.3±2.4a31.6±3.5a11.6±0.8b14.3±0.1aAQY 0.043±0.001a0.041±0.002a0.031±0.002b0.035±0.002aVcmax/[μmol/(m2·s)]77.9±11.7a74.6±12.6a35.1±1.7b52.1±10.5aJmax/[μmol/(m2·s]95.6±14.5a91.5±15.7a43.5±2.6b66.8±12.8a
注:同行数据后不同小写字母表示不同品种之间的差异显著(P<0.05)。
Note:Different letters in the same line indicate that the differences among Different cultivars reach significant level (P<0.05).
2.4 郑麦7698和周麦18开花后25 d旗叶不同部位叶绿素含量和净光合速率比较
由图5可知,周麦18和郑麦7698在开花后25 d,旗叶不同部位表现出不同的衰老进程,郑麦7698旗叶衰老较慢。郑麦7698旗叶的叶绿素含量均显著高于周麦18,并且郑麦7698旗叶任何部位的净光合速率均显著高于周麦18。这表明7698旗叶叶绿素含量和光合功能的持续期远高于周麦18,是郑麦7698籽粒产量提高的一个重要因素。
2.5 郑麦7698和周麦18产量及其构成因素比较
由表2可知,郑麦7698籽粒产量显著高于周麦18,增幅达9.1%;郑麦7698的千粒质量和穗粒数也均显著高于周麦18,增幅分别为3.5%和8.0%;郑麦7698的收获指数也显著高于周麦18,增幅达6.0%。郑麦7698与周麦18的生物学产量、穗数均无显著差异。
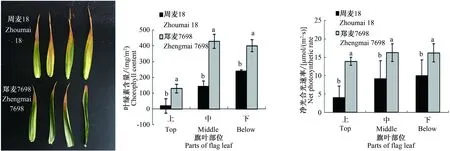
图5 周麦18和郑麦7698开花后25 d旗叶的衰老状况以及不同部位的叶绿素含量和净光合速率比较Fig.5 The senescence condition of flag leaves,the chlorophyll content and net photosynthetic rate of different parts of flag leaves in Zhoumai 18 and Zhengmai 7698 at 25 days after anthesis表2 周麦18和郑麦7698产量及其构成因素Tab.2 The grain yield and its components of Zhoumai 18 and Zhengmai 7698

品种Varieties籽粒产量/(kg/hm2)Grain yield生物学产量/(kg/hm2)Biomass收获指数Harvest index穗数/(×104/hm2)Spike number千粒质量/g1 000-grain weight穗粒数Grains number per spike周麦18Zhoumai 189 997.05±208.85b21 609.90± 761.70a0.463±0.020b 618.15±22.49a 44.16±0.64b35.94±1.026b郑麦7698Zhengmai 769810 911.45±546.30a22 402.05±1 233.86a0.491±0.013a620.18±26.43a45.71±1.03a38.81±0.985a
注:同列数据后不同小写字母表示不同品种之间的差异显著(P<0.05)。
Note:Different letters in the same column indicate that the differences among Different cultivars reach significant level (P<0.05).
3 结论与讨论
在以往的研究中,人们常常通过测定旗叶中部的光合速率来代表整个旗叶的光合速率,由于旗叶不同部位光合能力存在差异,尤其是在小麦的灌浆后期,旗叶开始衰老,不同品种旗叶不同部位之间的光合速率差别很大,利用该方法来反映旗叶的实际光合能力,对不同小麦品种来说会造成极大的误差。此外,传统光合速率的测定是将叶片和测定光垂直,而在田间,小麦穗完全直立,中午时与太阳的入射角平行;另外,现代小麦叶片与茎秆的夹角也很小,一天中与太阳光的入射角成为垂直的时候几乎没有。因此,以垂直光测定一天中最好时刻的光合速率也不能客观反映小麦叶片实际光合能力。国内关于小麦穗光合速率的研究十分有限,主要的研究结果均表明小麦穗的净光合速率远低于旗叶,只有旗叶净光合速率的20%~30%[18],这些结果均无法解释穗光合作用对籽粒产量的巨大贡献。而本研究首次利用特制叶室与CIRAS-3光合测定系统组成开放式气路,在测定过程中将整个小麦穗和旗叶密闭在透明叶室中,并保持旗叶与穗在大田的生长状态和位置,实时测定了郑麦7698和周麦18整个穗和旗叶开花后不同时间的总光合速率,以这种方式测定出来的小麦旗叶和穗的总光合速率能更客观和准确地反映小麦旗叶和穗的实际光合能力。本研究结果表明,无论是郑麦7698还是周麦18在开花后不同时间穗的总光合速率和旗叶的总光合速率基本相当,这与前人穗光合能力远低于旗叶的结果不符[18],主要是因为他们直接使用光合仪测定出来的净光合速率进行对比[13,18],忽略了穗极高的呼吸速率,此外他们以穗的投影面积来计算单位面积的穗净光合速率,这2种方法都极大地低估了穗的光合作用。
本研究以改良后的光合作用测定方法研究和比较了郑麦7698和周麦18旗叶和穗总光合速率在灌浆时期的动态变化,研究结果表明在整个测定时期,郑麦7698旗叶的总光合速率均显著高于周麦18,且郑麦7698穗的总光合速率在开花后6~18 d也显著高于周麦18。很多研究表明,小麦旗叶和穗的光合能力对小麦灌浆的影响至关重要[19-21]。因此,与周麦18相比,郑麦7698旗叶和穗优良的光合能力是保证小麦籽粒灌浆,最终使其具有较高千粒质量和穗粒数的生理基础。进一步研究表明,郑麦7698在小麦灌浆后期,旗叶能够维持较高的叶绿素含量,减缓了旗叶的衰老,这可能是郑麦7698旗叶在灌浆后期能够维持较高光合速率的原因之一。
小麦冠层结构的改变会影响小麦的光能利用效率和光合产物的分配,从而影响小麦产量[22-23],而冠层光能分布是反映冠层结构的一个重要指标。本研究结果表明,郑麦7698穗层的光能截获率显著高于周麦18,且郑麦7698旗叶和穗总光合速率也均比周麦18高。植物光合产物具有就近分配和运输的特点,且源—库距离越短,运输效率越高[13]。因此,郑麦7698较高的收获指数与其穗层较高的光能截获率和较高的光合速率有关。旗叶和穗光合能力的提高、冠层结构的优化以及衰老进程的迟缓是郑麦7698获得超高产量的生物学基础。这为进一步选育高产小麦品种提供了重要参考。

