复合益生菌液态发酵黄芪的制备方法
,,,,,,
(1.河南牧业经济学院,河南 郑州 450046; 2.郑州市益生菌发酵中药重点实验室,河南 郑州 450046;3.河南省益生菌生物转化工程技术研究中心,河南 郑州 450046; 4.河南省微生物生物转化中药工程实验室,河南 郑州 450046; 5.郑州市质量技术监督检验测试中心,河南 郑州 450007)
中草药是目前公认的绿色饲料添加剂,其在增强动物机体免疫力、抗菌、抗病毒等方面具有良好的作用效果[1-2]。但是中草药在临床应用中也存在一定缺点,如添加量较大、适口性较差、成本较高等,对其在动物生产上的推广与应用产生了不利的影响。常作为饲料添加剂的益生菌如枯草芽孢杆菌、乳酸菌等,具有增强动物机体免疫力、调整肠道菌群平衡、维持肠黏膜完整性及提高肠道消化吸收功能的作用[3-4]。结合现代微生物发酵工程技术,利用益生菌对中草药进行生物转化是对中草药炮制方法的创新,该技术能提高中草药的临床应用效果,主要表现在减少用药剂量、提高有效成分作用速率以及具有多功能性等,并且能降低某些药物的毒副作用[5]。一方面,中草药黄芪在提高动物机体免疫力、抗应激和抗氧化能力方面具有良好的作用效果,并且对枯草芽孢杆菌和乳酸菌等益生菌的体外增殖具有良好的促进作用;另一方面,黄芪经益生菌发酵后临床效果得到加强,用量减小的同时,提高了临床应用价值[6-7]。目前,关于发酵黄芪制剂的开发研究,主要集中于利用1种或1类益生菌对黄芪进行生物转化,多菌种混合发酵研究较少。本研究利用枯草芽孢杆菌、酵母菌和乳酸菌对黄芪进行分段复合发酵,旨在增强益生菌对黄芪生物转化的效果,发挥多菌种协同作用,加强复合益生菌黄芪发酵制剂的多功能特性,提高其临床应用效果。
1 材料和方法
1.1 试验材料及主要仪器
试验用黄芪饮片购于亳州药材市场;枯草芽孢杆菌、酵母菌和乳酸菌菌种由河南牧业经济学院发酵中药实验室保存;营养琼脂培养基、莫匹罗星锂盐MRS培养基均购于北京澳博星生物技术有限公司;马铃薯液体、琼脂培养基(含氯霉素)均购于青岛高科技工业园海博生物技术有限公司;恒温培养箱购于宁波莱福科技有限公司;恒温摇床购于天津路业实验仪器公司;电子天平购于郑州通渠商贸有限公司;200 L全自动发酵罐购于镇江东方生物工程设备技术公司。
1.2 菌种活化
将枯草芽孢杆菌、酵母菌及乳酸菌菌种的甘油冻存管置于室温,融化后用无菌接种环挑取少量菌种分别划线接种于营养琼脂培养基、马铃薯琼脂(含氯霉素)培养基和莫匹罗星锂盐MRS琼脂培养基,分别在37、28、37 ℃倒置培养24 h,然后将其转接至相应液体培养基,适宜条件下培养24 h后备用。
1.3 黄芪提取液的制备
准确称取适量的黄芪饮片,分别加5、4、4倍量的水,煮沸3次,每次约40 min,分别留取每次滤液,最后合并3次滤液并浓缩至黄芪质量浓度为0.5 g/mL,保存备用。
1.4 黄芪添加量、发酵培养基及发酵条件
黄芪提取液的添加量为:每毫升培养基中含黄芪0.5 g。发酵培养基组成为:每100 mL培养基中含黄芪50.0 g、豆粕2.0 g、玉米2.0 g、麸皮2.5 g;培养基初始pH值均为8.00,装液量均为100 mL(500 mL三角瓶)[8]。枯草芽孢杆菌、酵母菌和乳酸菌发酵温度分别为37、28、37 ℃,乳酸菌静置培养,枯草芽孢杆菌和酵母菌置恒温摇床转速160 r/min培养。
1.5 复合菌种分段发酵黄芪条件测定
1.5.1 菌种接种顺序对菌体生长的影响 取制备好的培养基18瓶,随机分为1—6组,每组3个重复,每个重复3瓶。按表1所示顺序组合将菌种分别在一定的时间点按1.0%的接种量接种至培养基中,接种后培养时间均为24 h,培养结束后镜检各菌种的生长情况及pH值,接种的相应菌种生长用“√”表示,接种的相应菌种未生长用“-”表示。

表1 菌种接种顺序 Tab.1 The inoculation order of strains
1.5.2 枯草芽孢杆菌发酵时间对酵母菌生长的影响 采用单因子试验法,取制备好的培养基15瓶,随机分为1—5组,每组3个重复,每个重复3瓶。1—5组均按3.0%接种量接入枯草芽孢杆菌[9],分别在接种后的24、36、48、60、72 h,取样测定枯草芽孢杆菌数量,同时各组均按1.0%接种量接入酵母菌,培养24 h后测定酵母菌数量。
1.5.3 酵母菌最适接种量的测定 采用单因子试验法,取制备好的培养基15瓶,随机分为1—5组,每组3个重复,每个重复3瓶。1—5组均按3.0%接种量接入枯草芽孢杆菌,按1.5.2中所得最优培养时间进行培养后,各组分别按0.1%、0.5%、1.0%、2.0%、4.0%的接种量接入酵母菌,培养24 h后测定酵母菌的数量。
1.5.4 酵母菌发酵时间对乳酸菌生长的影响 采用单因子试验法,取制备好的培养基15瓶,随机分为1—5组,每组3个重复,每个重复3瓶。1—5组均按3.0%的接种量接入枯草芽孢杆菌,按照1.5.2中所得最优培养时间进行培养,然后均按1.5.3中所得最佳接种量接入酵母菌,分别在接种后的24、36、48、60、72 h,取样并测定酵母菌数量,同时各组均按1.0%的接种量接入乳酸菌,培养24 h后测定乳酸菌数量。
1.5.5 乳酸菌最适接种量的测定 采用单因子试验法,取制备好的培养基15瓶,随机分为1—5组,每组3个重复,每个重复3瓶。1—5组均按3.0%的接种量接入枯草芽孢杆菌,按照1.5.2中所得最优培养时间进行培养,然后均按1.5.3中所得最佳接种量接入酵母菌,再按照1.5.4中所得最优培养时间进行培养后,各组分别按0.1%、0.5%、1.0%、2.0%、4.0%的接种量接入乳酸菌,培养24 h后测定乳酸菌的数量。
1.5.6 发酵时间对乳酸菌生长的影响 采用单因子试验法,取制备好的培养基15瓶,随机分为1—5组,每组3个重复,每个重复3瓶。1—5组均按3.0%的接种量接入枯草芽孢杆菌,按照1.5.2中所得最优培养时间进行培养,然后均按1.5.3中所得最佳接种量接入酵母菌,再按照1.5.4中所得最优培养时间进行培养,最后各组均按1.5.5中所得最佳接种量接入乳酸菌,分别在培养24、36、48、60、72 h时,取样并测定乳酸菌数量。
1.6 中试扩大试验
为进一步确定上述摇瓶试验结果的实用性,利用200 L全自动不锈钢发酵罐及筛选后的培养基进行中试扩大试验,并检测发酵液各菌种的数量和发酵终点pH值。培养基初始pH值为8.00,装液量为70%;枯草芽孢杆菌发酵温度为37 ℃,接种量为3.0%,电机转速为250 r/min,通气量为0.05 m3/min;酵母菌发酵温度为28 ℃,电机转速为250 r/min,通气量为0.05 m3/min;其他发酵条件按照1.5中所得的最优结果执行。
1.7 活菌数量的测定
采用平板菌落计数法测定活菌数量[10]。取1 mL发酵好的菌液稀释至10-6、10-7、10-8倍,取1 mL稀释液于无菌平板,然后加入适量琼脂培养基摇匀,待培养基凝固后,在适宜温度下倒置培养24 h,查出平板菌落数,测数样品设3个重复。根据公式:每毫升活菌数=平板上菌落数×稀释倍数,来计算发酵液中活菌总量。
枯草芽孢杆菌活菌数量的测定为:将发酵液置于80 ℃水浴锅中20 min,此后操作同平板菌落计数法,测数培养基采用营养琼脂培养基,培养条件为37 ℃有氧培养;酵母菌测定采用马铃薯琼脂培养基(含氯霉素),培养条件为28 ℃有氧培养;乳酸菌测数培养基采用莫匹罗星锂盐MRS琼脂培养基,培养条件为37 ℃厌氧培养。
2 结果与分析
2.1 菌种接种顺序对菌体生长的影响
由表2所示,按1、2组的菌种接种顺序,3种益生菌均能正常生长,按其他4组接种顺序,枯草芽孢杆菌不能生长。试验开始,按照表1的接种顺序,各组分别接种枯草芽孢杆菌(1、2组)、酵母菌(3、4组)和乳酸菌(5、6组),培养24 h后,各组中菌体均能生长。pH值以枯草芽孢杆菌组最高,分别为5.85和5.84;酵母菌组次之,pH值均为5.63;乳酸菌组最低,pH值分别为4.08和4.09。各组在24 h时分别接入相应菌种(表1),培养24 h后,1、5组(酵母菌)和2、4组(乳酸菌)接入的菌种均能正常生长,以上各组pH值分别为4.75、3.96、4.14、4.75;3、6组(枯草芽孢杆菌)接入的菌种未生长,pH值分别为5.32和4.02。各组在48 h时接入相应菌种(表1),培养24 h后,4、5组(枯草芽孢杆菌)未生长,其他各组接种的菌种正常生长,终末菌液均呈酸性,pH值分别为4.73、4.03、4.82、4.83、3.92、3.99,乳酸菌接种顺序在酵母菌之前组别(2、5、6组)的pH值低于酵母菌接种顺序在乳酸菌之前的组别(1、3、4组)。由于枯草芽孢杆菌和酵母菌均为需氧菌,除温度之外其他发酵条件一致,第1组的接种顺序在制剂制备时操作方便,因此确定第1组为最佳接种顺序组合。
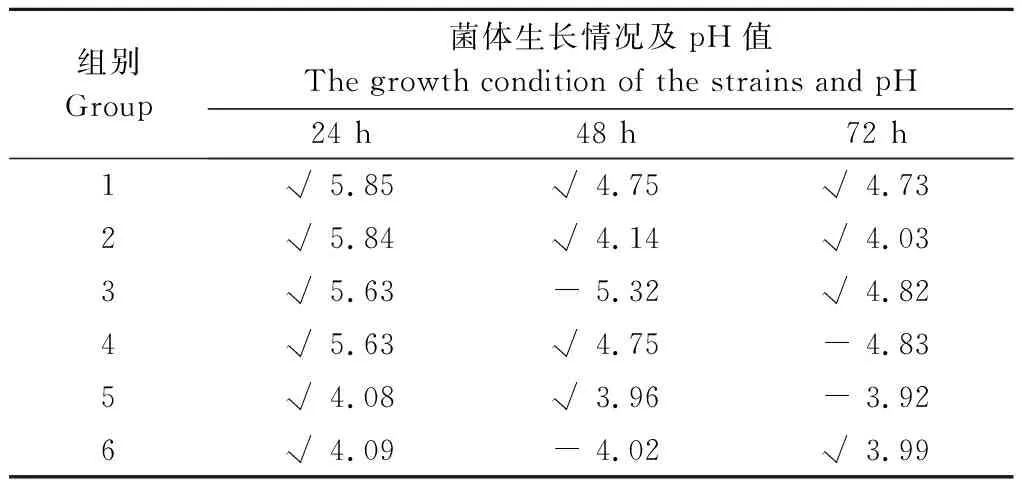
表2 菌种接种顺序对菌体生长的影响Tab.2 Effect of inoculation sequence on growth of strains
注:“√”表示接种的菌种生长,“-”表示接种的菌种未生长。
Note:“√” indicates the growth of the inoculated strain,and “-” indicates that the inoculated strain did not grow.
2.2 复合菌种分段发酵黄芪条件对各菌种生长的影响
2.2.1 枯草芽孢杆菌发酵时间对酵母菌生长的影响 由表3所示,检测得枯草芽孢杆菌在后续试验过程中活菌数量变化较小;当枯草芽孢杆菌培养时间为24 h时,接种的酵母菌在培养后获得的数量最高,为0.98×108cfu/mL,另外4组酵母菌数量在0.75×108~0.91×108cfu/mL,随着枯草芽孢杆菌培养时间的延长酵母菌数量呈下降趋势,说明延长枯草芽孢杆菌的培养时间能抑制酵母菌的生长。结果表明,在枯草芽孢杆菌培养24 h时接种酵母菌,既能保证枯草芽孢杆菌得到充分的生长,又能使酵母菌的菌体数量较高,因此,确定枯草芽孢杆菌培养24 h时为酵母菌的最优接种时间。

表3 枯草芽孢杆菌培养时间对酵母菌生长的影响Tab.3 Effect of Bacillus subtilis culture time on the growth of yeast
2.2.2 接种量对酵母菌生长的影响 由表4所示,随着酵母菌接种量的提高,培养后所得酵母菌数量先升高后降低,以接种量为2.0%的试验组酵母菌数量最高,为1.34×108cfu/mL,因此,确定酵母菌最佳接种量为2.0%。
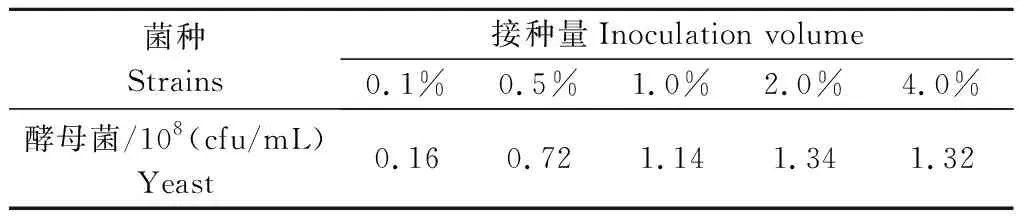
表4 接种量对酵母菌生长的影响Tab.4 Effect of inoculating volume on the growth of yeast
2.2.3 酵母菌培养时间对乳酸菌生长的影响 由表5所示,酵母菌数量随着培养时间的延长,活菌数量先升高后降低,以培养时间为60 h时的活菌数量最高,为1.98×108cfu/mL;随着酵母菌培养时间的延长,后续接种并培养的乳酸菌数量先升高后降低,当酵母菌培养时间为48 h时,接种的乳酸菌培养后获得的数量最高,为12.22×108cfu/mL。酵母菌培养48 h时乳酸菌数量为1.87×108cfu/mL,虽然低于酵母菌培养60 h时的乳酸菌数量,但考虑到此时接种所得乳酸菌的活菌数最高,且延长培养时间增加能耗,因此,确定酵母菌培养48 h时为乳酸菌的最优接种时间。
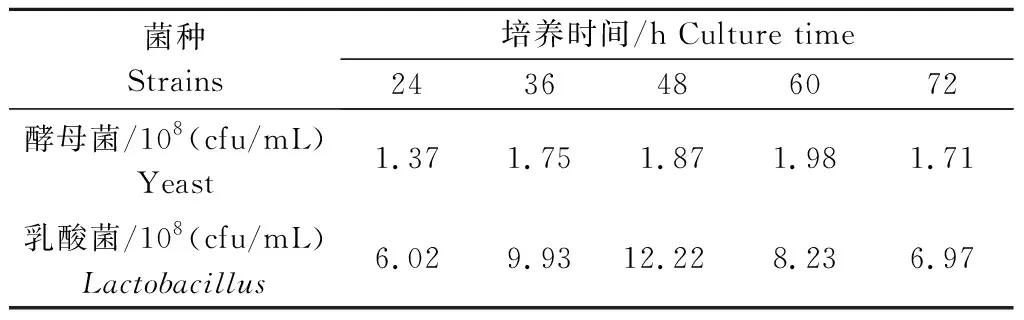
表5 酵母菌培养时间对乳酸菌生长的影响Tab.5 Effect of yeast culture time on Lactobacillus growth
2.2.4 接种量对乳酸菌生长的影响 由表6所示,随着乳酸菌接种量的提高,培养后所得乳酸菌数量先升高后降低,以接种量为0.5%的试验组乳酸菌数量最高,为11.48×108cfu/mL,因此,确定乳酸菌的最佳接种量为0.5%。
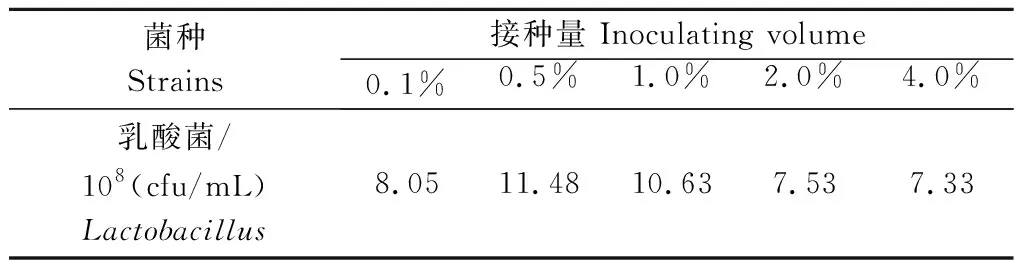
表6 接种量对乳酸菌生长的影响Tab.6 Effect of inoculating volume on the growth of Lactobacillus
2.2.5 培养时间对乳酸菌生长的影响 由表7所示,随着培养时间的延长,乳酸菌数量呈降低趋势,以培养时间为24 h的乳酸菌数量最高,为11.64×108cfu/mL,因此,确定乳酸菌最优培养时间为24 h。
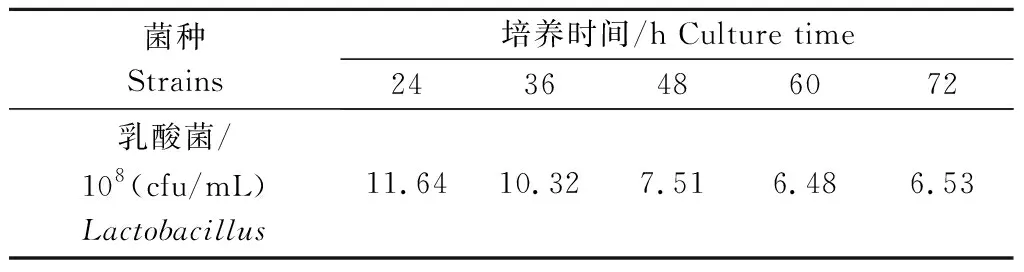
表7 培养时间对乳酸菌生长的影响Tab.7 Effect of culture time on the growth of Lactobacillus
2.3 中试扩大试验结果
由表8所示,按上述试验所得最优发酵条件,调整培养基初始pH值为8.00,发酵罐装液量为70%,枯草芽孢杆菌接种量为3.0%,发酵温度为37 ℃,电机转速为250 r/min,通气量为0.05 m3/min;枯草芽孢杆菌培养24 h后,以2.0%的接种量接种酵母菌,电机转速为250 r/min,通气量为0.05 m3/min,于28 ℃培养48 h;然后,以0.5%的接种量接种乳酸菌,于37 ℃静置培养24 h。检测发酵液中各菌种的数量如下:枯草芽孢杆菌为28.52×108cfu/mL,酵母菌为5.71×108cfu/mL,乳酸菌为9.34×108cfu/mL,终末pH值为4.55。与前期摇瓶试验阶段相比,乳酸菌数有所降低,但枯草芽孢杆菌和酵母菌数量大幅提高,说明本研究利用复合益生菌液态发酵黄芪的方法具有良好的可行性。

表8 中试扩大试验结果Tab.8 Result of pilot test
3 结论与讨论
本研究表明,利用多菌种能对黄芪提取液进行混合发酵,接种顺序为枯草芽孢杆菌、酵母菌、乳酸菌;最优发酵条件为:枯草芽孢杆菌以3.0%的接种量于37 ℃培养24 h后,以2.0%的接种量接种酵母菌,于28 ℃培养48 h后,再以0.5%的接种量接种乳酸菌,于37 ℃静置培养24 h;按优化后的发酵条件,利用发酵罐进行中试试验,发酵结束时,枯草芽孢杆菌、酵母菌、乳酸菌的活菌数分别为28.52×108、5.71×108、9.34×108cfu/mL,终末pH值为4.55。黄芪经益生菌混合发酵后,其作用效果与发酵之前或单一菌种发酵相比是否会有所提高,还需进一步研究。
3.1 分段复合发酵中菌种接种顺序对各菌种生长的影响
目前,关于多菌种复合发酵制备饲料添加剂或发酵型饲料原料的研究主要集中在利用同类菌种的混合发酵,由于同类菌种生长繁殖条件相似,混合发酵培养可行性强,通过同类多菌种混合发酵能有效提高发酵液中活菌数量或发酵底物的品质。例如,王玉燕等[11]利用3株乳酸菌混合发酵制备具有高活菌含量的发酵液,通过发酵条件和培养基的优化,活菌数量可达到1.8×1013cfu/mL。利用不同种类的有益菌混合发酵亦有报道,李祖旭[12]用枯草芽孢杆菌、米曲霉、鼠李糖乳杆菌和长双歧杆菌发酵健胃消食片药渣得到的制剂,对脾虚小鼠肠道菌群具有一定的调节作用;王国强等[13]利用异常汉逊酵母菌、枯草芽孢杆菌、干酪乳杆菌,以2∶2∶1的比例,5%的接种量,发酵豆粕48 h,明显提高了豆粕的营养价值。由于不同种类的菌种发酵条件和营养需求不一致,如果在相同的发酵条件下,将不同种类的菌种同时接种至同一培养基中,再加上菌种在生长过程中可能产生相互抑制,将会导致某些菌种生长不充分甚至无法生长。肖萌[13]利用纳豆芽孢杆菌和乳酸菌分段接种的方法混合发酵菜籽粕,首先接种纳豆芽孢杆菌,2 d后再接种短乳杆菌,再发酵2 d,通过成分检测发现,菜籽粕经发酵后粗蛋白、粗脂肪及总氨基酸等含量显著升高,植酸和单宁含量显著降低,整体营养价值得到提升。
本研究选用营养成分复杂的玉米、麸皮和豆粕混合物作为发酵黄芪提取液的培养基原料,能减少因营养需求不同对菌种生长造成的不利影响。接种方式采用分段接种,能够避免因发酵条件不同导致的菌体生长受阻,例如枯草芽孢杆菌和酵母菌在有氧条件下能大量繁殖,而乳酸菌则要求微需氧或厌氧条件。因此,接种顺序直接决定了黄芪发酵液中益生菌的种类和数量。试验中1、2组首先接种枯草芽孢杆菌,培养结束时pH值接近6.00,后续按不同顺序接种酵母菌和乳酸菌均能生长;3—6组首先接种酵母菌或乳酸菌,培养结束时pH值大约在4.00~5.50,后续培养枯草芽孢杆菌均不能正常繁殖,与史洪涛[14]研究结果相一致,推测培养基呈酸性可能是枯草芽孢杆菌不能正常繁殖的主要原因之一。此外,各菌种的代谢产物是否对其他菌种的生长产生抑制或促进作用,还有待深入研究。
3.2 复合菌种分段发酵条件对各菌种生长的影响
发酵条件是影响发酵产品品质的重要因素,相关研究表明,适宜的发酵条件包括发酵温度、接种量、接种顺序、pH值、含水量(固态发酵)等,能提高发酵产物中菌体数量,有利于目标代谢产物的积累,并且能降低发酵底物中有害物质的含量,进而提高发酵制剂品质和临床应用效果[15-19]。本研究将发酵菌种按一定的顺序接种至含有黄芪提取液的培养基中,由于微生物之间的相互作用关系比较复杂,混合培养能造成菌种之间的空间和营养竞争,一方面能提高营养物质的利用率,另一方面也可能造成不同菌种之间在生长繁殖方面的协同或拮抗作用。在摇瓶试验阶段,枯草芽孢杆菌和酵母菌受到供氧条件的限制,但在中试扩大试验时,获得充足氧气的枯草芽孢杆菌和酵母菌,在培养后活菌数量大幅提升。由此推断,由枯草芽孢杆菌和酵母菌活菌数量的增加所产生的营养竞争或菌体之间的抑制作用,可能是降低乳酸菌数量的原因。不同菌种之间产酶具有互补性,某些中药大分子或前体成分经微生物酶系转化后生成次级代谢产物具有更强的生物活性[20],因此,在保证各菌种能够生长的情况下,通过调整不同菌种的发酵时间和接种量,降低菌种之间因生长拮抗产生的不利影响,提高每个种类菌体的数量,能使复合菌种发酵的酶系更有利于黄芪成分的生物转化。

