CRT、CD47在胃癌组织中的表达及意义
孙科,叶亮,刘细平,徐绍忠,李志东,祁江
0 引言
胃癌是人类最常见的恶性肿瘤之一,主要治疗方法包括手术、放疗和化疗等,但总体疗效不满意,有必要探索新的治疗策略。免疫治疗旨在重新激活免疫系统,以消除癌细胞,是目前新的治疗方案。有文献报道多种恶性肿瘤细胞表面携带有促吞噬作用的钙网蛋白(Calreticulin,CRT),其可发送信号招募巨噬细胞吞噬并消化癌细胞[1];恶性肿瘤细胞还表达另外一种分子CD47,产生抑制性作用,能抵消CRT信号。本研究通过检测胃癌组织中CRT和CD47的表达,分析两者的表达与临床病理参数的关系,探讨两者在胃癌发生、发展中的作用。
1 资料与方法
1.1 临床资料
收集2013年6月—2015年5月在株洲市中心医院普外一科行胃癌根治术的患者病理标本50例,术前未接受放化疗,所有资料均经病理证实为胃癌;同时选取相对应癌旁正常组织(安全界外1 cm)病理标本作为对照。本组50例中,男28例、女22例,年龄45~81岁,平均年龄(60.5±14.2)岁。胃窦癌36例、胃体癌14例,均是胃腺癌。其中高分化14例、中分化16例、低分化20例。根据美国癌症联合委员会(American Joint Committee on Cancer, AJCC)公布的胃癌TNM分期,T1期3例,T2期12例,T3期19例,T4期16例。术后随访36~57月。
1.2 检测CRT、CD47蛋白的表达水平
胃癌及癌旁组织石蜡包埋标本,均由我院两位高年资病理医师对标本观察,确认并圈出组织芯的代表区域,对标记部位蜡块上取材、打孔,孔径为2 mm,将胃癌组织、癌旁组织芯放入蜡块孔内,将每个蜡块制作组织芯,50℃将蜡块融合,行4 μm厚连续切片。采用链霉素抗生物素蛋白-过氧化酶法检测胃癌组织中CRT、CD47蛋白的表达水平,CRT及CD47单克隆抗体均是美国Abcam公司产品,根据预实验情况,配制CRT抗体浓度1:1 400、CD47抗体浓度1:300。按说明书操作,蜡块切片,脱蜡至水,将切片浸于0.01 mol/L枸橼酸缓冲液(pH6.0)中加热煮沸2.5 min修复,冷却,滴入内源性过氧化物酶阻断剂,15 min后水洗,置入磷酸盐缓冲液(PBS)浸泡,分别滴入一抗(CRT、CD47抗体),滴入CD47抗体,-4℃孵育过夜,滴入CRT抗体不过夜,标本用PBS浸泡,再滴二抗(酶标羊抗鼠/兔IgG联合物,购自美国DAKO公司),放入37℃恒温箱中孵育,经DAB显色,苏木精对比染色,梯度乙醇脱水,二甲苯透明,中性树胶封片,镜检。结果判断:由本院两位高年资病理科医师进行双盲阅片、并评分,标准如下:每张切片随机选取10个高倍视野(×400)下计数,根据阳性细胞数及染色强度划分等级。(1)阳性细胞数<1%为0分,1%~10%为1分,>10%~50%为2分,>50%为3分;(2)染色强度:阴性为0分,弱阳性1分,中等阳性2分,强阳性3分。得分为(1)+(2),总分为0~6分,0分(-),1~2分(+),3~4分(++),5~6分(+++)。(-)~(+)是低表达,(++)~(+++)是高表达。
1.3 统计学方法
所有资料采用SPSS 17.0统计软件进行分析,计量资料(±s)表示,两样本均数比较采用t检验,计数资料率的比较用χ2检验,Kaplan-Meier生存曲线分析CRT、CD47不同表达的胃癌患者术后3年生存率,检验水准α=0.05。
2 结果
2.1 CRT、CD47在胃癌及癌旁组织中的表达
CRT、CD47在胃癌组织及癌旁组织中均有阳性表达,CRT的阳性表达主要位于胞质中,见图1,细胞核及细胞膜中未见表达,镜下阳性细胞呈棕黄色;CD47的阳性表达主要位于细胞核、胞质,见图2,镜下阳性细胞呈深黄色。
胃癌组织中CRT、CD47高表达率分别为68.0%(34/50)、56.0%(28/50);癌旁组织中CRT、CD47高表达率分别为26.0%(13/50)、28.0%(14/50)。CRT、CD47在胃癌组织中的高表达率高于癌旁组织,差异有统计学意义(P=0.001、0.005),见表1。
2.2 CRT、CD47在胃癌组织中的表达及与临床参数关系
结果显示CRT、CD47高表达者与肿瘤分化程度、淋巴结有转移及肿瘤浸润深度有关(P<0.05),与年龄、性别、肿瘤大小无关(P>0.05),见表2。
2.3 CRT、CD47不同表达组胃癌患者根治术后3年生存情况

图1 CRT在胃癌组织和癌旁组织中的表达 (SP ×400)Figure1 CRT expression in gastric cancer and adjacent normal tissues (SP ×400)

图2 CD47在胃癌组织和癌旁组织中的表达 (SP ×400)Figure2 CD47 expression in gastric cancer and adjacent normal tissues (SP ×400)
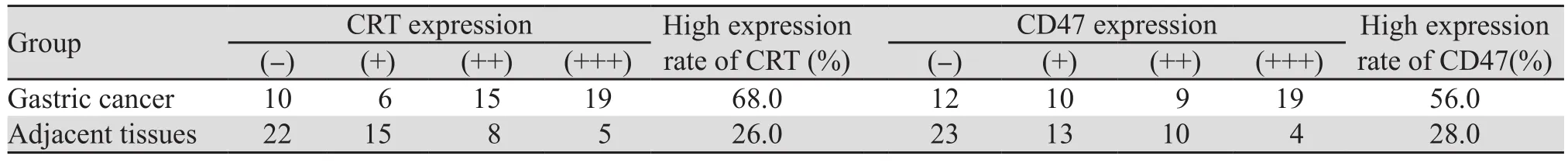
表1 CRT和CD47在胃癌组织与癌旁组织中的表达Table1 Expressions of CRT and CD47 in gastric cancer and adjacent normal tissues
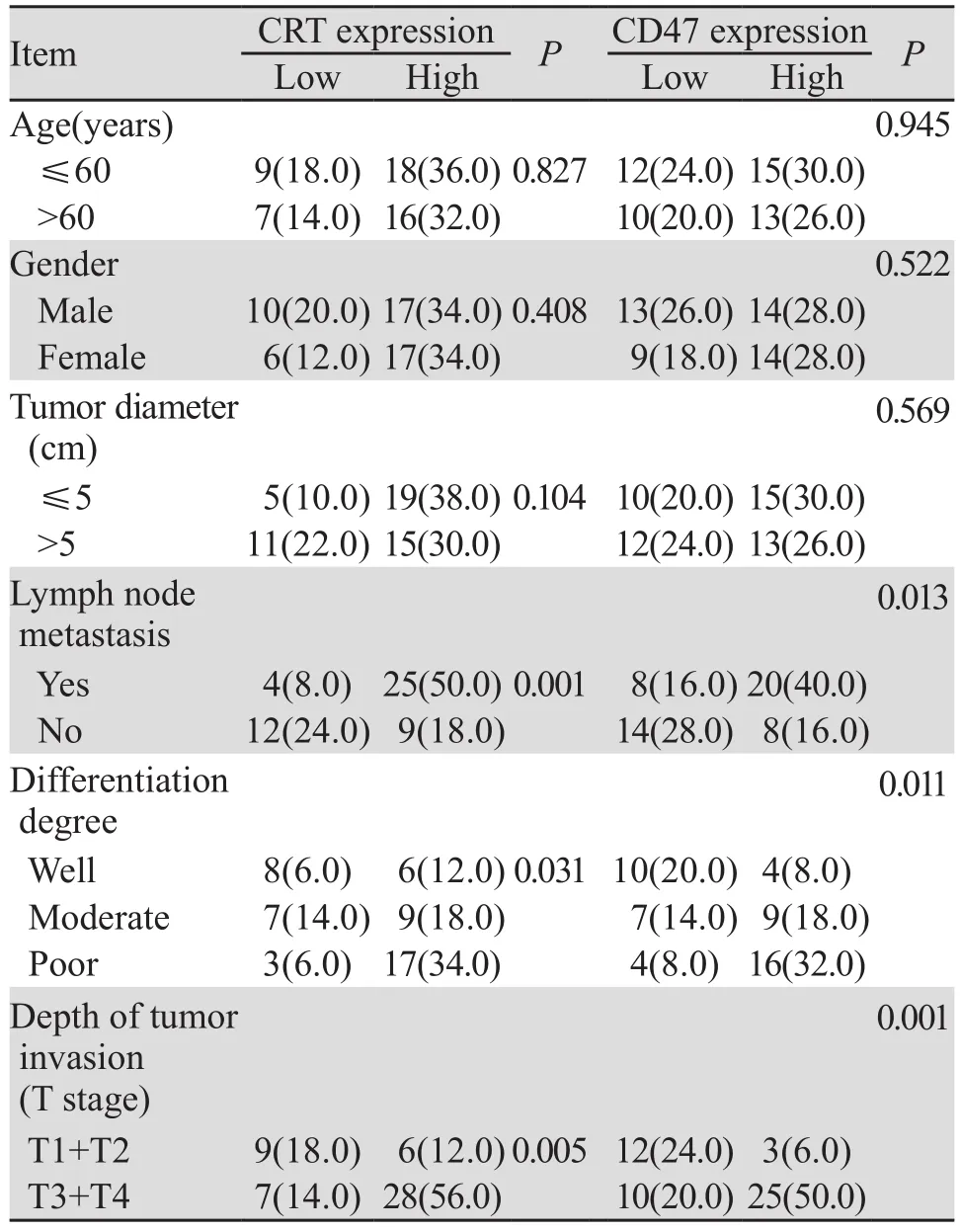
表2 CRT、CD47在胃癌组织中的表达及与临床病理参数关系 (例(%))Table2 Correlation between CRT, CD47 expression and clinicopathologic parameters of gastric cancer patients(n(%))
采用Kaplan-Meier绘制胃癌根治术后3年生存率曲线,显示CRT、CD47高表达组较低表达组的生存时间短,差异有统计学意义(P=0.039、0.043),见图3。
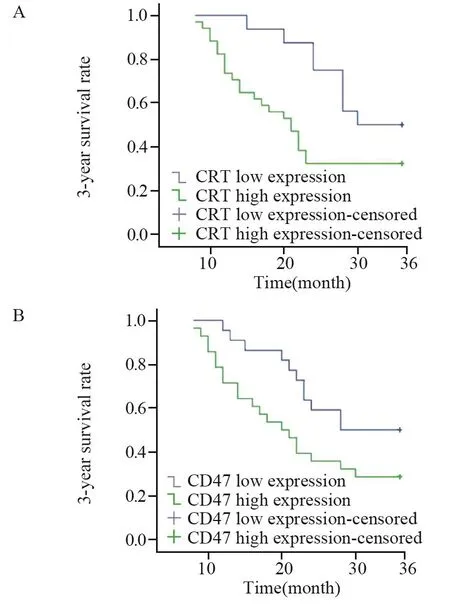
图3 不同CRT(A)、CD47(B)表达水平组胃癌根治术后3年生存率曲线Figure3 Three-year survival curves of gastric cancer patients with different expression levels of CRT(A) and CD47(B)
3 讨论
钙网蛋白(CRT)是内质网和肌浆网中主要的Ca2+结合蛋白[1],广泛存在于哺乳动物细胞中。在肿瘤免疫监视中,细胞膜表面CRT分子增多、聚集成簇,递呈肿瘤抗原,表达一种“来吃我”的信号,招募巨噬细胞,启动吞噬、清除细胞[2],是肿瘤免疫原性死亡的标志[3]。CD47又称整联蛋白(integrin-associated protein),是表达在细胞膜表面的免疫球蛋白样蛋白质[4],CD47与其配体信号调节蛋白α链结合后产生抑制抗性信号[5],下调巨噬细胞吞噬作用,对固有免疫系统产生抑制作用,使肿瘤细胞逃避巨噬细胞的吞噬,表达“别吃我”信号[6],抵抗CRT信号。CRT和CD47参与多种肿瘤的发生和发展,在胃癌细胞的凋亡和免疫逃逸中扮演重要角色。
CRT在胃癌中的表达及与胃癌发生转移的关系尚有争议,多项研究报道胃癌中CRT呈高表达,曲晶磊等[7]报道胃癌组织中CRT阳性表达率为84.3%;王妍等[8]报道胃癌组织中CRT基因的表达量比癌旁组织上调3.70倍。肿瘤组织恶性程度越高,更多的CRT聚集,CRT蛋白表达上调,因此检验发现往往CRT高表达的胃癌细胞,侵袭力更强,且与生存期、淋巴结转移、肿瘤分期呈正相关[9-10]。本研究胃癌组织中CRT高表达率为68%,高于癌旁组织的26%(P<0.05),CRT高表达与分化程度、淋巴结转移、肿瘤浸润深度正相关,显示CRT高表达与胃癌的发生发展有密切关系。
与上述研究结论不同的是,黄红丽等[11-12]报道CRT在胃腺癌细胞株中mRNA及蛋白质水平均较正常胃黏膜上皮细胞下调,胃癌组织中CRT阳性表达率明显低于正常胃组织。猜测可能的原因是CRT在胃癌免疫中仍有较多的机制不详,如CRT主要在内质网、胞质中,当细胞膜CRT蛋白聚集时才发出“来吃我”信号,CRT低表达水平是否受CRT胞内释放、膜转移、重新分布等影响,细胞膜CRT蛋白聚集对CRT基因是否有负反馈调节,这些机制有待于进一步研究。
肿瘤细胞膜表面出现大量CRT,如果伴随CD47表达量明显下降,可增强细胞被吞噬的效率[13]。而如果不伴有CD47表达下降,肿瘤细胞通过高表达CD47逃避巨噬细胞吞噬及细胞毒性作用[14],肿瘤呈进展态势、恶性程度增高。甘波等[15]报道CD47在胃癌组织中表达率为51.85%,高于癌旁组织的36.84%(P<0.05),CD47表达强度在低分化、有淋巴结转移、浸润更深的患者中表达更高。Sudo等[16]报道胃癌组织中CD47蛋白表达升高。Yoshida等[17]报道49.5%的胃癌细胞中CD47呈高表达;将胃癌细胞培养,发现CD47高表达的胃癌细胞持续生长的时间更长,且形成的瘤体更大,具有较强的增殖能力。本研究检测胃癌组织中CD47高表达率为56.0%,高于癌旁组织的28%(P<0.05)。CD47高表达的胃癌分化程度低、浸润深度及淋巴结转移增加,证实CD47在胃癌组织中呈高表达,促进肿瘤的发生和发展。
CRT、CD47在胃癌细胞凋亡和免疫逃逸中扮演重要角色,机体维持两者的平衡,当不平衡时,免疫监视缺乏,导致肿瘤细胞增殖、发展。多数肿瘤细胞中CD47、CRT的表达常相伴进行,以防护CRT介导的吞噬作用[18],因此当CD47高水平表达时,能抵抗CRT的促吞噬及免疫激活功能,从而允许虽有CRT表达的细胞不被吞噬并获得额外的突变,最后转化成恶性细胞。通过对CRT、CD47不同表达患者3年生存率曲线的分析,CRT、CD47高表达的胃癌病例相对于CRT、CD47低表达的病例生存时间更短,证实了CRT、CD47高表达促进胃癌细胞发生、发展,进而降低生存率。
CRT、CD47在胃癌组织中的表达与胃癌发生发展、侵袭转移相关。随着以免疫检查点抑制剂为代表的肿瘤免疫治疗临床研究迅速发展[19],肿瘤免疫治疗引领了肿瘤治疗的新方向,胃癌的免疫治疗是一个治疗热点,CD47、CRT是有潜在价值的标志物[20],可能为胃癌的早期诊断与免疫治疗提供潜在靶点,是胃癌治疗的新途径。

