柑橘类黄酮的生物学活性及提高生物利用度技术研究进展
黄 睿,沈淑妤,陈虹霖,吴文艳,陈士国,叶兴乾*
(浙江大学生物系统工程与食品科学学院,馥莉食品研究院,浙江省农产品加工技术研究重点实验室,浙江省食品加工技术与装备工程实验室,浙江 杭州 310058)
柑橘是世界第一大类水果,是仅次于玉米和小麦的第三大贸易农产品。世界柑橘年均产量约8 000多万t,而我国居世界首位,2015年达3 600万 t[1],主要包括甜橙类、宽皮柑橘类、葡萄柚和柚类、柠檬类、杂柑类和金柑类等。作为世界范围内最受人喜爱的水果之一,除了良好的口感,柑橘还被证实具有显著的营养和健康促进作用,这与其富含黄酮类物质密不可分。柑橘皮渣中此类活性成分含量较高,可对柑橘加工副产物进行充分利用。类黄酮是柑橘中存在的主要次级代谢产物,它们有一个共同的基本骨架,包括两个芳香环(A环和B环)和一个吡喃环(C环)[2]。目前已在柑橘中鉴定出超过60 种类黄酮单体,根据结构可分为黄酮、黄烷酮、黄酮醇、黄烷醇和花青素(仅存在于血橙中)等五大类,其中黄烷酮含量最为丰富,存在形式包括糖苷配基和配糖体两种:糖苷配基以橙皮素、柚皮素和圣草素为主,配糖体的糖基包括新橙皮糖基和芸香糖基[3]。柑橘中最为常见的21 种类黄酮汇总于表1中。
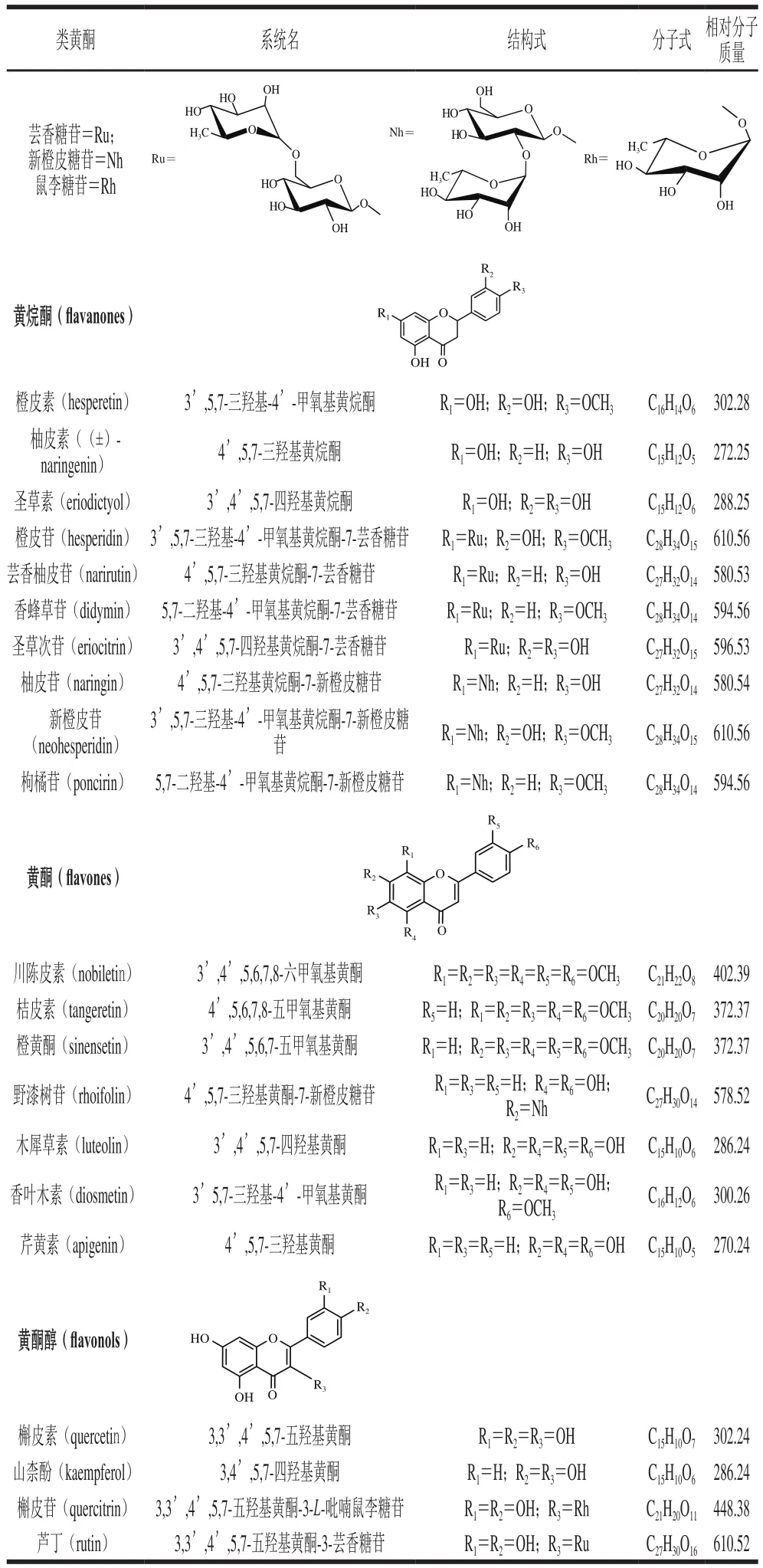
表1 柑橘中21 种常见类黄酮Table1 Chemical properties of twenty-one common fl avonoids in citrus
柑橘类黄酮生物学活性的研究近年来广受关注,其生物活性主要包括:抗氧化活性[4-5]、抗炎活性[6-7]、调节脂质代谢[8]、抗癌活性[9]和神经保护活性[10]等,并且柑橘类黄酮天然存在、安全性较高,具有发展成为治疗这些疾病的临床药物或辅助药物的潜在价值,张晓丹等[11]对柑橘类黄酮生物学活性的效果表征进行了综述,但关于作用机理方面讨论较少,其作用机理研究不断更新且较为零散,需加以系统总结。活性物质的生物利用度主要取决于3 个因素:生物可及性、吸收率和生物转化率。生物可及性受到活性物质从食物基质中释放和在胃液中的溶解性的影响[12],而柑橘中的主要类黄酮如橙皮苷、橙皮素、柚皮素、多甲氧基黄酮等水溶性都非常差,极大地限制了其生物利用度,而当前国内关于提高柑橘类黄酮生物利用度技术的研究和综述非常有限,有必要进行系统总结。
本文立足于上述问题,就近年来关于柑橘类黄酮生物学活性的研究现状和提高其生物利用度的技术方法进行综述,在此基础上,对柑橘类黄酮的研究与开发利用前景进行展望。
1 柑橘类黄酮的生物学活性
柑橘显著的营养和健康促进作用与其富含类黄酮密不可分,大量体外和体内研究表明,柑橘类黄酮具有多种药理活性且安全性高,是开发保健品和药物的优良原料。
1.1 抗氧化活性
柑橘类黄酮发挥抗氧化作用主要通过3 个途径:清除氧自由基、抑制脂质过氧化和螯合金属离子[6]。在生物体中,生理信号传递过程会产生少量活性氧;炎症反应中,白细胞消灭病菌会产生大量活性氧;多不饱和脂肪酸自动氧化过程中会产生脂质氧(RO·)和脂质过氧(ROO·)自由基;紫外照射等外界刺激过程也都会使机体产生氧化应激,而长期暴露于氧化应激环境被认为是退行性疾病发展的开端。柑橘类黄酮通过清除活性氧簇(reactive oxygen species,ROS)可减轻机体受到的氧化损伤[2]。
类黄酮的抗氧化活性很大程度上与其结构相关,主要包括3 种结构基团:1)B环上的3’,4’-邻二酚羟基,可通过氢键参与电子易位和稳定芳酰自由基;2)C环上的2,3位碳碳双键,可以易位B环上的电子(如芹菜素有一定的抗氧化性,而柚皮素对超氧阴离子无清除作用);3)3,5位上的羟基基团[3,6]。
Park等[13]建立了乙醇诱导小鼠肝损伤模型,模型肝组织中的超氧化物歧化酶(superoxide dismutase,SOD)活性和还原型谷胱甘肽(glutathione,GSH)水平降低,表明肝细胞内的抗氧化能力减弱,同时脂质过氧化产物如丙二醛(malondialdehyde,MDA)水平升高,这些变化都是由慢性乙醇消耗引起。将芸香柚皮苷与乙醇一同喂养小鼠,可使肝脏中SOD活力和GSH、MDA含量维持在与正常饮食组相当的水平,从而恢复机体的氧化防御能力。Rapavi等[14]用含450 mg香叶木苷和50 mg橙皮苷的药物喂养高脂膳食大鼠(60 mg/(kg·d))9 d作为实验组,高脂膳食模型组相较于正常饮食组,肝脏中自由巯基浓度、供氢能力和自由基清除能力明显降低,MDA和共轭二烯(二者同属脂质过氧化产物)含量显著升高。实验组中,这些参数(除共轭二烯)都有显著性改善,表明香叶木苷和橙皮苷可保护和修复脂肪肝的氧化防御体系。
1.2 抗炎活性
炎症是机体应对组织损伤、微生物病菌感染和化学性刺激的一种正常生理反应。在受伤位点,炎症由血管中免疫细胞的迁移和介质的释放引发,紧接着召集更多免疫细胞并释放出ROS、活性氮(reactive nitrogen species,RNS)以及促炎因子来消灭外来病菌和修复受伤组织[15]。这些炎症性化学物质也会攻击周边正常组织,导致DNA氧化损伤、基因突变和细胞增殖,造成大面积组织炎症。控制ROS、RNS和促炎因子的释放,成为抗炎药物发挥功效的关键。Liu Xin等[16]发现,在脂多糖诱导的鼠源RAW 264.7巨噬细胞或BMDMs模型中,柚皮素可抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin,IL-6)的释放和mRNA的表达,呈量效关系,还能显著减轻由脂多糖引起的Toll样受体4(toll-like receptors 4,TLR4)、诱导型一氧化氮合酶(inducible NO synthase,iNOS)、环氧合酶-2(cyclo-oxygenase-2,COX-2)和NADPH氧化酶-2(NADPH oxidase-2,NOX2)等促炎因子表达水平的升高,主要通过抑制核因子κB(nuclear factorκB,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等信号通路的激活发挥作用。Park等[13]证实芸香柚皮苷可有效抑制由乙醇诱导的小鼠肝脏中NF-κB、TNF-α和IL-1β等促炎因子的增加,且呈量效关系。因此,柑橘类黄酮具有治疗过度炎症反应的潜力。
柑橘类黄酮的抗炎活性与其结构紧密相关,例如:在B环上有4’-OH或3’,4’-OH取代基的黄酮可作为选择性脂氧合酶抑制剂,而含有5 个或更多甲氧基取代基的黄酮具有更高的磷酸二酯酶抑制活性[6,17]。多甲氧基黄酮,如川陈皮素可有效抑制脂多糖诱导人单核细胞产生TNF-α[18],也在由脂多糖诱导的BV2小神经胶质细胞中显现出比其他黄烷酮糖苷和多甲氧基黄酮更强的抗炎功效[19]。Chen Xiumin等[6]发现在脂多糖和干扰素-γ诱导的RAW 264.7细胞中,川陈皮素和橘皮素含量较高的橙皮提取物可抑制促炎介质iNOS和COX-2的蛋白和mRNA表达,并将此作用效果归因于大量存在的甲氧基团。由于川陈皮素和橘皮素等多甲氧基黄酮中的多数羟基被甲氧基取代而抗氧化活性较弱,故研究认为其抗炎活性与抗氧化活性的相关性并不大[18]。
1.3 调节脂质代谢活性
常用的降脂药物主要包括以抑制胆固醇合成为主的他汀类和促进脂肪酸氧化、抑制甘油三酯合成的贝特类等,但这些药物在发挥功效的同时,还伴随有肌肉损伤、肝功能破坏等副作用[20]。柑橘类黄酮作为一类天然的活性物质,具有较高安全性,且诸多实验结果表明,其能有效缓解由高脂膳食诱导的代谢紊乱,可改善血脂水平和肝脏脂肪变性程度,主要通过对核受体活性调控、极低密度脂蛋白(very low-density lipoprotein,VLDL)形成和分泌的调节以及对AMPK信号通路调控这3 个途径发挥功效。
与脂质代谢相关的核受体主要有3 类:过氧化物酶体增殖物激活受体类(peroxisome proliferator activated receptors,PPARs)、肝X受体(liver X receptor,LXR)和类法尼醇X受体(farnesoid X receptor,FXR)[21]。PPARα可引起脂肪酸β-氧化程度增加,LXRα能诱导脂肪酸合成和胆固醇转运[22],FXR通过抑制胆汁酸合成、促进胆汁酸分泌的同时抑制肝脏对胆汁酸的吸收来促进胆固醇代谢[23]。Goldwasser等[24]证实,柚皮素是PPARα和PPARγ的双重激动剂、LXRα的部分激动抑制剂,它能直接阻止LXRα配体结合区与Trap220辅激活物的结合,同时诱导PPAR主要配体PGC1α的表达量增加。这些效果通过激活与PPARα相关的下游基因的表达(包括CYP4A11、CPT-1和ACOX1等脂肪酸氧化基因)促进脂肪酸β-氧化,通过抑制受LXRα调控的脂质生成基因(如FAS)抑制脂质生成。柚皮素能同时作为PPARα和PPARγ的激动剂,表明它同时具有抑制脂质生成和胰岛素增敏属性(临床证明PPARα激动剂贝特类和PPARγ激动剂噻唑烷二酮类分别具有这些药效[25]),并且作为膳食补充剂具有清晰的安全记录,可为糖脂代谢异常提供有价值的新型治疗和干预方案。Cho等[26]以雄性大鼠为模型,在膳食中添加不同剂量柚皮素喂养6 周,发现其能显著降低大鼠血浆和肝脏中的甘油三酯(triglyceride,TG)和胆固醇含量,显著增加肝脏中PPARα蛋白的表达。此外,受PPARα调控的肉毒碱棕榈酰转移酶-1(carnitine palmitoyl transterase-1,CPT-1)和解偶联蛋白-2(unconjugated protein-2,UCP-2)蛋白的表达在柚皮素作用下也有显著提升。由此,可认为柚皮素激活PPARα转录因子和上调脂肪酸氧化目标基因是其在生物体中发挥降脂作用的途径之一。
VLDL的形成和分泌主要发生于肝脏中。TG在微粒体三酰甘油转移蛋白(microsomal triglyceride transfer protein,MTP)的作用下运输至内质网中并与载脂蛋白B(apolipoprotein B,Apo B)结合,胆固醇通过酰化辅酶A胆固醇酰基转移酶(acylated coenzyme A cholesterol acyltransferase,ACAT)酯化为胆固醇酯并转移至Apo B上,由Apo B、TG和胆固醇酯结合后形成VLDL前体粒子,通过外被体蛋白Ⅱ(coatmer protein,COPⅡ)输出内质网并转移至高尔基体中,与以脂滴形式存在的大量TG结合形成成熟的VLDL颗粒,并通过胞吐作用运输到细胞外[27]。因此,与甘油三酯和胆固醇酯的转移紧密相关的MTP和ACAT,是减少VLDL形成的两个重要靶标蛋白。另外,通过PI3K基因介导的LDL-受体表达与Apo B的含量也紧密相关,因为血浆中Apo B的浓度除了与脂质输出相关外,还与LDL通过LDL-受体从血浆转运到肝细胞中分解相关[28]。Borradaile[29]和Bawazeer[30]等发现,柚皮素和橙皮素在HepG2细胞中能通过提高PI3K磷酸化水平来增加LDL受体mRNA的表达,从而促进LDL的分解,减少其在血浆中的浓度。根据Borradaile等[31]的发现,柚皮素和橙皮素在HepG2细胞中可减少Apo B的积累,并呈量效关系,这与减少胆固醇酯的合成相关,同时在喂养橙皮苷和柚皮苷的模型小鼠肝脏中观察到羟甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutary CoA reductase,HMG-CoA)和ACAT活力的降低。Wilcox等[32]还在HepG2细胞研究体系中探究了柑橘类黄酮对ACAT1、ACAT2、HMG-CoA还原酶、MTP和LDL-受体的活性和表达水平的影响,发现橙皮素和柚皮素主要通过两种机制抑制ApoB的分泌:1)降低ACAT1和ACAT2的活力,并选择性减少ACAT2的表达;2)降低MTP活性,同时提高LDL-受体的活性。
AMPK即AMP依赖的蛋白激酶,包括3 个亚基:α-催化亚基、β-和γ-调节亚基。α-亚基的磷酸化能够激活AMPK,AMPK磷酸化激活后可通过磷酸化乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)、抑制核转录因子固醇调控元件结合蛋白(sterol regulatory element binding protein,SREBP)而降低脂肪酸合成酶(fatty acid synthase,FAS)的活性,减少脂肪酸的合成;通过激活CPT-1来增强线粒体对脂肪酸的利用和氧化,从而促进分解代谢反应[33]。同时,AMPK的磷酸化激活可靶向HMG-CoA还原酶来抑制胆固醇合成(AMPK是HMG-CoA还原酶的上游调节器)[34-35]。Shin等[35]利用椪柑皮醇提物处理油酸诱导的HepG2细胞,发现其能抑制肝细胞中的脂质聚集,激活AMPK及其下游目标蛋白ACC的磷酸化,并通过测定与脂质代谢相关蛋白的表达情况总结出4 条通过激活AMPK调节脂质代谢的途径:1)激活下游蛋白CPT-1的表达来促进脂肪酸氧化;2)抑制ACC的表达和活性来减少脂质生成;3)抑制HMG-CoA还原酶来减少胆固醇合成;4)通过抑制SREBP-1c来降低FAS的表达从而减少脂肪生成。Pu Peng等[36]建立了高脂膳食小鼠模型,柚皮苷喂养20 周后,发现柚皮苷能抑制脂肪酸的生物合成和增加脂肪酸氧化,并上调AMPK及其信号通路,这也是其有效防止代谢综合征发展的主要作用机制。
1.4 抗癌活性
研究证实,柑橘类黄酮是一类可降低患癌风险的天然活性物质,其发挥抗癌活性的机制主要包括:减少并修复DNA氧化损伤、抑制肿瘤细胞增殖和转移、诱导肿瘤细胞凋亡和阻滞细胞周期、抑制血管生成、参与凋亡蛋白(Caspase)依赖途径和线粒体通路等[37]。Li Jinjiang等[38]发现,用柚皮苷处理脑胶质瘤细胞U87 MG,可通过抑制黏着斑激酶(focal adhesion kinase,FAK)周期蛋白D1通路来抑制细胞增殖,通过影响FAK/bads通路来促进细胞凋亡,通过抑制FAK/mmps通路来阻止肿瘤细胞侵袭和转移;因此,抑制黏着斑激酶活性是柚皮苷发挥抗脑胶质瘤功效的一条有效途径。Nagappan等[39]从瓶橘(Citrus platymamma)中分离出类黄酮混合物并用其处理人肺癌细胞A549,发现其能抑制A549细胞的增殖且呈量效关系,还可显著增加sub-G1期、G2/M期和凋亡的细胞数量,使部分细胞核凝结和碎片化,并能下调一系列与癌细胞增殖相关的周期蛋白的表达。因此,瓶橘类黄酮通过阻滞A549细胞G2/M期抑制细胞增殖和激活凋亡蛋白Caspase-3促使细胞凋亡来发挥抗肺癌功效。生长抑制与DNA损伤诱导蛋白α(growth arrest and DNA-damage-inducible protein α,GADD45α)作为DNA损伤的标志性蛋白,可通过JNK和p38途径诱导肿瘤细胞凋亡,Lee等[40]认为川陈皮素、橘皮素等多甲氧基黄酮能以独立于p53途径(报道称该途径可上调GADD45α以应对DNA损伤)之外的方式上调GADD45α转录和表达水平来发挥抗增殖作用。血管生成是肿瘤增殖和扩散的基础,基质金属蛋白酶(matrix metalloproteinases,MMPs)和血管内皮生长因子(vascular endothelial growth factor,VEGF)与新血管生成紧密相关,靶向这两种蛋白的治疗方案将有希望控制癌症进一步发展[9],Lien等[41]研究表明,川陈皮素可在神经胶质瘤细胞中通过抑制胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和蛋白激酶B(protein kinase B,Akt)的激活及下调MMP-2和MMP-9的表达发挥抗肿瘤转移活性,另有研究表明,川陈皮素在前列腺癌细胞PC-3中通过下调AKT/HIF-1α信号通路减少VEGF和NF-κB的蛋白表达,可有效抑制细胞活性,降低患癌风险[42]。
1.5 神经保护活性
研究证实,川陈皮素和橘皮素等多甲氧基黄酮可通过改善脑内类胆碱不足、β淀粉样蛋白非正常聚集、天冬氨酸受体功能衰退和缺血性损伤,阻止tau蛋白的过度磷酸化,提高脑啡肽酶水平等方式防治阿尔茨海默病、帕金森综合征等神经退行性疾病[43]。在中枢神经系统中,小胶质细胞的激活会释放促炎因子,造成神经炎和神经细胞的死亡。Wu等[44]用柚皮素处理小鼠小胶质细胞BV-2和N2a,发现其能通过AMPKα和PKCδ信号通路抑制NO和促炎因子的释放,减弱iNOS、COX-2等与炎症发生相关蛋白的表达,同时诱导细胞因子信号抑制基因(suppressor of cytokine signaling,SOCS)-3的表达,以此抑制神经炎症反应,保护中枢神经系统。Mohd等[45]利用大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)大鼠模型发现,在诱发MCAO之前口服橙皮苷(50 mg/kg mb)预处理15 d,可显著改善中风后脑梗塞和神经损伤程度,并证明橙皮苷的神经保护作用与其清除自由基和减少炎症反应的活性相关。另有诸多报道称,柑橘类黄酮是通过抗氧化活性以外的作用保护神经细胞免受氧化应激[46],如Vauzour等[47]认为,橙皮素能有效抑制氧化应激诱导的神经细胞凋亡并非因其抗氧化性,而是通过对神经细胞凋亡机制的调节发挥神经保护作用,主要包括激活/Akt和胞外信号调节激酶1/2这两条信号通路抑制细胞凋亡相关蛋白的活化。综上所述,柑橘类黄酮的神经保护作用与其抗氧化、抗炎和能触发多条细胞内促生存的信号通路紧密相关。
2 提高柑橘类黄酮生物利用度的技术方法
无论是食品还是药品,口服是最容易、方便也是采用最多的一种摄入方式。通常,限制活性成分口服生物利用度的因素可分为三大类:生物可及性、吸收率和代谢转化率。生物可及性取决于活性成分从食品基质中的释放和在胃液中的溶解情况,吸收率是指穿过黏液层进入上皮细胞经转化后流出的活性成分的比例,代谢转化则是活性成分穿过胃肠道上皮细胞进入血液并分散到各个组织器官后发生的一系列结构变化[12]。多数柑橘类黄酮在体外实验中表现出非常好的生物活性,但因其较差的溶解性和吸收性,直接影响这些活性成分在生物体中的生物利用度,无法发挥应有功效,故而需采用一定的技术手段提高其生物利用度。
2.1 环糊精包埋法
环糊精(cyclodextrin,CD)是一类具有三维中空环状结构的低聚糖,可将物质疏水性部分包裹在非极性的空腔中,亲水性部分暴露在外端与环糊精的羟基一同增加整体的水溶性,并且无毒害,对光、热、碱稳定,常被用作活性物质的包埋材料[48]。因β-CD在水中的溶解度较低(室温下仅为1.85%),且可能有溶血作用,故常使用其衍生物来替代,主要包括甲基-β-CD(M-β-CD)、二甲基-β-CD(DM-β-CD)、三甲基-β-CD(TM-β-CD)、磺丁醚-β-CD(SBE-β-CD)和羟丙基-β-CD(HP-β-CD)等。
Shulman等[49]使用HP-β-CD包埋柚皮素,使其溶解度从(36±1)μmol/L增加到(15.8±1.4)mmol/L,提高了437 倍;采用Caco-2单层细胞模型评价包埋前后柚皮素的穿透性,从基底层中检测出柚皮素浓度由(0.04±0.02)μmol/L增加到(0.51±0.07)μmol/L,HP-β-CD使其细胞穿透率提高11 倍;通过建立大鼠模型,分别灌胃柚皮素和HP-β-CD包埋的柚皮素,取血液分析,发现包埋前后其药物代谢速率增加7.4 倍,血液中柚皮素最大浓度增加14.6 倍,证明HP-β-CD能显著提高柚皮素的生物利用度。Yang Lijuan等[50]利用β-CD及其衍生物DM-β-CD、TM-β-CD和HP-β-CD等包埋橙皮素,通过X射线衍射、差示扫描量热法、扫描电子显微镜、1H和2D核磁共振以及紫外-可见光谱等技术手段,全方位评价了包合物的结构特性、包埋方式以及溶解性、稳定性等。结果显示,这些包埋方式均能显著提高橙皮素的水溶性和稳定性。
2.2 酶处理法
柑橘类黄酮通常是以糖苷形式天然存在,主要包括新橙皮糖苷、芸香糖苷和葡萄糖苷等类型。单糖形式的葡萄糖苷可在小肠中被β-葡萄糖苷酶水解;二糖形式存在的新橙皮糖苷和芸香糖苷(如橙皮苷、柚皮苷等)需要到结肠中,在肠道微生物的作用下水解糖苷键,释放相应苷元[51]。柑橘类黄酮只有以苷元或葡萄糖苷的形式存在时,才能在肠腔内被机体吸收,而橙皮素、柚皮素等大多数苷元因水溶性较差导致生物利用度不高。因此,可利用糖苷酶将二糖苷水解为溶解度较高且能在小肠部位被水解或在葡萄糖转运蛋白的作用下直接被吸收的葡萄糖苷,以提高其生物利用度。
Nielsen等[52]选择16 名健康的志愿者,令其随机食用控制橙皮素量的天然橙汁(低剂量)、经橙皮苷酶处理(生成橙皮素-7-O-葡萄糖苷)的橙汁(酶处理组)以及经强化比第一组橙皮苷剂量高3 倍的橙汁(高剂量组),结果显示酶处理组的志愿者血液中橙皮素的药时曲线面积比低剂量组高2 倍多,接近高剂量组水平;最大血浆浓度比低剂量组高4 倍多,比高剂量组高1.5 倍,且达到最大血浆浓度速率显著快于另外两组。这表明橙皮苷经酶处理转化为橙皮素-7-O-葡萄糖苷能显著提高其生物利用度。Lee等[53]使用酱油曲霉(Aspergillus sojae)的柚皮苷酶重复不间断地处理橙皮苷,主要获得橙皮素-7-O-葡萄糖苷,其在水中的溶解度相较于橙皮苷和橙皮素分别提高36、77 倍,故而生物利用度更高。同时,橙皮素-7-O-葡萄糖苷在抑制肠道中的麦芽糖酶和胆固醇合成中的关键酶——HMG-CoA还原酶的功效相较于其苷元和芸香糖苷均有显著提升。因此,经柚皮苷酶处理的橙皮苷具有更高的生物利用度和更强的生物活性。
2.3 脂质体运载体系
脂质体通常包括由磷脂构成的单个或多重层状球形结构。根据磷脂分子的双亲性,在水溶液中其疏水尾部聚集在一起,亲水头部暴露在水相中,形成单层微胶束或具有双分子层结构的封闭囊泡,双分子层中的疏水区域可用来装载非极性物质[12]。同时,脂质体的磷脂双分子层与生物膜的结构相似,易被组织吸收且无毒性,故可用于提高营养物质的生物可及性和吸收率。
Wolfram等[54]使用薄层蒸发技术制备脂质体并用来装载橙皮素,避免了有毒增溶试剂的使用,同时能使橙皮素在血浆中长时间保持稳定、免遭降解,且有较好的药物释放特性。橙皮素-脂质体复合物在H441肺癌细胞和MDA-MB-231乳腺癌细胞中显示出的抗增殖活性均显著高于单独使用橙皮素或脂质体,这可能由于脂质体能更好地与细胞膜融合,使包合物更易被细胞吸收而发挥更强功效。Wang Yuanwen等[55]使用薄膜水化分散法制备脂质体并装载柚皮素,装载率达72.2%。体外释放实验表明,柚皮素-脂质体复合物相较于柚皮素在盐酸溶液、醋酸盐缓冲液和磷酸盐缓冲液中的释放率均有显著提高;体内动物实验表明,依据药时曲线面积,脂质体运载体系能提高柚皮素的口服生物利用率约13.44 倍,且能显著提高柚皮素在以肝脏为主的各类器官中的分布浓度。因此,脂质体运载体系是改善柚皮素溶解性和提高其生物利用度的一种优良方法。
2.4 乳液运载体系
乳液运载体系是由2 种及以上互不相溶的液体相互混合而成,主要包括水/油和油/水两种类型,可用来保护活性成分以防其降解、提高溶解性以及促进其更好地被生物体吸收,从而提高营养物质的口服生物利用度[56]。Ting Yuwen等[57]利用乳液运载体系制备橘皮素乳浊液,发现其在结肠癌细胞系HCT116和HT29中的抗增殖活性有显著提升;通过构建结肠炎相关结肠肿瘤生成小鼠模型,证明乳液运载体系能有效增强橘皮素在体内的抗结肠癌发展和调节肿瘤相关蛋白表达的活性。体外和体内实验均证实乳液运载体系是提高橘皮素口服生物利用度的一种有效途径。
3 结 语
本文详述了柑橘类黄酮的主要生物学活性和提高其生物利用度的技术方法。柑橘类黄酮具有抗氧化、抗炎、调节脂质代谢、抗癌和神经保护等生物学活性,无论是体外细胞实验还是体内动物实验都将单体类黄酮在分子层面对多个靶标蛋白的表达和信号通路的影响研究得较为充分,但将不同类黄酮活性的差异与其分子结构的不同联系起来的系统研究,以及将多种具有同种活性的类黄酮共同使用来探究其协同或拮抗效应的研究较少。柑橘类黄酮较低的生物利用度极大地限制了其在体内发挥应有的生物学活性,但目前国内对提高其生物利用率的技术方法研究得非常少,并且现存方法都存在包埋或装载率较低的问题。未来除了从提高生物可及性、吸收率和生物转化率这三个层面研究新型技术方法外,还需不断优化制备工艺以提高装载率,并实现产业转化。

